Stellenwert selektiver RET-Inhibitoren beim Schilddrüsenkarzinom
Autor:
A.o. Univ.-Prof. Dr. Rainer W. Lipp, FACNM
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin, Graz
E-Mail: Rainer.lipp@medunigraz.at
Seit 2020 stehen mit Pralsetinib und Selpercatinib zwei selektive RET-Inhibitoren zur Behandlung eines progredienten papillären und follikulären Schilddrüsenkarzinoms oder eines medullären Schilddrüsenkarzinoms nach Erstlinientherapie mit einem Tyrosinkinaseinhibitor (TKI) zur Verfügung. Beide Substanzen haben seit 2020 eine FDA-Zulassung, Selpercatinib hat seit 2021 zusätzlich auch eine Zulassung durch die EMA.
Keypoints
-
RET-Genalterationen sind mit <10% bei fortgeschrittenem oder metastasiertem papillärem/follikulärem und 60 bis 100% bei medullärem Schilddrüsenkarzinom relativ häufig.
-
Mit Selpercatinib steht seit 2021 der erste in der EU zugelassene selektive RET-Inhibitor zur Verfügung.
-
Vor Therapieeinsatz ist der Nachweis einer RET-Fusion bei papillärem/follikulärem Schilddrüsenkarzinom oder einer RET-Mutation bei medullärem Schilddrüsenkarzinom notwendig.
-
Die zielgerichtete molekulare RET-Therapie zeigt in Phase-I/II-Studien einen anhaltenden Therapieeffekt bei gut kontrollierbarem Nebenwirkungsprofil.
Schilddrüsenkarzinome zählen mit 741 Neuerkrankungen pro Jahr zu den zehn häufigsten Tumorerkrankungen in Österreich.1 Die papillären und follikulären Schilddrüsenkarzinome (PTC/FTC), deren Name sich vom Schilddrüsenepithel (=Follikelzellen) ableitet, machen bei Frauen ca. 90% aller Schilddrüsenkarzinome und bei Männern ca. 80% aus.2 Abhängig von der Tumorgröße und dem Metastasierungsgrad wird eine Thyreoidektomie mit oder ohne Lymphadenektomie durchgeführt und je nach Tumorstadium eine zusätzliche ablative Radiojodtherapie mit 131Jod empfohlen.3 Das 10-Jahres-Überleben ist mit >90% ausgezeichnet.4
Das von den parafollikulären Schilddrüsenzellen ausgehende medulläre Schilddrüsenkarzinom (MTC) ist nicht Radiojod-sensitiv, tritt bei Männern mit 7% fast doppelt so häufig wie bei Frauen auf und kann primär nur durch eine Operation behandelt werden.2 Aufgrund der höheren Tumoraggressivität ist im Vergleich zu den epithelialen hochdifferenzierten Schilddrüsenkarzinomen häufiger mit Rezidiven bzw. Metastasierungen zu rechnen. Das 10-Jahres-Überleben beträgt 75%.4
Durch Genalterationen können verschiedene transmembrane Rezeptorkinasen des MAPK- oder PI3K-Weges aktiviert und andererseits der Natrium-/Jodid-Symportermechanismus, der für die Aufnahme von alimentärem und radioaktivem Jod veranwortlich ist, kann herunterreguliert werden. Beim Radiojod-refraktären fortgeschrittenen PTC/FTC und beim metastasierten MTC stehen in Österreich mit den Tyrosinkinaseinhibitoren Sorafenib und Levatanib beim PTC/FTC und Vandetanib und Cabozantinib beim MTC jeweils zwei zugelassene TKI zur palliativen Erstlinienbehandlung zur Verfügung.
Selektive RET-Inhibitoren
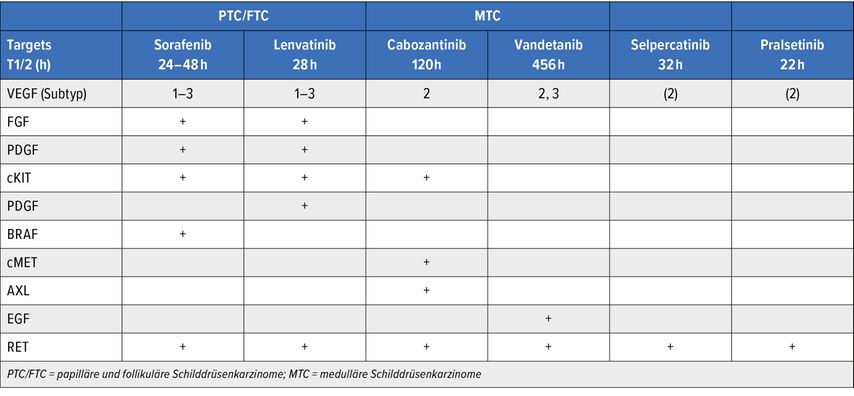
Voraussetzung für die Anwendung dieser neuen Substanzklasse ist der Nachweis einer RET-Fusion beim PTC/FTC. Eine solche kann bei bis zu 10% der Patienten nachgewiesen werden.5 Bei Kindern und jungen Erwachsenen können bis zu 30% RET-Fusionen nachgewiesen werden.6 Nach dem Reaktorunfall in Tschernobyl 1986 wurden RET-Fusionen in 58% der PTC/FTC nachgewiesen.7 CCD6-RET (RET/PTC1) & NCOA4-RET (RET/PTC3) sind die häufigsten RET-Fusionen, die mittels NGS („next-generation sequencing“), PCR („polymerase chain reaction“) oder FISH („Fluoreszenz in situ“- Methode) nachgewiesen werden können.8 Ca. 25% aller MTC sind vererbbar, treten im Rahmen einer multiplen endokrinen Neoplasie (MEN) 2A auf und zeigen bis zu 100% Keimbahnmutationen.4 Die am häufigsten vererbbare Keimbahnmutation ist die RET-C634-Mutation. 60% der sporadisch auftretenden MTC zeigen eine somatische Mutation. Die häufigste nachweisbare somatische Mutation ist die RET-M918T-Mutation.8 Ein großer Vorteil von Pralsetinib und Selpercatinib ist die selektive Blockade von RET und mit Einschränkungen des VEGF-2-Rezeptors, im Gegensatz zu Sorafenib/Lenvatinib bei PTC/FTC und Cabozantinib/Lenvatinib bei MTC, die zahlreiche Targets blockieren und daher ein vielseitiges Nebenwirkungsprofil entwickeln können (Tab.1).
Beide selektiven RET-Inhibitoren wurden jeweils in einer Phase-I/II-Studie (nicht randomisiert, open-label, Multi-Kohorten, Multicenter) untersucht.
ARROW-Trial
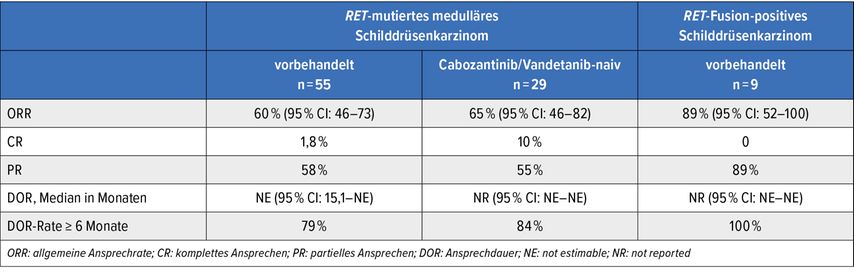
In der Pralsetinib-Studie (ARROW-Trial; NCT03037385) wurden Patienten mit fortgeschrittenem oder metastasiertem RET-Fusion-positivem nicht kleinzelligem Lungenkarzinom (NSCLC), RET-mutiertem medullärem SD-Karzinom und RET-Fusion-positivem SD-Karzinom in separaten Kohorten geführt.9 Patienten erhielten Pralsetinib 400mg 1x1 Tbl. tgl. p.o. bis zur Tumorprogression oder zum Auftreten einer inakzeptablen Toxizität. Die primären Endpunkte allgemeine Ansprechrate (ORR) und Ansprechdauer (DOR) wurden nach RECIST-v1.1-Kriterien zentral ausgewertet. Die Ergebnisse werden in Tabelle 2 zusammengefasst. Auffallend ist, dass Patienten mit MTC trotz intensiver Vorbehandlung mit Cabozantinib und/oder Vandetanib mit einer ORR von 60% ähnlich gut ansprachen wie jene, die keine TKI-Vorbehandlung hatten. In der kleinen Zahl RET-Fusion-positiver PTC fiel die ORR mit 89% noch höher aus. Ein Therapieansprechen über 6 Monate konnte zu ca. 80% bei MTC und 100% bei PTC gezeigt werden.
In einer Auswertung der häufigsten Nebenwirkungen (≥25%) von 438 Patienten, die auch Patienten mit NSCLC inkludierte, finden sich Obstipation, Bluthochdruck, Fatigue, muskuloskelettale Schmerzen und Durchfall. Die häufigsten laborchemischen Veränderungen (Grad 3 und 4) ≥2% waren Abnahme der Lymphozyten-, Neutrophilen-, Thrombozytenzahl, Abnahme von Hämoglobin, Abnahme von Kalzium und Phosphat sowie die Erhöhung der Leberfermente und der alkalischen Phosphatase.
LIBRETTO-001
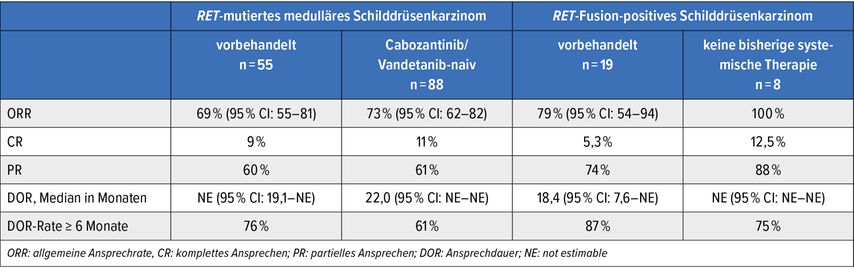
In der Selpercatinib-Studie (LIBRETTO-001; NCT03157128) wurden ebenfalls Patienten mit fortgeschrittenem oder metastasiertem RET-Fusion-positivem NSCLC, RET-mutiertem medullärem SD-Karzinom und RET-Fusion-positivem SD-Karzinom in separaten Kohorten geführt.10 Die Patienten erhielten Selpercatinib 160 mg 2x1 Tbl. tgl. p.o. bis zur Tumorprogression oder bis zum Auftreten einer inakzeptablen Toxizität. Die primären Endpunkte ORR und DOR wurden ebenfalls nach RECIST-v1.1-Kriterien zentral ausgewertet. Die Ergebnisse werden in Tabelle 3 zusammengefasst.
Auch unter Selpercatinib zeigten Patienten mit MTC trotz intensiver TKI-Vorbehandlung mit Cabozantinib und/oder Vandetanib mit 70% ORR ein ähnlich gutes Ansprechen wie jene, die keine Vorbehandlung erhalten hatten. Bei RET-Fusion-positiven Schilddrüsenkarzinomen konnte in der mit Sorafenib und/oder Lenvatinib vorbehandelten Gruppe ein ORR von 79% bzw. 100% erzielt werden. Das Therapieansprechen über 6 Monate war bei MTC und PTC in der TKI-vorbehandelten Gruppe jeweils um 10% höher als in der TKI-naiven Gruppe.
In einer Auswertung der häufigsten Nebenwirkungen (≥25%) von 702 Patienten, die auch Patienten mit NSCLC inkludierte, finden sich trockener Mund, Durchfall, Obstipation, Fatigue, Bluthochdruck, Hauttoxizität und Ödembildung. Die häufigsten laborchemischen Veränderungen (Grad 3 und 4) ≥2% waren Abnahme der Thrombozytenzahl, Abnahme von Kalzium und Natrium und eine Erhöhung der Leberfermente, der alkalischen Phosphatase und von Bilirubin und Glukose.
Auch wenn es noch keine publizierten Phase-III-Studiendaten mit Pralsetinib und Selpercatinib gibt, so scheint eine sehr gute Wirksamkeit und Verträglichkeit dieser neuen Substanzklasse gegeben zu sein. Permanente Therapieabbrüche aufgrund von Nebenwirkungen wurden für Pralsetinib nicht berichtet und werden für Selpercatinib mit nur 2% angegeben.
Literatur:
1 Statistik Austria. Online unter: www.statistik.at 2 Zentrum für Krebsregisterdaten - Robert Koch Institut. Online unter: www.krebsdaten.de 3 Sippel RS et al.: Current management of medullary thyroid cancer. Oncologist 2008; 13: 539-47 4 Luster M et al.: Guidelines for radioiodine therapy of differentiated thyroid cancer. Eur J Nucl Med Mol Imaging 2008; 35(10): 1941-59 5 Cancer Genome Atlas Research Network: Integrated genomic characterization of papillary thyroid cancer. Cell 2014; 159: 676-90 6 Vanden Borre P et al.: Pediatric, adolescent, and young adult thyroid carcinoma harbors frequent and diverse targetable genomic alterations, including kinase fusions. Oncologist 2017; 22: 255-63 7 Ricarte-Filho JC et al.: Identification of kinase fusion oncogenes in post-Chernobyl radiation-induced thyroid cancers. J Clin Invest 2013; 123: 4935-44 8 Mulligan LM: RET revisited: expanding the oncogenic portfolio. Nat Rev Cancer 2014; 14: 173-6 9 Subbiah V et al.: C Pralsetinib for patients with advanced or metastatic RET-altered thyroid cancer (ARROW): amulti-cohort, open-label, registrational, phase 1/2 study. Lancet Diabetes Endocrinol 2021; 9: 491-501 10 Wirth LJ et al.: Efficacy of Selpercatinib in RET-altered thyroid cancer. New Engl J Medicine 2020; 383: 825-35
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...