Spannende Daten zu aggressiven Lymphomen
Autor*innen:
Dr. med. Martina Bertschinger
Kantonsspital Winterthur
Mitglied der 2022 Young Oncology Academy der Schweizerischen Arbeitsgemeinschaft für Klinische Krebsforschung (SAKK)
E-Mail: martina.bertschinger@ksw.ch
Prof. Dr. med. Urban Novak
Inselspital/Universitätsspital Bern
Mentor der Young Oncology Academy der SAKK
E-Mail: urban.novak@insel.ch
Am diesjährigen Jahreskongress der European Hematology Association (EHA) in Wien wurden einige spannende Studien zur Behandlung von aggressiven Lymphomen präsentiert, insbesondere zu bispezifischen Antikörpern, zu einer vielversprechenden neuen CAR-T-Zell-Therapie in der Behandlung des r/r DLBCL sowie neue Daten zum Burkitt- und Mantelzelllymphom.
Keypoints
-
Bispezifische Antikörper bei r/r DLBCL zeigen eine vielversprechende Wirksamkeit bei vertretbarer Toxizität.
-
DA-EPOCH-R ist im Vergleich zu R-CODOX-M/R-IVAC beim Burkitt-Lymphom ähnlich gut wirksam, aber weniger toxisch.
-
Ibrutinib in Kombination mit Bendamustin/Rituximab verlängert bei älteren Patient*innen mit Mantelzelllymphom das PFS deutlich.
-
Die mittels T-chargeTM hergestellten CAR-T-Zellen sind ein vielversprechendes neues CAR-T-Zell-Konstrukt.
Vielversprechende Daten zu bispezifischen Antikörpern in der Behandlung des r/r DLBCL
Epcoritamab bei stark vortherapierten Patient*innen
In der Plenary Session wurde von Catherine Thieblemont ein Late Breaking Abstract zu Epcoritamab, einem subkutan verabreichten bispezifischenCD20xCD3-IgG1-Antikörper, präsentiert.1 In der Open-Label-Phase-II-Studie EPCORE NHL-1 wurden Patient*innen mit CD20+ reifen B-Zell-Lymphomen, welche mindestens zwei Vortherapien erhalten hatten, behandelt. Eine vorangegangene CAR-T-Zell-Therapie war erlaubt. Primärer Endpunkt war die Ansprechrate. Die 157 eingeschlossenen Patient*innen waren stark vortherapiert, 71% hatten mindestens 3 Therapielinien und 39% eine frühere CAR-T-Zell-Therapie. Das mediane Follow-up betrug 10,7 Monate.
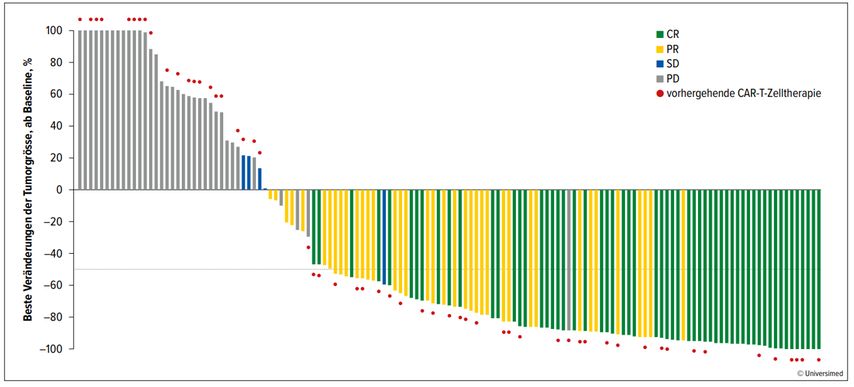
Es konnte eine Gesamtansprechrate (ORR) von 63% mit einer Komplettremissionsrate (CR) von 39% erreicht werden. Patienten, die eine frühere CAR-T-Zell-Therapie erhalten haben, scheinen ebenfalls von der Therapie mit Epcoritamab zu profitieren, wenn auch die CR-Rate niedriger lag bei der CAR-T-Zell-vortherapierten Population (CR ohne CAR-T-Zell-Vortherapie 42%, CAR-T-Zell-Vortherapie 34% bei CAR-T-Zell-Therapie-Refraktärität 28%). Abbildung 1 gibt einen Überblick über das Ansprechen der Patient*innen auf Epcoritamab.
Die meisten Nebenwirkungen durch Epcoritamab waren vom Grad 1–2. Die häufigste, das Zytokinfreisetzungssyndrom (CRS), trat bei 49,7% der Patient*innen auf, nur bei 2,5% in Grad 3. Am häufigsten trat das CRS nach der ersten vollen Dosis Epcoritamab auf.
Epcoritamab plus R-CHOP?
Neue Daten zu Epcoritamab gab es nicht nur zur Mono-, sondern auch zur Kombinationstherapie. In EPCORE-NHL-2, einer Phase-I/II-Studie, wird Epcoritamab in Kombination mit verschiedenen Standardtherapien untersucht, wobei im Arm A Patient*innen mit Hochrisiko-DLBCL (3–5 Punkte R-IPI) mit der Kombination Epcoritamab plus R-CHOP behandelt werden. In der Poster-Session wurde ein Update der noch laufenden Studie präsentiert.2 Es zeigte sich ein vielversprechendes Therapieansprechen (ORR 100%) bei akzeptablem Toxizitätsprofil, sodass Epcoritamab in Kombination mit R-CHOP als Erstlinientherapie wohl weiter untersucht werden wird.
Glofitamab in fixer Therapiedauer
Eine weitere Studie zu bispezifischen Antikörpern wurde von Michael Dickinson vorgestellt.3 Diese Phase-II-Studie untersuchte die Wirksamkeit von Glofitamab, einembispezifischenCD20xCD3-2:1-IgG1-Antikörper. Bemerkenswert an dieser Studie ist, dass eine fixe Therapiedauer (maximal zwölf Zyklen) gewählt wurde. Eingeschlossen wurden Patient*innen mit DLBCL,transformiertem follikulärem Lymphom, aggressivem B-Zell-Lymphom und primär mediastinalem B-Zell-Lymphom. Die Patient*innen hatten in 59% der Fälle ≥3 Vortherapien, 33% eine CAR-T-Zelltherapie, 18% eine autologe Stammzelltransplantation (ASCT).
In dieser stark vortherapierten Population konnte durch die Gabe von Glofitamab eine ORR von 51,6% bei einer CR-Rate von 39,4% erreicht werden. Zur Abschwächung von Nebenwirkungen, insbesondere des zu erwartenden CRS, wurden eine Obinutuzumab-Vortherapie (1x1000mg) und im Zyklus 1 eine ansteigende Dosierung von Glofitamab (2,5 und 10mg, bei Zieldosis von 30mg ab Zyklus 2) gewählt. Bei 63% trat ein CRS auf, jedoch war dieses meist milde (nur 3,6% CRS Grad 3–4).
Ähnliche Daten zu Mosunetuzumab und Odronextamab
Bereits vor dem EHA-Kongress wurden zwei Phase-I-Studien zu weiterenbispezifischen CD20xCD3-Antikörpern (Monsunetuzumabund Odronextamab)publiziert,4,5 wobei in beiden Studien alle Non-Hodgkin-Lymphom-Entitäten eingeschlossen wurden. Deckend mit den nun publizierten Daten zu Epcoritamab und Glofitamab zeigten sich auch bei Mosunetuzumab und Odronextamab ähnliche Ansprechraten und Toxizitäten.
Abb. 1:Waterfall-Plot der Behandlung von Patient*innen mit r/r DLBCL mit Epcoritamab. CR: Komplettremission; PR: partielle Remission; SD: stabile Erkrankung; PD: fortschreitende Erkrankung. Modifiziert nach Thieblemont et al.1
Fazit
Die Phase-I/II-Studien zu den bispezifischen Antikörpern zeigen vielversprechende Ansprechraten bei Patient*innen mit stark vorbehandelten r/r DLBCL inklusive vorangehender CAR-T-Zell-Therapie. Studien zu bispezifischen Antikörpern in frühen Linien und in Kombinationen mit Chemo-Immuntherapie sind initiiert, und die Resultate werden mit Spannung erwartet.
DA-EPOCH-R vs. R-CODOX-M/R-IVAC beim Burkitt-Lymphom
In dieser multizentrischen akademischen Phase-III-Studie wurden zwei verschiedene Chemotherapie-Regime miteinander verglichen: R-CODOX-M/R-IVAC versus DA-EPOCH-R.6 Eingeschlossen wurden Patient*innen (18–75 Jahre) mit unbehandeltem Hochrisiko-Burkitt-Lymphom. Hohes Risiko war definiert durch:
-
Erhöhung der LDH,
-
WHO Performance Score (PS) ≥2,
-
Stadium III/IV oder
Masse ≥10cm.
Die Patient*innen erhielten entweder zwei Zyklen R-CODOX-M/R-IVAC oder 6 Zyklen DA-EPOCH-R. Aufgrund einer langsamen Rekrutierung musste diese Studie nach 84 randomisierten Patient*innen vorzeitig geschlossen werden. Die mediane Beobachtungszeit betrug 19,1 Monate.
Die Therapie mit DA-EPOCH-R führte zu vergleichbaren Raten an kompletten metabolischen Remissionen (CMR) wie R-CODOX-M/R-IVAC (komplette metabolische Remission bei 66% versus 65%). Die vorläufigen Überlebensraten sind identisch (2-Jahres-OS für R-CODOX-M/R-IVAC 75% und für DA-EPOCH-R 76%). Die Therapie mit DA-EPOCH-R wurde jedoch deutlich besser vertragen (weniger Infekte, Komplikationen, Transfusionen und Hospitalisationstage).
Hinzunahme von Ibrutinib führt zur PFS-Verlängerung beim «de novo» Mantelzelllymphom
In der randomisierten, doppelblinden Phase-III-Studie SHINE, präsentiert von Michael Wang, wurde die zusätzliche Gabe von Ibrutinib zur Standardtherapie mit Bendamustin und Rituximab bei älteren Patient*innen (definiert als nicht intensiv therapierbar) mit bisher unbehandeltem Mantelzelllymphom untersucht.7
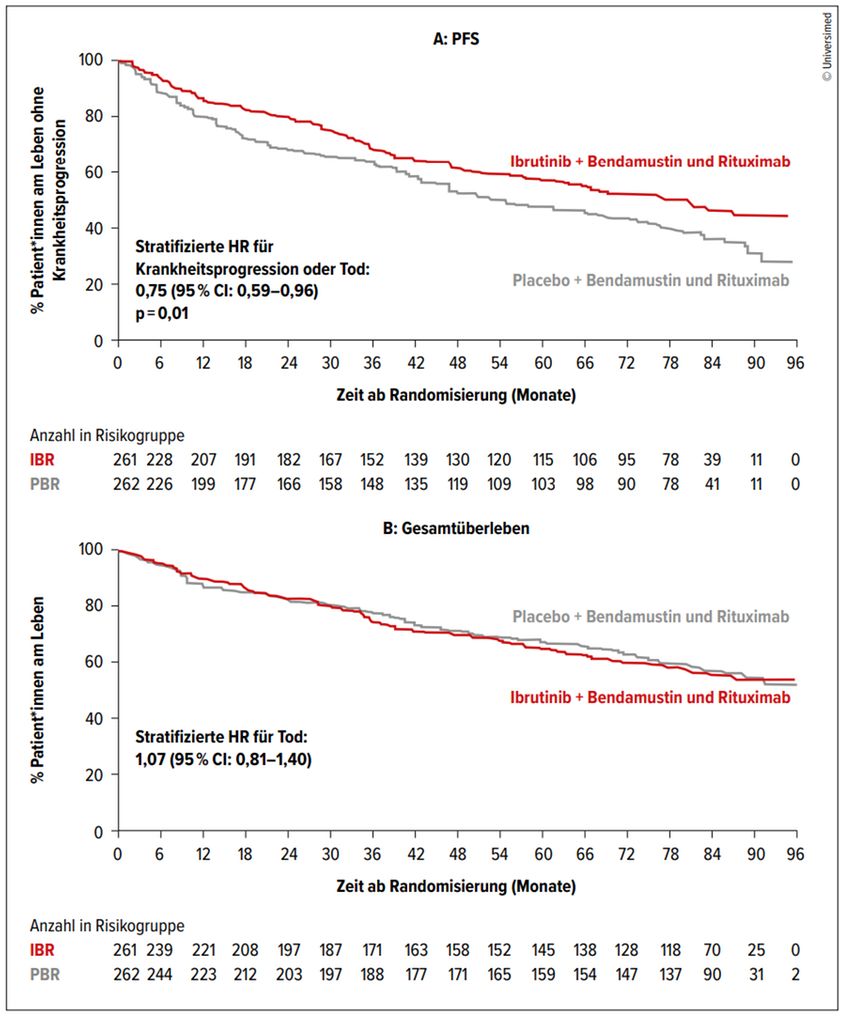
Der primäre Endpunkt, das mediane PFS, konnte durch die Hinzugabe von Ibrutinib deutlich verlängert werden (80,6 Monate versus 52,9 Monate, HR: 0,75; p=0,01; Abb. 2A). Bezüglich des Gesamtüberlebens («overall survival», OS) konnte nach einem medianen Follow-up von 84,7 Monaten (0,1–97,5 Monate) jedoch kein signifikanter Unterschied zwischen den Gruppen gezeigt werden (Abb. 2B); das mediane OS wurdenoch nicht erreicht.
Bezüglich der Toxizität waren keine unerwarteten Effekte durch die Kombination zu beobachten (Grad-3/4-Nebenwirkungen durch Bendamustin und Rituximab bei 77,3% und in Kombination mit Ibrutinib bei 81,5%).
Die anschliessende Diskussion hat gezeigt, dass die Meinungen, ob eine deutliche PFS-Verlängerung ohne bisher demonstrierten OS-Unterschied reicht, um die Kombinationstherapie der sequenziellen Therapie vorzuziehen, auseinandergehen.
T-chargeTM-CAR-T-Zellen bringen Vorteile für die Patient*innen
Michael Dickinson präsentierte auch eine Phase-I-Studie zu einem neuen CD19- gerichteten CAR-T-Zell-Produkt, YTB363 von Novartis.8 Die mittels der Plattform T-chargeTM hergestellten CAR-T-Zellen sollen ihre Stammzelleigenschaften bewahren und somit effektiver und länger anhaltend wirken. Ein weiterer Vorteil eines mittels T-chargeTM hergestellten CAR-T-Zell-Produkts ist die kürzere Herstellungszeit (<2d).9
In der präsentierten Studie wurden insgesamt 45 r/r DLBCL-Patient*innen mit mindestens 2 Vortherapien (inklusive Hochdosistherapie mit ASCT) eingeschlossen und bisher über median 10 Monate (0,3–29 Monate) beobachtet. Die Studie zeigt im Dosislevel 2 (12,5x106 Zellen) eine vielversprechende und anhaltende Effektivität (ORR 69% bei CR 65%) bei akzeptablem Toxizitätsprofil (CRS Grad 3/4 von 4% und ICANS [«immune effector cell-associated neurotoxicity syndrome»] Grad 3/4 bei 7,1%).
Bezüglich des Designs muss hervorgehoben werden, dass die Dosis der depletierenden/konditionierenden Chemotherapie im Vergleich zu anderen Studien erhöht wurde (Cyclophosphamid 500mg/m2 und Fludarabin 30mg/m2). Eine Phase-III-Studie wurde angekündigt, wobei der Vergleichsarm noch nicht bekannt gegeben wurde. Schliesslich bleiben die Daten der Phase-II/III-Studie abzuwarten. Eine deutlich verkürzte Produktionszeit von 2 Tagen würde die klinische Anwendung dieses CAR-T-Zell-Produktes wesentlich vereinfachen und möglicherweise den Bedarf an Bridging-Behandlungen reduzieren.
Abb. 2: Die Hinzunahme von Ibrutinib zur Standardtherapie (Rituximab und Bendamustin) bei älteren Patient*innen mit unbehandeltem Mantelzelllymphom führt zu einem deutlichen PFS-Unterschied (A), jedoch ist nach einem Beobachtungszeitraum von 84,7 Monaten kein Überlebensvorteil zu erkennen (B). Modifiziert nach Wang M et al.7
Literatur:
1 Thieblemont et al.: Subcutaneous epcoritamab in patients with relapsed or refractory large B-cell Lymphoma(EPCORE NHL-1): Pivotal results from a phase 2 study. EHA 2022; Abstr. #LB2364 2 Clausen M et al.: Subcutaneous epcoritamab+ R-CHOP for first-line treatment of patients with high-risk diffuse large B-cell lymphoma: Phase 1/2 update. EHA 2022; Abstr. #1214 3 Dickinson M et al.: Glofitamab induces durable complete remissions and has favorable safety in patients with relapsed/refractory diffuse large B-cell lymphoma and ≥2 prior therapies: pivotal phase II expansion results. EHA 2022; Abstr. #S220 4 Budde LE et al.: Single-agent mosunetuzumab shows durable complete responses in patients with relapsed or refractory b-cell lymphomas: phase I dose-escalation study. J Clin Oncol 2022; 40(5): 481-91 5 Bannerji R et al.: Odronextamab, a human CD20×CD3 bispecific antibody in patients with CD20-positive B-cell malignancies (ELM-1): results from the relapsed or refractory non-Hodgkin lymphoma cohort in a single-arm, multicentre, phase 1 trial. Lancet Haematol 2022; 9(5): e327-39 6 Chamuleau M et al.: R-CODOX-M/R-IVAC versus dose-adjusted(DA)-EPOCH-R in patients with newly diagnosed high-risk Burkitt lymphoma; first results of a multi-center randomized HOVON/SAKK TRIAL. EHA 2022; Abstr. #LB2370 7 Wang M et al.: Ibrutinib plus bendamustine and rituximab in untreated mantle-cell lymphoma. N Engl J Med 2022; 386(26): 2482-94 8 Dickinson M et al.: Phase I study of YTB323, a chimeric antigen receptor (CAR)-T cell therapy manufactured using T-chargeTM, in patients with relapsed/refractory diffuse large b-cell lympoma. EHA 2022; Abstr. #S212 9 Engels et al.: Preservation of T-cell stemness with a novel expansionless CAR-T manufacturing process, which reduces manufacturing time to less than two days, drives enhanced CAR-T Cell Efficacy. ASH 2021; Abstr. #2848
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...