Schwere Hämophilie A ohne Inhibitoren: Invasive Eingriffe unter Emicizumab-Prophylaxe
Autor:
Dr. med. Lukas Graf
Stv. Chefarzt, Leiter Hämophilie- und Hämostasezentrum
Zentrum für Labormedizin, St. Gallen
E-Mail: lukas.graf@zlmsg.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Therapie der Hämophilie A hat sich in den letzten Jahren deutlich gewandelt. Neben diversen Faktor-VIII-Produkten mit verlängerter Halbwertszeit ist seit einiger Zeit mit dem bispezifischen Antikörper Emicizumab erstmals auch eine Nicht-Faktor-Therapie zur Prophylaxe bei Patienten mit kongenitaler Hämophilie A mit und ohne Hemmkörper zugelassen. Emicizumab ist zweifellos eine extrem wertvolle und mittlerweile bereits bei vielen Patienten erfolgreich eingesetzte Ergänzung der therapeutischen Optionen bei Hämophilie A. In speziellen Situationen, insbesondere bei invasiven Eingriffen, stellt die Substanz die Behandelnden jedoch vor völlig neue Herausforderungen. Der Einfachheit halber wird im Folgenden primär das perioperative Prozedere bei Patienten mit Hämophilie A ohne Inhibitoren unter Emicizumab diskutiert.
Keypoints
-
In den letzten Jahren haben sich die Behandlungsoptionen für Hämophilie A (und B) vervielfacht. Emicizumab ist die erste zugelassene Nicht-Faktoren-Therapie für die Blutungsprophylaxe bei Hämophilie A.
-
Mehr Behandlungsoptionen bedeuten auch eine höhere Komplexität bei invasiven Eingriffen.
-
Es ist ein spezifisches Wissen für den perioperativen Einsatz der Hämophilietherapien sowie für das Labormonitoring und die Interpretation des Gerinnungslabors notwendig.
-
Längere Halbwertszeiten erlauben grundsätzlich ein sicheres perioperatives Gerinnungsmanagement. Zwingend ist eine gute Kommunikation zwischen Hämophiliebehandler, Labor, Anästhesist, Operateur und Patient.
Hämophilie A und Blutungsprophylaxe
Bei Menschen mit normaler Blutgerinnung bildet der Gerinnungsfaktor VIII (FVIII) zusammen mit dem Gerinnungsfaktor IX (FIX) den Tenasekomplex. Dieser Komplex, mit FIX als Enzym und FVIII als Coenzym, agiert im Gerinnungssystem wie eine Verstärkerschlaufe und ist in der Lage, Gerinnungsfaktor X sehr effizient zu aktivieren. Diese Aktivierung führt über einen weiteren Schritt zur massiven Generierung von Thrombin («Thrombin-Burst») und letztlich zur Umwandlung von Fibrinogen in Fibrin.
Bei einem Patienten mit schwerer Hämophilie A fehlt FVIII. Deshalb kann der Tenasekomplex nicht gebildet werden und der Thrombin-Burst bleibt aus. Als Resultat haben diese Patienten eine deutlich verlangsamte Blutgerinnung und leiden unbehandelt an einer schweren Blutungsneigung mit Spontanblutungen, insbesondere in die Gelenke.
Die moderne Hämophiliebehandlung hat zum Ziel, Spontanblutungen zu verhindern. Bislang wurde diese Blutungsprophylaxe durch regelmässige Gabe von aus Spenderplasma gewonnenem oder rekombinant hergestelltem FVIII erzielt. Limitierend bei dieser Therapie ist jedoch die relativ kurze Halbwertszeit von FVIII, die beim Erwachsenen nur rund zwölf Stunden beträgt. In den letzten Jahren wurden verschiedene Halbwertszeit-verlängerte FVIII-Konzentrate eingeführt, die immerhin Halbwertszeiten von rund 18 Stunden aufweisen und dadurch eine bessere und komfortablere Blutungsprophylaxe ermöglichen. Alle diese FVIII-Konzentrate müssen intravenös verabreicht werden.
Da Antikörper Halbwertszeiten von mehreren Wochen aufweisen und zudem auch subkutan appliziert werden können, wären Therapieansätze auf Basis von Antikörpern in der Lage, das Gerinnungssystem sehr lange und konstant zu beeinflussen. Ein solches Antikörper-basiertes Therapeutikum ist der bispezifische Antikörper Emicizumab. Diese Substanz ist in der Schweiz zur Blutungsprophylaxe bei Hämophilie A mit und ohne Inhibitoren zugelassen.1
Emicizumab
Der rekombinant hergestellte monoklonale Antikörper Emicizumab imitiert die Funktion des Gerinnungsfaktors VIII, indem er sowohl an den aktivierten Gerinnungsfaktor IX (FIXa) als auch an den Gerinnungsfaktor X (FX) binden kann. Dies bringt diese beiden Faktoren so weit in räumliche Nähe, dass der FIXa in der Lage ist, den FX zu aktivieren.2 Dadurch wird die Funktion des Tenasekomplexes als Verstärkerschlaufe des Gerinnungssystems wiederhergestellt.
Die Sache hat jedoch leider insofern einen Haken, als Emicizumab nicht gleich effizient ist wie der physiologische FVIII. Im Labor ist es allerdings sehr schwierig, den wahren hämostatischen Effekt von Emicizumab zu erfassen, da die Substanz die funktionellen Gerinnungstests artifiziell übermässig stark beeinflusst.
Auf der Basis von diversen Daten aus Tierversuchen, komplexen Messungen im Labor sowie aus Erfahrungen mit der Blutungsprophylaxe beim Menschen werden für Emicizumab FVIII-Äquivalente zwischen 10 und 30% diskutiert.1 Wegen der sehr langen Halbwertszeit kann dieser Wert durchgehend sehr konstant erreicht werden, indem die Substanz je nach verwendetem Schema wöchentlich, zweiwöchentlich oder alle vier Wochen subkutan gespritzt wird.
Dies ist ein deutlicher Unterschied zur Therapie mit klassischen FVIII-Konzentraten, die wegen der viel kürzeren Halbwertszeit meistens mehrmals pro Woche gespritzt werden müssen und bei denen die FVIII-Werte einer starken Wellenbewegung (Berg- und Talspiegel) unterliegen.
Vereinfacht gesagt ist Emicizumab somit in der Lage, aus einem Patienten mit Hämophilie A und spontanen Blutungen einen Patienten mit sehr milder Hämophilie A ohne spontane Blutungen zu machen. Die meisten Patienten erleben denn auch unter Therapie mit Emicizumab einen praktisch blutungsfreien Alltag. Die Tatsache, dass Emicizumab das Gerinnungssystem nicht vollständig normalisieren kann, führt jedoch zu ganz neuen Herausforderungen bei invasiven Eingriffen.
Emicizumab und Gerinnungslabor
Um das perioperative Vorgehen besser verstehen zu können, müssen wir einen kurzen Exkurs in die Gerinnungsdiagnostik machen. Wie oben erwähnt beeinflusst Emicizumab einige Gerinnungstests in vitro übermässig stark. Im Besonderen davon betroffen sind die aktivierte partielle Thromboplastinzeit (aPTT) und die aPTT-basierte FVIII-Aktivität.
Die aPTT ist unter Emicizumab deutlich verkürzt und im aPTT-basierten Testsystem werden massiv erhöhte FVIII-Werte gemessen (im «steady state» erfahrungsgemäss Werte um 500–1000%; Norm: 50–150%). Diese Werte repräsentieren jedoch nicht die Gerinnungskapazität in vivo, die deutlich niedriger liegt (siehe oben).
In den chromogenen Gerinnungstests für FVIII führt Emicizumab in Abhängigeit vom verwendeten Testkonzept zu sehr unterschiedlichen Resultaten. In den chromogenen Testsystemen sind FIXa und FX im Überschuss vorhanden, sodass die Reaktion des Systems nur vom FVIII im Patientenplasma abhängt. Die entsprechende Zugabe führt über die Aktivierung von FX zur Spaltung einer chromogenen Substanz und somit zur Generierung eines Signals, das proportional zum Faktor VIII im Testsystem ist.
Das chromogene Testsystem wird sowohl mit humanen als auch mit bovinen FIXa und FX angeboten. Die erste Version ist ähnlich sensitiv auf Emicizumab wie die aPTT-basierte FVIII-Messung, die zweite Version wird durch Emicizumab gar nicht beeinflusst. Deshalb können chromogene Testsysteme mit bovinen Substraten verwendet werden, um bei Patienten unter Emicizumab die zusätzliche Gabe von FVIII-Konzentraten zu überwachen, zum Beispiel in perioperativen Situationen.1
Zulassungsstudien und perioperative Eingriffe
In vier Zulassungsstudien für Emicizumab (HAVEN 1–4) wurden insgesamt 288 invasive Eingriffe erfasst.3 Davon waren 215 kleinere Eingriffe bei 115 verschiedenen Patienten und 18 grössere Eingriffe bei 18 verschiedenen Patienten. Die kleineren Eingriffe umfassten zum Beispiel Zahneingriffe, endoskopische Eingriffe, Gelenkspunktionen und das Anbringen von zentralvenösen Zugängen. Bei den grösseren Eingriffen handelte es sich vorwiegend um Gelenksersatzoperationen und Synovektomien.
Zwei Drittel der kleineren Eingriffe wurden lediglich unter Emicizumab durchgeführt und in der grossen Mehrheit (über 90% der Fälle) war auch postoperativ keine zusätzliche Faktorengabe notwendig. Bei rund einem Drittel der kleineren Eingriffe wurde zusätzlich präinterventionell einmalig ein Faktorenkonzentrat verabreicht und auch in diesen Fällen war nur selten (bei rund 10% der Eingriffe) postoperativ eine zusätzliche Faktorengabe notwendig.
Es muss berücksichtigt werden, dass die sehr heterogene Gruppe der kleineren Eingriffe auch mit unterschiedlichen Blutungsrisiken vergesellschaftet ist. Da in den Studien kein periinterventioneller Behandlungsalgorithmus vorgegeben war, wurden diese Risiken von den Behandlern der Studienpatienten unterschiedlich bewertet. Entsprechend erfolgte auch die Gabe von Faktorenkonzentraten sowie deren Dosierung nach unterschiedlichen Kriterien.
Wichtig in diesem Kontext ist, dass die zusätzliche Gabe von FVIII-Konzentraten bei Behandlung mit Emicizumab nicht zu einem additiven Effekt führt, da Emicizumab eine deutlich geringere Affinität zu FIXa und FX hat als der physiologische FVIII. Deshalb kann durch zusätzliche FVIII-Gabe das Gerinnungssystem vorübergehend korrigiert werden, ohne dass ein erhöhtes Thromboserisiko in Kauf genommen werden muss. Dies ist insbesondere bei grösseren invasiven Eingriffen, bei denen eine vollständig normalisierte Gerinnung erforderlich ist, von grossem Nutzen.
Bei den 18 grösseren operativen Eingriffen in den Studien HAVEN 1–4 wurden lediglich drei ohne zusätzliche Gabe eines FVIII-Konzentrats durchgeführt und es traten bei allen keine Blutungskomplikationen auf. Bei diesen drei Eingriffen handelte es sich um Eingriffe mit relativ kleinem Blutungsrisiko: eine Synovektomie, eine offene Reduktion einer Femurfraktur und eine Muskelnaht.
Alle anderen grösseren Eingriffe (über 80%), davon die Hälfte Operationen an Gelenken, wurden unter Gabe von FVIII-Konzentraten über mehrere Tage und ununterbrochenem Weiterführen der Emicizumab-Prophylaxe durchgeführt. Auch diese Eingriffe erfolgten ohne grössere postoperative Blutungen und insbesondere auch ohne thromboembolische Komplikationen.
Empfehlungen
Aufgrund der oben dargestellten Daten kann konstatiert werden, dass invasive Eingriffe unter Emicizumab grundsätzlich sicher durchführbar sind. Emicizumab alleine scheint bei Patienten mit schwerer Hämophilie A bei kleineren Eingriffen mit geringem Blutungsrisiko eine adäquate Hämostase zu gewährleisten.
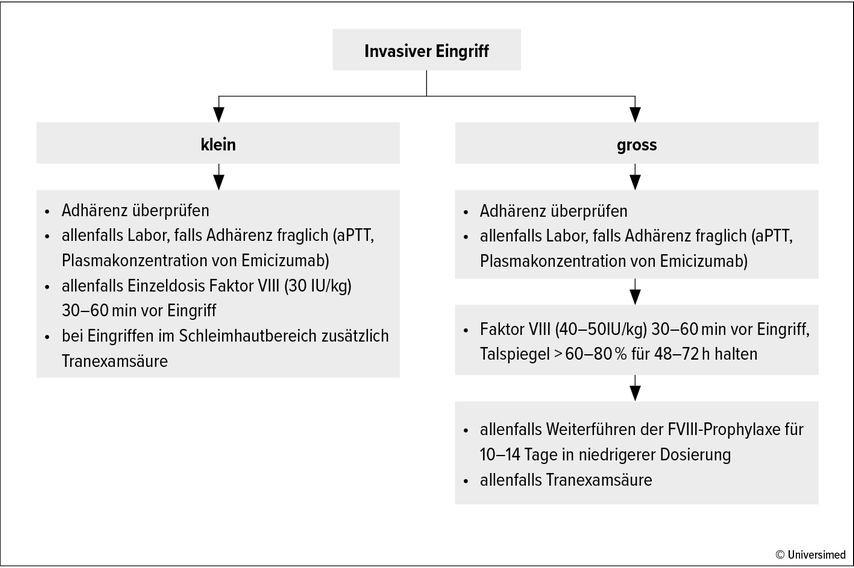
Bei grösseren Eingriffen ist der Konsens, dass bei ununterbrochener Emicizumab-Therapie zusätzlich eine Substitution mit einem FVIII-Konzentrat durchgeführt werden soll.4 Die exakte Dosierung und zeitliche Dauer der FVIII-Substitution hängen letztlich von der Art des Eingriffs und der klinischen Gesamtsituation ab. Die Schweizerische Arbeitgruppe für Hämostase (WPH) hat zusammen mit dem Schweizerischen Hämophilie Netzwerk (SHN) entsprechende Richtlinien publiziert (Abb. 1).5 Es ist unabdingbar, dass eine solche Behandlung von einer ärztlichen Fachperson mit Erfahrung in der Hämophiliebehandlung geplant und überwacht wird.
Abb. 1: Konsens der WPH/SHN zum perioperativen Vorgehen bei Patienten mit schwerer Hämophilie A, welche eine Prophylaxe mit Emicizumab erhalten
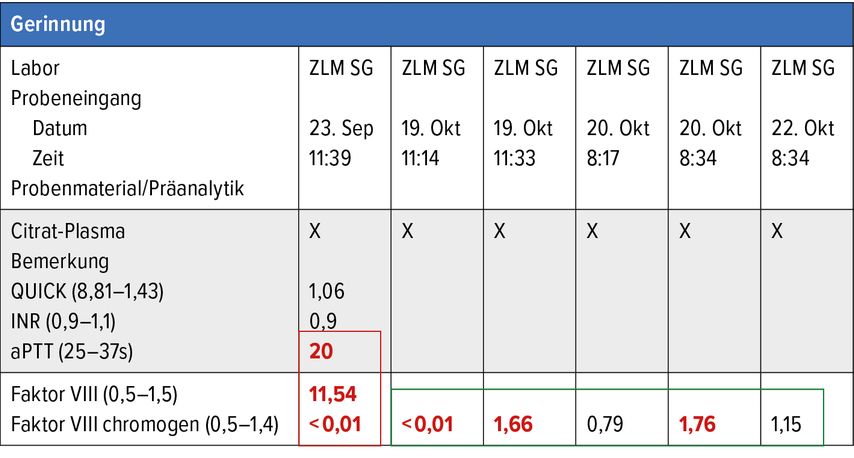
Wenn zur FVIII-Bestimmung ein chromogenes Testsystem mit bovinen Substraten vorhanden ist, kann die FVIII-Substitution auch unter Emicizumab problemlos überwacht werden (Tab. 1).
Tab. 1: Beispiel eines Patienten mit schwerer Hämophilie A unter Emicizumab, der für die Einlage einer Knieendoprothese zusätzlich mit einem FVIII-Konzentrat behandelt wurde. Rot umrandet die präoperative Situation: Unter Emicizumab ist die aPTT verkürzt und der aPTT-basierte Faktor VIII massiv artifiziell erhöht (zur Interpretation: 0,01 = 1%); die chromogene FVIII-Messung erfasst Emicizumab nicht und deshalb ist der chromogen gemessene Faktor VII beim Patienten mit schwerer Hämophilie A auch bei Therapie mit Emicizumab <1%. Grün umrandet die perioperative Situation: Mit der chromogenen Messung nach Gabe des FVIII-Konzentrats Anstieg des FVIII auf über 100% und im Verlauf unter repetitiver FVIII-Gabe durchwegs FVIII-Spiegel über 60%
Konklusion
Die Behandlungsoptionen bei Hämophilie A (und B) haben in den letzten Jahren massiv zugenommen und weitere Entwicklungsschritte werden folgen. Mehr Optionen, insbesondere auch der Einsatz von Nicht-Faktoren-Therapien, bedeuten eine deutlich höhere Komplexität. Für den Einsatz der Hämophilietherapien in komplexeren Situationen sowie das Labormonitoring dieser Therapien ist viel Erfahrung und spezifisches Wissen notwendig. Gerade im perioperativen Setting ist eine gute Kommunikation zwischen Hämophiliebehandler, Labor, Anästhesie und Operateur zwingend. Keinesfalls vergessen werden darf jedoch eine gute Aufklärung des Patienten bezüglich der Eigenschaften der eingesetzten Hämophilietherapie.
Literatur:
1 Lenting PJ: Laboratory monitoring of hemophilia A treatments: new challenges. Blood Adv 2020; 4(9): 2111-8 2 Kitazawa T et al.: a humanized bispecific antibody to coagulation factors IXa and X with a factor VIIIa-cofactor activity. Int J Hematol 2020; 111(1): 20-30 3 Kruse-Jarres R et al.: Surgical outcomes in people with hemophilia A taking emicizumab prophylaxis: experience from the HAVEN 1-4 studies. Blood Adv. 2022; Online ahead of print 4 Holstein K et al.: Hamostaseologie 2020; 40: 561-71 5 Fontana P et al.: Management of bleeding events and invasive procedures in patients with haemophilia A without inhibitors treated with emicizumab. Swiss Med. Wkly 2020; 150: w20422
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...