Schwangerschaft nach Brustkrebserkrankung
Autorin:
Univ.-Prof. PD Dr. med. Vesna Bjelic-Radisic
Abteilung für Senologie
Helios Universitätsklinik Wuppertal
Universität Witten/Herdecke
Eine Schwangerschaft nach Brustkrebs ist nicht mit einer schlechteren Prognose der Erkrankung assoziiert; das ist bisher vorliegenden Daten zu entnehmen. Bei ausgewählten Frauen mit HR-positivem Brustkrebs im Frühstadium (Stadium 1–3) stellt eine vorübergehende Unterbrechung der endokrinen Therapie bis zu zwei Jahre nach bereits 18–30 Monaten durchgeführter endokriner Therapie kein höheres kurzfristiges Risiko für Lokal- und Fernmetastasen dar.
Hintergrund
Etwa 7% aller Brustkrebserkrankungen werden bei Frauen unter 40 Jahren diagnostiziert: in einem Alter, in dem oft die Familienplanung nicht abgeschlossen und weiterhin ein potenzieller Kinderwunsch vorhanden ist.1,2 Laut einer in den USA durchgeführten Umfrage haben 77% der bisher kinderlosen Frauen mit Brustkrebs den Wunsch, in der Zukunft Kinder zu bekommen.3 In einer anderen Umfrage wünschte sich ein Drittel der Frauen, die bereits ein Kind hatten, ein weiteres Kind.4
Abhängig von den klinischen Charakteristika und der Biologie des Tumors erfasst die Therapie neben der Operation und Bestrahlung auch Chemo- und zielgerichtete Therapie, antihormonelle Therapie und ovarielle Suppression.5–7 Der positive Effekt all dieser Therapien auf das krankheitsfreie Überleben (DFS) und das Gesamtüberleben (OS) der Frauen mit Brustkrebs kann mit einem negativen Effekt auf die Fertilität verbunden sein.8–10
Aktuell gehören der negative Effekt der Chemotherapie, die jahrelang dauernde antihormonelle Therapie und die ovarielle Suppression sowie die Zukunftssorge der Frauen in Bezug auf das Wiederkommen der Erkrankung und die Sorge über den potenziellen negativen Einfluss der Schwangerschaft auf die Prognose der Erkrankung zu den zentralen Gründen, warum die Schwangerschaftsrate bei Frauen nach einer Brustkrebserkrankung niedrig ist.
Die Inzidenz der Schwangerschaft bei Frauen nach der Diagnose von Brustkrebs liegt zwischen 8 und 10%. Verglichen mit den gleichaltrigen, nicht an Brustkrebs erkrankten Frauen ist diese Inzidenz ca. 50% niedriger.10–13 Die Studien zeigen, dass nur ca. 8% der Frauen, die vor ihrem 35. Lebensjahr an Brustkrebs erkrankt sind, schwanger werden. In den Gruppen mit höherem Alter ist diese Zahl noch niedriger. Bis zum Alter von 45 Jahren durchleben nur 3% der Frauen eine Schwangerschaft nach einer Brustkrebserkrankung.10,14 In einer 2011 veröffentlichten bevölkerungsbezogenen Studie aus Norwegen zeigt sich, dass Frauen nach dem Brustkrebs im Vergleich zu der altersgerechten Vergleichsgruppe nicht erkrankter Frauen eine um 70% niedrigere Wahrscheinlichkeit haben, später schwanger zu werden.15
Einfluss der Schwangerschaft auf die Prognose von Brustkrebs
Der Einfluss einer Schwangerschaft auf die Prognose einer Brustkrebserkrankung wird seit Jahren diskutiert. Der ausgeprägte Anstieg der weiblichen Sexualhormone während der Schwangerschaft hat für viel Besorgnis in Bezug auf die Prognose der Erkrankung geführt, sowohl bei Patient:innen als auch bei Ärzt:innen – und das, obwohl Studien, meistens retrospektiver Natur, keinen negativen Einfluss der Schwangerschaft auf die Prognose der Erkrankung zeigten.
Die bisherigen retrospektiven Daten belegen, dass Frauen, die nach der Brustkrebsdiagnose Kinder bekommen haben, ein ähnliches oder sogar längeres Gesamtüberleben als Frauen ohne Schwangerschaften nach der Erkrankung zeigen.16–21 Auch das krankheitsfreie Überleben (DFS) bei Frauen mit Östrogenrezeptor-positiven (ER+) Tumoren war nicht kürzer verglichen mit Frauen ohne Schwangerschaften.22–24
Neben der Diskussion, dass eine Verzerrung der Daten als Folge des „Healthy mother“-Effekts verantwortlich für diese Ergebnisse ist, werden auch einige Theorien diskutiert, die eine schützende Wirkung der Schwangerschaft in Bezug auf Brustkrebs vermuten. Hier werden die Alloimmunisierung durch fötale Zellen, ein schützender Effekt eines hohen Gehaltes an Östrogen, Progesteron und plazentarem HCG, eine Indizierung der Reparatur der DNA und eine bessere zelluläre Differenzierung diskutiert. Unter dem Ausdruck „Healthy mother“-Effekt wird postuliert, dass Frauen, die sich für eine Schwangerschaft nach Brustkrebs entscheiden, gesünder sind und eine bessere Prognose im Vergleich mit den Frauen haben, die diesen Schritt nicht wagen.25
Die POSITIVE-Studie
Basierend auf diesen retrospektiven Daten, steigender Inzidenz der Erkrankung und dem steigenden Alter Gebärender wurde die erste prospektive, einarmige Studie durchgeführt, die die Sicherheit einer Schwangerschaft nach Brustkrebserkrankung prüfen sollte.26
Zwischen 2014 und 2019 wurden 518 Frauen mit Kinderwunsch nach Brustkrebserkrankung in die POSITIVE-Studie eingeschlossen. An der Studie konnten Frauen teilnehmen, die ≤42 Jahre alt waren und in der Anamnese HR-positiven Brustkrebs hatten (Stadium 1–3). Sie konnten ihre Therapie vorübergehend abbrechen, um Kinder zu bekommen. Die antihormonelle Therapie musste bereits mind. 18 Monate und max. 30 Monate durchgeführt worden sein. Eine Therapiepause von insgesamt zwei Jahren wurde erlaubt, um den Frauen Möglichkeit zu geben, schwanger zu werden, Schwangerschaften auszutragen, Kinder zu gebären und anschließend zu stillen. Alle Methoden der Reproduktionsmedizin waren erlaubt.
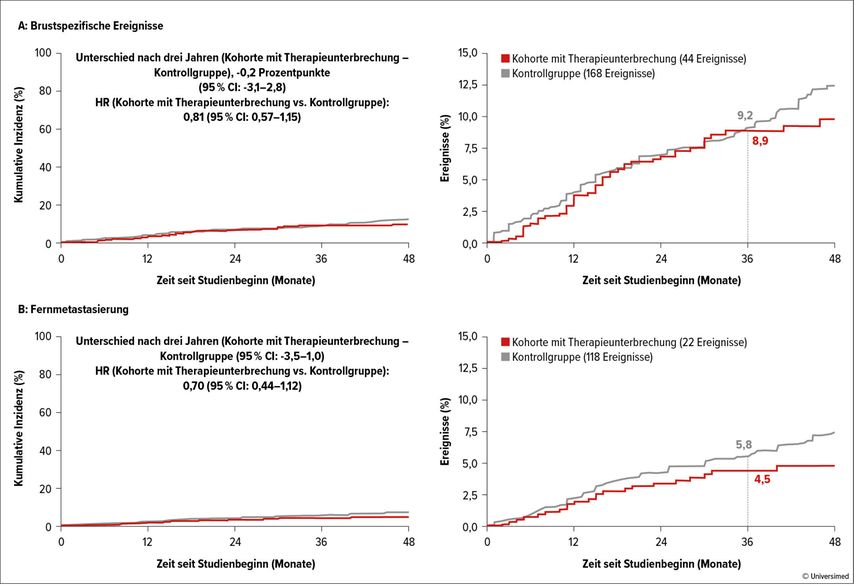
Nach einem medianen Follow-up von 41 Monaten wurden die Daten von 497 Frauen und 368 Schwangerschaften analysiert. Insgesamt wurden 365 Kinder geboren. Die Rezidivrate (lokale und Fernmetastasen), definiert als primäres Ziel der Studie, betrug 8,9% (44 Ereignisse) verglichen mit 9,2% in der Kontrollgruppe. Als Kontrollgruppe dienten die Daten der SOFT- und TEXT-Studien.27 Alleinige Fermetastasierung betrug 4,5% (vs. 5,2% in den SOFT- und TEXT-Studien). Diese Resultate, wenn auch nur mit einem kurzen Follow-up, bestätigen die bisherigen publizierten Daten dazu, dass eine Schwangerschaft nach Brustkrebserkrankung keinen negativen Einfluss auf die Prognose der Erkrankung hat (Abb. 1A und 1B).
Abb. 1: Brustspezifische und Fernmetastasenereignisse in der POSITIVE-Studie. Modifiziert nach Partridge AH et al.26
Outcome für das Kind
Eine kürzlich durchgeführte systematische Metaanalyse zeigte, dass die Inzidenz von Frühgeburten und niedrigem Geburtsgewicht und eine höhere Kaiserschnittrate mit Schwangerschaft nach Brustkrebs assoziiert sind.28 Der Zeitpunkt der Schwangerschaft scheint jedoch wichtig zu sein. Frauen, die innerhalb von einem Jahr nach Beginn einer Chemotherapie schwanger werden, haben ein erhöhtes Risiko für eine Frühgeburt, unabhängig von der Art der Krebserkrankung.29
In der POSITIVE-Studie war der Zeitpunkt des Einschlusses in die Studie mindestens 18 Monate nach Beginn einer endokrinen Therapie bzw. nach Abschluss der Chemotherapie. Der prozentuale Anteil der schwangerschaftsassoziierten Komplikationen stimmt mit denen der gesunden Populationen überein.30
Die Inzidenz der kindlichen Anomalien war in der Studie gering (2,2% in der Population von 365 Kindern) und ist im Einklang mit der Inzidenz der allgemeinen Bevölkerung.30
Aktive Beratung und Planung der Schwangerschaft nach Brustkrebs
Die Aufklärung über das Risiko für Fertilitätsverlust und die Möglichkeiten der Fertilitätsprotektion/des Fertilitätserhalts soll ein fixer Bestandteil der onkologischen Behandlung bei allen prämenopausalen Frauen zum Zeitpunkt der Diagnose sein, besonders bei jenen, die die Familienplanung nicht abgeschlossen haben.31–34
Die Auswahl der Methode für den Fertilitätserhalt sowie die Aufklärung über deren Vor- und Nachteile, Chancen und Risiken sollen vor dem Beginn der Therapie erfolgen. Beratung und Aufklärung über die Anwendung von GnRH-Analoga während der zytotoxischen Therapie, Ovarkryokonservierung und Kryokonservierung von befruchteten und unbefruchteten Eizellen sowie die Kombination verschiedener Maßnahmen sollen erfolgen.31–34
Assistierte Reproduktionstechnologien bei Brustkrebs
Bisherige Daten zeigen, dass keine der Arten der assistierten Reproduktionstechnologien (ART) einen negativen Einfluss auf die Prognose der Erkrankung hat.
In der POSITIVE-Studie hatten 179 (36,0%) Frauen (von 497 insgesamt) zum Fertilitätserhalt bei der Diagnosestellung eine ovarielle Stimulation zur Kryokonservierung von Embryonen/Eizellen erhalten.26 68 (37,9%) dieser Frauen hatten einen Embryotransfer während der Studie.
Bei 215 Patientinnen (43,3%) wurde zumindest eine Art der ART angewendet, 80 (37,2%) erhielten eine ovarielle Stimulation für eine In-vitro-Fertilisation (IVF) oder eine intrazytoplasmatische Spermieninjektion (ICSI). Weitere eingesetzte ART waren Clomifen (n=19), intrauterine Insemination (n=37) und Eizellspenden (n=17). Die Resultate des Zusammenhangs der ART und der brustspezifischen Ereignisse werden auf dem SABCS 2023 präsentiert.
Zusammenfassung
Die bisher vorliegenden Daten belegen, dass eine Schwangerschaft nach Brustkrebs nicht mit einer schlechteren Prognose der Erkrankung assoziiert ist. Eine kürzlich durchgeführte systematische Metaanalyse zeigte, dass die Inzidenz von Frühgeburten, niedriges Geburtsgewicht und höhere Kaiserschnittrate mit der Schwangerschaft nach Brustkrebs assoziiert sind. Der Zeitpunkt der Schwangerschaft scheint in diesem Zusammenhang jedoch wichtig zu sein.
Die Resultate der POSITIVE-Studie zeigen, dass bei ausgewählten Frauen mit früherem HR-positivem Brustkrebs im Frühstadium (Stadium 1–3) eine vorübergehende Unterbrechung der endokrinen Therapie bis zwei Jahre nach 18–30 Monaten durchgeführter endokriner Therapie kein höheres kurzfristiges Risiko für Lokal- und Fernmetastasen verglichen mit der externen Kontrollkohorte darstellt. Die schwangerschaftsassoziierten Komplikationen in der POSITIVE-Studie stimmen mit denen der gesunden Populationen überein. Die Inzidenz der kindlichen Anomalien war in der Studie gering (2,2%) und ist im Einklang mit der Inzidenz in der allgemeinen Bevölkerung.
Die Aufklärung über das Risiko für Fertilitätsverlust und die Möglichkeiten der Fertilitätsprotektion/des Fertilitätserhalts soll ein fixer Bestandteil der onkologischen Behandlung sein.
Literatur:
1 Ferlay J et al.: Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer 2010; 127(12): 2893-17 2 DeSantis C et al.: Breast cancer statistics, 2013. CA Cancer J Clin 2014; 64(1): 52-62 3 Martinez GM et al.: Fertility, contraception, and fatherhood: data on men and women from cycle 6 (2002) of the 2002 National Survey of Family Growth. Vital Health Stat 2006; (26): 1-142 4 Schover LR et al.: Having children after cancer. A pilot survey of survivors’ attitudes and experiences. Cancer 1999; 86(4): 697-709 5 EBCTCG: Relevance of breast cancer hormone receptors and other factors to the efficacy of adjuvant tamoxifen: patient-level meta-analysis of randomised trials. Lancet 2011; 378(9793): 771-84 6 Davies C et al.: Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor-positive breast cancer: ATLAS, a randomised trial. Lancet 2013; 381(9869): 805-16 7 Gray RG et al.: aTTom: Long-term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years in 6,953 women with early breast cancer. J Clin Oncol 2013; 31(Suppl. 18): 5 8 Reichman BS, Green KB: Breast cancer in young women: effect of chemotherapy on ovarian function, fertility, and birth defects. J Natl Cancer Inst Monogr 1994; 16: 125-9 9 Del Mastro L et al.: Infertility and pregnancy after breast cancer: current knowledge and future perspectives. Cancer Treat Rev 2006; 32(6): 417-22 10 Mueller BA et al.: Childbearing and survival after breast carcinoma in young women. Cancer 2003; 98(6): 1131-40 11 Sankila R et al.: Survival of breast cancer patients after subsequent term pregnancy: “healthy mother effect”. Am J Obstet Gynecol 1994; 170(3): 818-23 12 Von Schoultz E et al.: Influence of prior and subsequent pregnancy on breast cancer prognosis. J Clin Oncol 1995; 13(2): 430-4 13 Pagani O et al.: Pregnancy after breast cancer: if you wish, ma’am. Breast Cancer Res Treat 2011; 129(2): 309-17 14 Blakely LJ et al.: Effects of pregnancy after treatment for breast carcinoma on survival and risk of recurrence. Cancer 2004; 100(3): 465-9 15 Stensheim H et al.: Pregnancy after adolescent and adult cancer: a population-based matched cohort study. Int J Cancer 2011; 129(5): 1225-36 16 Cooper DR, Butterfield J: Pregnancy subsequent to mastectomy for cancer of the breast. Ann Surg 1970; 171(3): 429-33 17 Valachis A et al.: Safety of pregnancy after primary breast carcinoma in young women: a meta-analysis to overcome bias of healthy mother effect studies. Obstet Gynecol Surv 2010; 65(12): 786-93 18 Petrek JA: Pregnancy safety after breast cancer. Cancer 1994; 74(Suppl. 1): 528-31 19 Kroman N et al.: Should women be advised against pregnancy after breast-cancer treatment? Lancet 1997; 350(9074): 319-22 20 Kopeika J et al.: Planned and unplanned pregnancies in breast cancer survivors. Breast 2019; 46: 75-80 21 Ives A et al.: Pregnancy after breast cancer: population based study. BMJ 2007; 334(7586): 194 22 Azim HA Jr et al.: Prognostic impact of pregnancy after breast cancer according to estrogen receptor status: a multicenter retrospective study. JClin Oncol 2013; 31(1): 73 23 Nye L et al.: Breast Cancer outcomes after diagnosis of hormone-positive breast cancer and subsequent pregnancy in the tamoxifen era. Clin Breast Cancer 2017; 17(4): e185-9 24 Lambertini M et al.: Long-term safety of pregnancy following breast cancer according to estrogen receptor status. J Natl Cancer Inst 2017; 110(4): 426-9 25 De Bree E et al.: Pregnancy after breast cancer. A comprehensive review. J Surg Oncol 2010; 101(6): 534-42 26Partridge AH et al.: Interrupting endocrine therapy to attempt pregnancy after breast cancer. N Engl J Med 2023; 388(18): 1645-56 27 Francis PA et al.: Tailoring adjuvant endocrine therapy for premenopausal breast cancer. N Engl J Med 2018; 379(2): 122-37 28Lambertini M et al.: Pregnancy after breast cancer: asystematic review and meta-analysis. J Clin Oncol 2021; 39(29): 3293-305 29 Hartnett KP et al.: Pregnancy after cancer: does timing of conception affect infant health? Cancer 2018; 124(22): 4401-7 30 Society for Maternal-Fetal Medicine Committee on Clinical Consensus-Obstetrics: Pregnancy at age 35 years or older: ACOG obstetric care consensus no. 11. Obstet Gynecol 2022; 140(2): 348-66 31 Paluch-Shimon S et al.: ESO-ESMO 3rd international consensus guidelines for breast cancer in young women (BCY3). Breast 2017; 35: 203-17 32 Lee SJ et al.: ASCO recommendations on fertility preservation in cancer patients. J Clin Oncol 2006; 24(18): 2917-31 33 Fertilitätserhalt bei onkologischen Erkrankungen, S2k, AWMF-Registernummer 015/082 34 Interdisziplinäre S3-Leitlinie für die Früherkennung, Diagnostik, Therapie und Nachsorge des Mammakarzinoms. Langversion 4.3 – Februar 2020; AWMF-Registernummer: 032-045OL
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...