Rezidivtherapie für die akute myeloische Leukämie nach allogener Stammzelltransplantation
Autorin:
Priv.-Doz. Dr. Alexandra Böhm
3. Medizinische Abteilung
Hanusch-Krankenhaus
Wien
E-Mail: alexandra.boehm@oegk.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Auf der diesjährigen Frühjahrstagung der Österreichischen Gesellschaft für Hämatologie & Onkologie, die sowohl vor Ort in Graz als auch virtuell stattfand, wurde unter anderen Themen die allogene Stammzelltransplantation besprochen. Diskutiert wurde die Rolle von Post-Transplant-Cyclophosphamid bei der Spenderauswahl. Außerdem wurde über Innovationen bei der Graft-versus-Host-Erkrankung (GvHD) sowie über die therapeutischen Optionen beim Rezidiv berichtet.
Keypoints
-
MRD-Assessment bzw. MRD-getriggerte personalisierte Nachsorge muss Standard sein.
-
Frührezidive <12 Monate nach allogener Stammzelltransplantation haben weiterhin eine infauste Prognose.
-
Genetische und epigenetische Charakterisierung des Rezidivs ist hilfreich für die Wahl der Therapie.
-
Therapeutische Optionen sind Tyrosinkinasehemmer wie z.B. Sorafenib, zytotoxische und immunmodulierende Substanzen wie AZA und/oder Lenalidomid.
-
Neue, bisher noch nicht in großen Studien publizierte Optionen im Rezidiv sind CAR-T-Zellen, Checkpoint-Inhibitoren, Venetoclax und orales Azacitidin CC-486.
In den letzten Jahren konnte die transplantationsassoziierte Mortalität unter anderem durch Verbesserung der Supportivtherapie, Anpassung der Intensität der Konditionierungschemotherapie und genauere Spenderauswahl deutlich gesenkt werden. Trotz dieser Entwicklungen bleibt ein Rezidiv der Grunderkrankung aber insbesondere nach Tag 100 die Haupttodesursache. Um dieses Risiko zu senken, können sowohl prä als auch peri und post Transplantation unterschiedliche Faktoren optimiert werden. Dazu zählen:
-
Erweiterung der Induktionschemotherapie um zielgerichtete Substanzen je nach molekularem Profil (z.B. Tyrosinkinase-Inhibitoren[TKI], monoklonale Antikörper)
-
Anwendung von Risikoscores, um die Rezidivwahrscheinlichkeit besser abschätzen zu können (z.B. Disease Risk Index [DRI], Disease-Risk Stratification Scheme [DRSS])1,2
-
Wahl der Konditionierung (myeloablativ oder dosisreduziert) und Graft-versus-Host(GvHD)-Prophylaxe (z.B. rasches Tapering)3
-
Faktoren post Transplantation:
1. Ursachen für ein Rezidiv (chemorefraktäre Subklone vs. Immun-Escape)4
2. Erhaltungstherapie (unter „Messbare-Resterkrankung“[MRD]-Monitoring)
3. Präemptive Therapie
4. Salvagetherapie
Eines der wichtigsten Hilfsmittel in der Nachsorge ist das Monitoring der MRD. Es sollte Standard sein, um ein beginnendes Rezidiv frühzeitig zu erkennen. Methodisch kann die MRD durchflusszytometrisch mittels Chimärismus oder molekular mittels Polymerase-Kettenreaktion (PCR) oder „next-generation sequencing“ (NGS) bestimmt werden.
Ursachen für ein Rezidiv
Rezidive post Transplantation können nicht nur durch residuale, chemorefraktäre Subklone ausgelöst werden, sondern auch durch Mechanismen, bei denen leukämische Blasten dem Immunsystem entkommen. Das geschieht zum Beispiel durch eine beeinträchtigte Antigen/„Humanes Leukozytenantigen“(HLA)-Präsentation (z.B. HLA-Verlust nach haploidenter Stammzelltransplantation), Überexpression von Checkpoint-Liganden, Anstiegantiinflammatorischer Zytokine und/oder Verminderung proinflammatorischer Zytokine.4 Eine genauere Analyse dieser Mechanismen würde eine verbesserte Auswahl einer Rezidivtherapie ermöglichen, wird aber aufgrund der aufwendigen Methoden in der klinischen Praxis in den meisten Zentren noch nicht durchgeführt.
Erhaltungstherapie
Das Therapiekonzept bei den akuten Leukämien und vielen anderen hämatologischen Erkrankungen hat sich durch neue Behandlungsoptionen – insbesondere durch Einführung der zielgerichteten Substanzen – verändert. So wird inzwischen nach Abschluss der Erstlinienbehandlung mit oder ohne allogene Stammzelltransplantation oftmals eine Erhaltungstherapie gegeben.
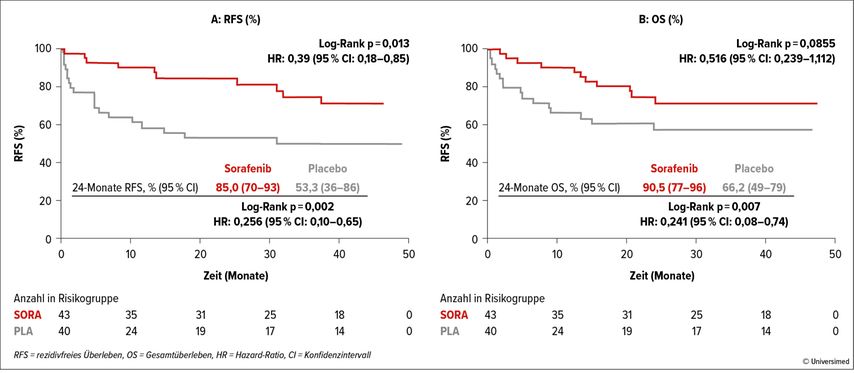
Eine der wichtigsten Studien mit positiven Ergebnissen ist hierbei die multizentrische SORMAIN-Studie, die 2020 publiziert wurde.5 In ihr wurden 83 Patient*innen mit FLT3-positiver akuter myeloischer Leukämie (AML) in kompletter hämatologischer Remission (CR) entweder in den Erhaltungsarm mit 24 Monaten Sorafenib oder in den Kontrollarm mit Placebo randomisiert. Die Rate des rezidivfreien Überlebens (RFS) lag bei 85% im Erhaltungsarm vs. 53% im Kontrollarm (Abb. 1). Diese Studie legte den Grundstein für die Empfehlung einer prophylaktischen oder präemptiven Erhaltungstherapie bei FLT3-positiver AML.
Abb. 1: In der multizentrischen SORMAIN-Studie lag das rezidivfreie Überleben für den Erhaltungsarm mit Sorafenib bei 85% vs. 53% für den Kontrollarm mit Placebo. Das Gesamtüberleben lag bei 91% vs. 66%. Modifiziert nach Burchert A et al.5
Eine weitere wegbereitende Studie war die RICAZA-Studie zur Verträglichkeit und Wirksamkeit von hypomethylierenden Substanzen (HMA).6 An ihr nahmen 37 AML-Patient*innen teil, 32 davon in CR. Sie erhielten frühzeitig nach einer allogenen Stammzelltransplantation (im Median ab Tag 54) über fünf Tage und drei bis zehn Zyklen Azacitidin (AZA) in einer niedrigen Dosierung von 36mg/m2. Das 1-Jahres-Gesamtüberleben (OS) lag bei 81%. Immunologisch kam es durch AZA zu einer CD8-positiven T-Zell-Antwort im Sinne eines potenziellen Graft-versus-Leukemia(GvL)-Effekts bei guter Verträglichkeit.
Eine amerikanische Studie am MD Anderson Cancer Center untersuchte rezent eine HMA-Erhaltungstherapie bei 87 Patient*innen mit AML oder myelodysplastischem Syndrom (MDS) im Vergleich mit einem Kontrollarm ohne Erhaltungstherapie (n=100), unabhängig vom Risikoprofil.7 Dabei konnte weder ein Überlebensvorteil beobachtet noch das Rezidivrisiko gesenkt werden. Allerdings wurden bei dieser Studie keine MRD-Daten inkludiert. Ob einzelne Subgruppen daher möglicherweise profitiert hätten, lässt sich auf Basis der vorhandenen Daten nicht schlussfolgern.
Insgesamt zeigt sich dennoch in Zusammenschau aller rezenten Publikationen ein klarer Vorteil für die Erhaltungstherapie, insbesondere sofern das molekulare Profil und/oder der MRD-Verlauf für ein hohes Rezidivrisiko sprechen.
Präemptive Therapie
In der RELAZA-2-Studie wurde eine MRD-getriggerte, präemptive Therapie mit AZA getestet, um ein hämatologisches Rezidiv zu verhindern.8 53 Patient*innen mit AML/MDS wurden eingeschlossen, 24 davon nach allogener Stammzelltransplantation. Sobald der CD34-Chimärismus unter 80% fiel und/oder die molekulare MRD über1% anstieg, wurde die Therapie mit AZA gestartet. 67% der Patien*innen waren nach sechs Monaten mit einem tolerablen Nebenwirkungsprofil von AZA immer noch in CR. Allerdings wäre eine frühzeitige therapeutische Intervention, bevor der Chimärismus unter 80% fällt, wahrscheinlich noch wirksamer.
Ebenfalls präemptiv ist die Therapie mit Donorlymphozyten (DLI, Spenderlymphozyten). So werden unmanipulierte CD3-positive T-Lymphozyten bezeichnet, die vom allogenen Stammzellspender stammen und post Transplantation als prophylaktische, präemptive oder therapeutische Zelltherapie verabreicht werden. DLI wurden initial schon vor vielen Jahren bei der chronischen myeloischen Leukämie erfolgreich eingesetzt, um Rezidive zu verhindern. Sie waren allerdings immer mit einem hohen Risiko verbunden, eine schwere GvHD zu entwickeln. Bei schnell proliferierenden Erkrankungen ist eine vorhergehende Therapie zur raschen Krankheitskontrolle notwendig, bis sich der GvL-Effekt aufbauen kann.
Salvagetherapie
Frühe hämatologische Rezidive nach einer allogenen Stammzelltransplantation sind zumeist mit einer infausten Prognose assoziiert. Mit der Kombination von immunmodulierenden Substanzen – jedoch weniger mit intensiver Chemotherapie – stehen aber dennoch therapeutische Optionen zur Verfügung.
Basierend auf früheren Studien wurde bei 29 AML/MDS-Patient*innen mit einem Frührezidiv die Kombination von AZA und Lenalidomid untersucht.9 AZA wurde dabei in der konventionellen Dosierung von 75mg/m2 eingesetzt, Lenalidomid von Tag 10 bis Tag 30 in unterschiedlichen Dosierungen bis zu 25mg. Im Median wurden drei Zyklen verabreicht, die Overall Response Rate (ORR) lag bei 47%, das mediane OS war 27 Monate bei Ansprechen ohne erhöhte GvHD-assoziierte Mortalität, vs. 10 Monate bei Nicht-Ansprechen.
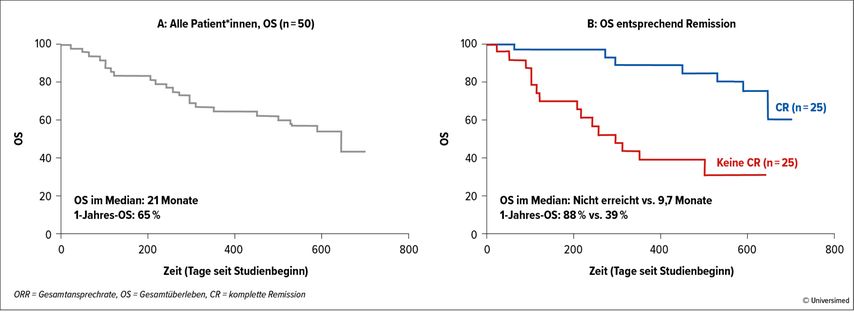
Sowohl beim Kongress der American Society of Hematology 2021 als auch beim diesjährigen Kongress der European Society for Blood and Marrow Transplantation wurde die AZALENA-Studie mit einem sehr ähnlichen Konzept präsentiert. In ihr wurden AZA und Lenalidomid allerdings um die Zugabe von DLI in eskalierender Dosierung nach dem vierten Zyklus erweitert. Lenalidomid wurde maximal bis 5mg dosiert. Die ORR lag bei 56%, mit einem 1-Jahres-Gesamtüberleben von 65% (Abb. 2).
Abb. 2: In der AZALENA-Studie, in der Azacitidin und Lenalidomid um die Zugabe von Spenderlymphozyten in eskalierender Dosierung nach dem vierten Zyklus erweitert wurden, lag die Gesamtansprechrate bei 56% mit einem 1-Jahres-Gesamtüberleben von 65%
Je nach ECOG(Eastern Cooperative Oncology Group)-Status der Patient*innen und der Remissionsdauer nach der ersten Transplantation (mindestens 6–12 Monate) ist letztendlich auch eine Zweittransplantation erfolgreich möglich.10
Literatur:
1 Armand P et al.: Validation and refinement of the Disease Risk Index for allogeneic stem cell transplantation. Blood 2014; 123: 3664-71 2 Shouval R et al.: Development and validation of a disease risk stratification system for patients with haematological malignancies: a retrospective cohort study of the European Society for Blood and Marrow Transplantation registry. Lancet Haematol 2021; 8: e205-e21 3 Scott BL et al.: Myeloablative versus reduced-intensity hematopoietic cell transplantation for acute myeloid leukemia and myelodysplastic syndromes. J Clin Oncol 2017; 35: 1154-61 4 Zeiser R et al: Mechanisms of immune escape after allogeneic hematopoietic cell transplantation. Blood 2019; 133: 1290-7 5 Burchert A et al.: Sorafenib maintenance after allogeneic hematopoietic stem cell transplantation for acute myeloid leukemia with FLT3-internal tandem duplication mutation (SORMAIN). J Clin Oncol 2020; 38: 2993-3002 6 Craddock C et al.: Tolerability and clinical activity of post-transplantation azacitidine in patients allografted for acute myeloid leukemia treated on the RICAZA trial. Biol Blood Marrow Transplant 2016; 22: 385-90 7 Oran B et al.: A phase 3 randomized study of 5-azacitidine maintenance vs observation after transplant in high-risk AML and MDS patients. Blood Adv 2020; 4: 5580-8 8 Platzbecker U et al.: Measurable residual disease-guided treatment with azacitidine to prevent haematological relapse in patients with myelodysplastic syndrome and acute myeloid leukaemia (RELAZA2): an open-label, multicentre, phase 2 trial. Lancet Oncol 2018; 19: 1668-79 9 Craddock C et al.: Combination lenalidomide and azacitidine: a novel salvage therapy in patients who relapse after allogeneic stem-cell transplantation for acute myeloid leukemia. J Clin Oncol 2019; 37: 580-8 10 Christopeit M et al.: Second allograft for hematologic relapse of acute leukemia after first allogeneic stem-cell transplantation from related and unrelated donors: the role of donor change. J Clin Oncol 2013; 31: 3259-71
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...