Resektion und Transplantation beim HCC: was für wen?
Autoren:
Dr. Felix J. Krendl
Assoz.Prof. Priv.-Doz. Dr. Rupert Oberhuber, PhD, FEBS (transplant)
Univ.-Prof. Dr. Stefan Schneeberger, Executive MBA, FEBS (transplant)
Department für Visceral-, Transplantations- und Thoraxchirurgie, Medizinische Universität Innsbruck
Korrespondenz:
E-Mail: stefan.schneeberger@i-med.ac.at
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Lebertransplantation spielt bei der Behandlung des hepatozellulären Karzinoms (HCC) eine zunehmend wichtige Rolle. Innovative Immuntherapien und erweiterte Selektionskriterien lassen kurative Behandlungsoptionen für bisher palliative Tumorstadien in greifbare Nähe rücken.
Keypoints
-
Die Behandlung des hepatozellulären Karzinoms (HCC) basiert auf dem „Barcelona Clinic Liver Cancer“(BCLC)- Algorithmus; chirurgische Resektion und Lebertransplantation sind wichtige Therapieoptionen.
-
Die chirurgische Resektion kommt als Therapieoption für Patient:innen mit noch kompensierter Leberfunktion infrage.
-
Erweiterte Selektionskriterien unter Berücksichtigung der Tumorbiologie sind zunehmend überlegen, um Patient:innen für die Lebertransplantation zu selektionieren.
Eine wichtige Referenz für die Behandlung des hepatozellulären Karzinoms (HCC) sind die „Barcelona Clinic Liver Cancer“(BCLC)-Kriterien.1 Die chirurgische Resektion kommt vor allem bei Patient:innen mit (noch) kompensierter Leberfunktion zur Anwendung. Das Rezidivrisiko nach Resektion ist allerdings hoch.1
Im Vergleich zur Resektion bietet die Lebertransplantation den Vorteil einer umfassenden lokalen Tumorkontrolle, kombiniert mit dem Ersatz der präkanzerösen, zirrhotischen Leber.2 Das Konzept, ein tumoröses, krankes Organ durch ein gesundes, tumorfreies zu ersetzen, beschreibt das Grundprinzip der Transplantationsonkologie, das an sich nicht neu ist.3Schon bei der ersten erfolgreichen Lebertransplantation im Jahr 1967 war die Indikation zur Transplantation eine onkologische.4 Nach anfänglichem Enthusiasmus wurden onkologische Indikationen jedoch aufgrund von hohen Rezidivraten und schlechtem Outcome zugunsten von nicht-onkologischen Indikationen verlassen.2
Besseres Langzeitüberleben dankder Milan-Kriterien
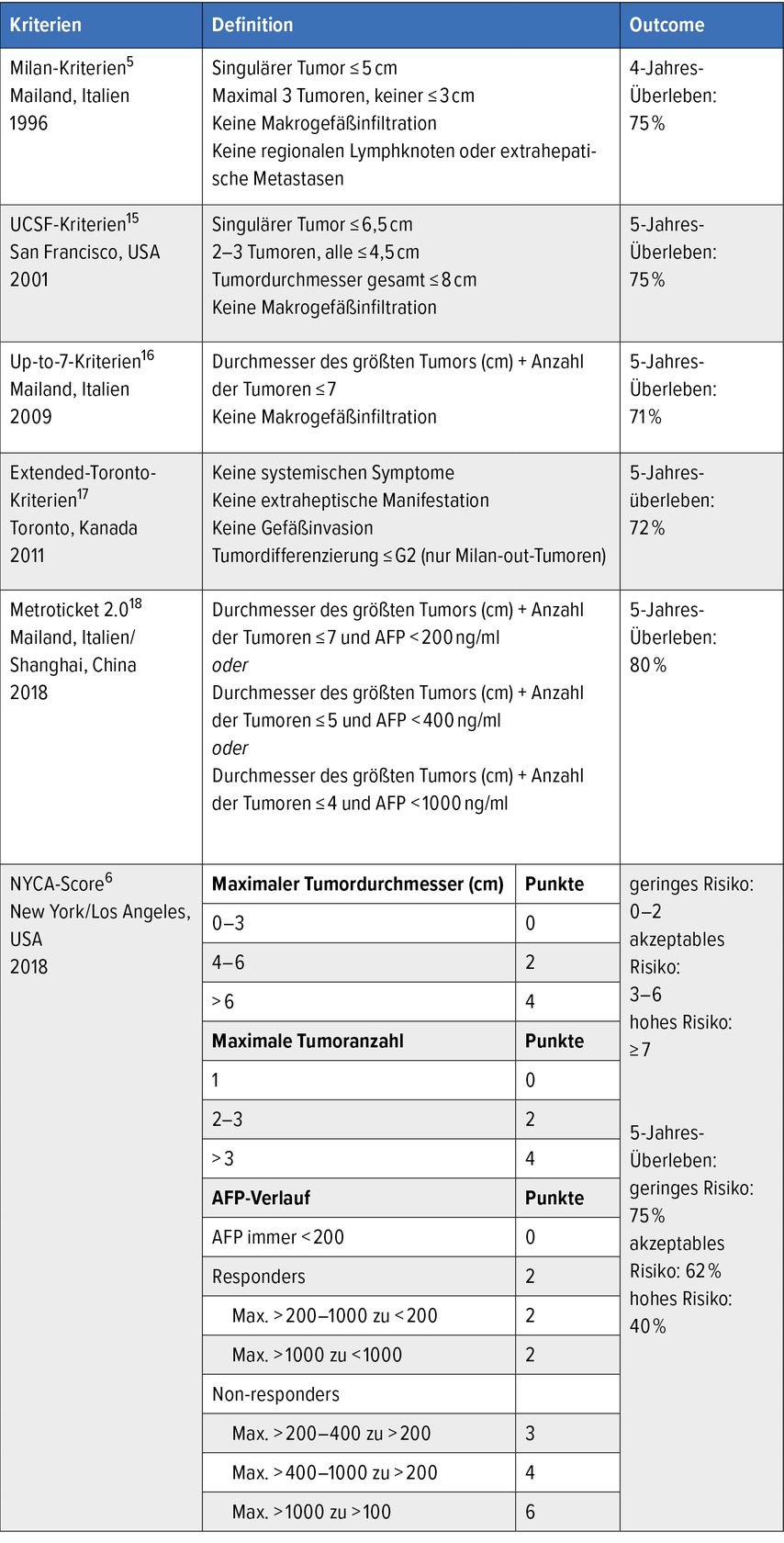
Erst mit den von Mazzaferro et al. 1996 im New England Journal of Medicine publizierten Milan-Kriterien hat das Gebiet der Transplantationsonkologie Schritt für Schritt wieder an Bedeutung gewonnen.5 Bei den Milan-Kriterien handelt es sich um morphologische Selektionskriterien, die ein Langzeitüberleben von bis zu 75% ermöglichen (Tab. 1). In vielen westlichen Ländern finden die Milan-Kriterien bis heute Anwendung, um Patient:innen mit einem HCC für eine Lebertransplantation zu priorisieren. Sowohl ET (Eurotransplant) als auch UNOS (United Network for Organ Sharing) vergeben sogenannte „exceptional MELD points“ für Patient:innen, welche die Milan-Kriterien (bzw. ein Tumorstadium T2) initial oder nach erfolgreichem Downstaging erfüllen (Milan-in).
Tab. 1: Überblick und chronologische Auflistung ausgewählter Selektionskriterien (modifiziert nach Krendl FJ et al.)2
Die Milan-Kriterien haben geholfen, Patient:innen zu identifizieren, bei denen ein sehr gutes Langzeitüberleben zu erwarten ist. Neuere Daten und Interpretationen zum individuellen Benefit hinsichtlich des Patientenüberlebens sowie des rezidivfreien Überlebens haben gezeigt, dass diese Kriterien zu stringent sind und damit Patient:innen den Zugang zu einer potenziell kurativen Therapieoption verwehren.6 Die seit Beginn der Lebertransplantation bestehende und bis heute andauernde limitierte Verfügbarkeit von passenden Spenderorganen führt dazu, dass Patient:innen auf der Warteliste um Organe konkurrieren. Daraus ergeben sich medizinisch-ethische Implikationen.
Für Patient:innen mit nichtonkologischen Indikationen zur Lebertransplantation wird bei der Organallokation ein „urgency“-basierter Ansatz („sickest first“) verfolgt. Patient:innen mit dem höchsten MELD-Score – also jene auf der Warteliste mit dem höchsten Risiko zu versterben – bekommen bevorzugt ein Spenderorgan zugeteilt. Dabei ist zu bedenken, dass ein höherer MELD-Score vor der Transplantation auch ein Risiko für ein schlechteres Outcome nach der Transplantation bedeutet.7 Für Patient:innen mit onkologischen Indikationen erfolgt die Organallokation hingegen „utility“-basiert. Dabei werden Personen mit Erkrankungsstadien priorisiert, die ein 5-Jahres-Überleben von 70% und mehr erwarten lassen.
Ein alternativer Ansatz dazu ist die „benefit“-orientierte Organallokation, bei der Organe so verteilt werden, dass die Anzahl der durch die Transplantation gewonnen Lebensjahre maximiert wird. Dieser Ansatz berücksichtigt dabei sowohl „urgency“ als auch „utility“.8
Verfeinerte Selektionskriterien füreine Lebertransplantation
In den vergangenen 20 Jahren wurden die Selektionskriterien beim HCC schrittweise erweitert, um mehr Patient:innen die Chance zu geben, von einer Lebertransplantation zu profitieren (Tab.1). Beschleunigt wurde diese Entwicklung sicherlich auch durch den quasi Wegfall der Hepatitis C als Ursache für die Leberzirrhose und die damit verbundene geringere Zahl von Nicht-HCC-Transplantationskandidat:innen. Besonders hervorzuheben sind die 2001 veröffentlichten UCSF-Kriterien, gefolgt von den 2009 publizierten Up-to-7-Kriterien (Tab.1).
2018 wurden die Kriterien Metroticket 2.0 publiziert. Dabei handelt es sich um eine AFP(Alpha-Fetoprotein)-adjustierte Verfeinerung der Up-to-7-Kriterien. Die Metroticket-2.0-Kriterien unterscheiden sich von den rein morphologischen Selektionskriterien insofern, als sie auch biochemische Parameter beinhalten. Der 2018 publizierte NYCA-Score beinhaltet nicht nur absolute AFP-Werte, sondern auch den AFP-Verlauf über die Zeit.6 Dadurch ist eine dynamische Bewertung der Tumorbiologie möglich.
Eine Kernfrage in der Allokationsthematik ist, wie das Ergebnis nach Transplantation zu werten ist. Mithilfe von Markov-Modellen haben Volk et al. anhand von UNOS-Daten gezeigt, dass das 5-Jahres-Überleben nach Lebertransplantation für Milan-out-Patient:innen bei 60% und mehr liegen muss, damit für die Wartelistenkohorte kein Nachteil entsteht.9 Zu beachten ist allerdings, dass dieser Wert je nach UNOS-Region und damit je nach Spenderaufkommen und Organverfügbarkeit stark variiert. In Regionen mit hohem Spenderaufkommen ist selbst bei einem 5-Jahres-Überleben von 25% nicht mit negativen Auswirkungen für Patient:innen auf der Warteliste zu rechnen. Ein Paritätsprinzip existiert aufgrund der Regionalisierung in der Transplantation nicht, weshalb keine allgemein gültigen Kriterien auf alle Regionen anwendbar sind. Die Definition eines „akzeptablen Outcomes“ nach Lebertransplantation ist somit relativ und sollte das zu erwartende Outcome der Alternativtherapie (versterben auf der Warteliste) sowie die Organverfügbarkeit und lokale Wartelistendynamik miteinbeziehen.
Therapieoptionen bei fortgeschrittenen Tumorstadien
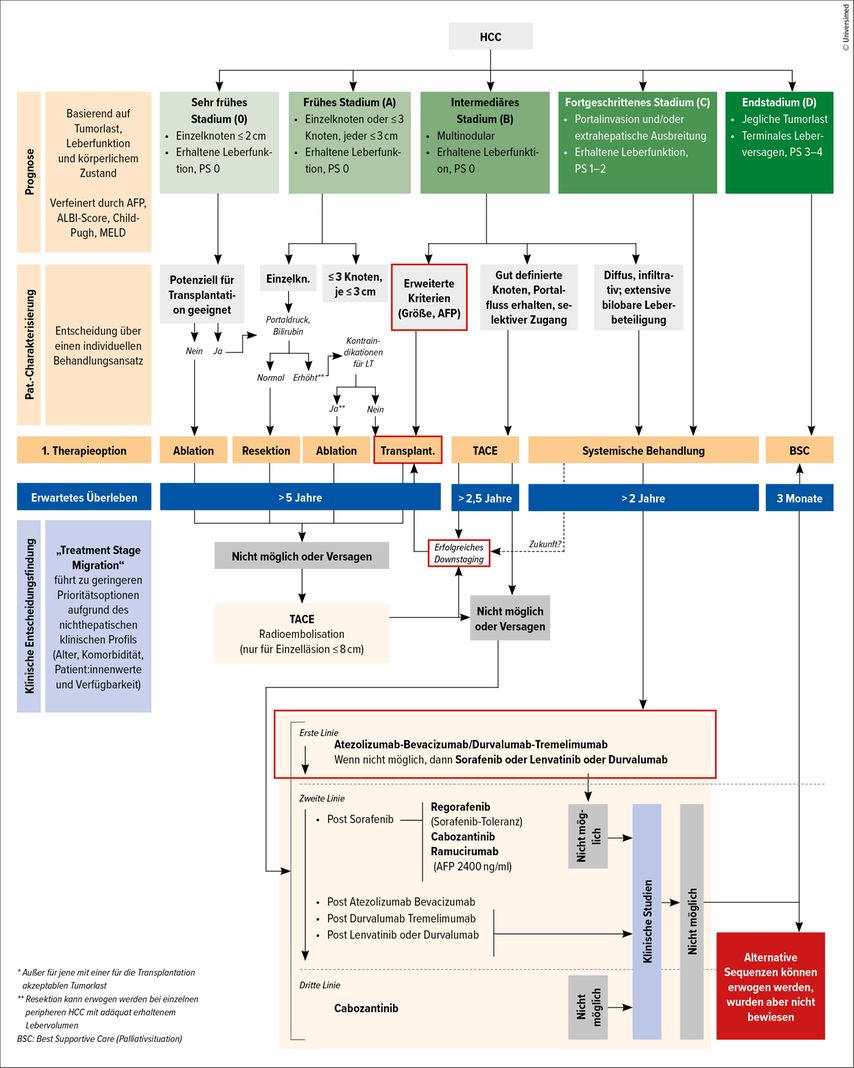
Für Patient:innen mit fortgeschrittener Tumorerkrankung, stehen lokoregionäre Therapien (LRT) wie die transarterielle Chemoembolisation (TACE) und die Radiofrequenzablation (RFA) im Rahmen von Downstaging-Protokollen zur Verfügung. Unter Downstaging versteht man den Versuch, ein fortgeschrittenes Tumorstadium außerhalb etablierter Selektionskriterien in ein transplantables Tumorstadium zu überführen. Die meisten westlichen Transplantationszentren bieten Patient:innen, die initial einen Tumor außerhalb der Milan-Kriterien haben, ein Downstaging an.10 Wenn der Tumor dadurch auf eine Größe/Zahl innerhalb der Milan-Kriterien gebracht werden kann (Milan-in), sind die 5-Jahres-Überlebensraten nach Transplantation ähnlich gut wie bei Personen, die zu Beginn die Milan-Kriterien erfüllt haben. Prinzipiell sollte daher bei allen Patient:innen, die initial etablierte Selektionskriterien nicht erfüllen, ein Downstaging erwogen werden. Dies spiegelt sich auch im aktuellen BCLC-Algorithmus sowie in den aktuell publizierten Empfehlungen der ESOT (European Society of Organ Transplantation) wider (Abb. 1).1,11
Abb. 1: BCLC-Algorithmus (modifiziert nach Reig M et al.)1: Hervorgehoben sind sogenannte erweiterte Selektionskriterien, die selbst Patient:innen außerhalb der Milan-Kriterien einen Weg in Richtung Lebertransplantation ermöglichen. Auch Patient:innen, die die initial erweiterten Selektionskriterien nicht erfüllen, steht nach erfolgreichem Downstaging der Weg in Richtung Lebertransplantation offen. In Zukunft wird die Lebertransplantation möglicherweise auch für Patient:innen im Stadium BCLC C nach erfolgreichem Downstaging eine etablierte Behandlungsoption darstellen.
Während zum Downstaging bisher vor allem LRT zur Anwendung kamen, häufen sich zuletzt Berichte, bei denen Immuntherapien eingesetzt und die Patient:innenanschließend transplantiert wurden.12
Schmiderer et al.13 haben den Fall eines 63-jährigen Mannes mit HCV-Zirrhose und maligner Transformation mit Makrogefäßinfiltration (BCLC C) beschrieben, bei dem das Downstaging nach Systemtherapie mit Atezolizumab in Kombination mit Bevacizumab erfolgreich war und der transplantiert wurde. In der Histologie der explantierten Leber zeigte sich ein vollständiges Ansprechen der 11cm großen, gefäßinfiltrierenden Läsion (abschließende Tumorklassifikation ypT2 N0, M0, L0, V0, R0, G2). Zum Zeitpunkt der Listung wurden Atezolizumab und Bevacizumab pausiert und eine Erhaltungstherapie mit Lenvatinib wurde initiiert. Die Zeitdauer von der letzten Atezolizumabgabe bis zur Lebertransplantation (Wash-out-Periode) betrug sechs Wochen. Der Patient entwickelte keine Abstoßungsreaktion und ist ein Jahr nach Transplantation tumorfrei. Durch die interdisziplinäre Zusammenarbeit und den Einsatz moderner Systemtherapien in Kombination mit einer Lebertransplantation konnte eine fortgeschrittene Tumorerkrankung in ein potenziell kuratives Stadium überführt werden.
Mögliches Risiko der Immun-therapie: Abstoßungsreaktionen
Ein Caveat bei dem Einsatz von Immuntherapien in zeitlichem Zusammenhang mit der Transplantation ist das Risiko für eine schwere Abstoßungsreaktion bis hin zum Organverlust.14
Aktuell laufen zwei Sicherheits- und Machbarkeitsstudien (NCT 05185505, NCT 05879328), die den Einsatz von Atezolizumab in Kombination mit Bevacizumab vor einer Lebertransplantation evaluieren. Es bleibt zu hoffen, dass im nächsten BCLC-Update auch für Patient:innen im Stadium BCLC C nach erfolgreichem Downstaging ein Weg in Richtung Transplantation aufgezeigt wird.
Literatur:
1 Reig M et al.: J Hepatol 2022; 76(3): 681-93 2 Krendl FJ et al.: JHEP Reports 2024; 6(2): 100965 3 Hibi T, Sapisochin G: Surgery 2019; 165(2): 281-5 4 Starzl TE et al.: Ann Surg 1968; 168(3): 392-415 5 Mazzaferro V et al.: NEngl J Med 1996; 334(11): 693-9 6 Halazun KJ et al.: Ann Surg 2018; 268(4): 690-9 7 Dutkowski P et al.: Ann Surg 2011; 254(5): 745-53 8 Cillo U et al.:Hepatology 2017; 65(5): 1741-8 9 Volk ML et al.: Am J Transplant 2008; 8(4): 839-46 10 Seehofer D et al.: Transpl Int 2022; 35: 10333 11 Claasen M et al.: Transpl Int 2023; 36: 11648 12 Cesario S et al.: Life (Basel) 2023; 13(7): 1562 13 Schmiderer A et al.: Dig Dis 2023; 41(4): 641-4 14 Abdelrahim M et al.: Cancers (Basel) 2022; 14(7): 1760 15 Yao FY et al.: Hepatology 2001; 33(6): 1394-403 16 Mazzaferro V et al.: Lancet Oncol 2009; 10(1): 35-43 17 DuBay D et al.: Ann Surg 2011; 253(1): 166-72 18 Mazzaferro V et al.: Gastroenterology 2018; 154(1): 128-39
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...