Radionuklidtherapie mit Lu-PSMA: Aktuelle Einordnung und Zukunftsaussicht
Autorin:
PD Dr. med. Irene Burger
Chefärztin Nuklearmedizin, Kantonsspital Baden
E-Mail: Irene.Burger@ksb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Anlässlich der Jahrestagung der Deutschen Gesellschaft für Hämatologie und Onkologie war es mir eine Ehre, die Radionuklidtherapie mit Lu-PSMA in einer Session mit dem Fokus auf der Integration neuer Systemtherapien beim metastasierten Prostatakarzinom vorzustellen. Das grosse Interesse in der Onkologie an diesem neuen Therapieansatz ist eine Chance für die Etablierung der internen Bestrahlung beim Prostatakarzinom. Gute Patientenselektion und eine enge Zusammenarbeit zwischen den Disziplinen sind dabei entscheidend für eine optimale Patientenbetreuung.
Keypoints
-
177Lu-PSMA-617 ist eine gut tolerierte, wirksame Alternative für Patienten mit einem hormonresistenten, metastasierten Prostatakarzinom, die nicht mehr auf Taxane in der Erstlinientherapie ansprechen.
-
Die Schmerz- und auch die Lebensqualitäts-Scores fielen unter 177Lu-PSMA-617 deutlich besser aus als in der Kontrollgruppe.
-
Patienten sollten vor der 177Lu-PSMA-Behandlung eine PSMA-PET/CT bekommen, damit Patienten mit fehlendem Target nicht unnötig behandelt werden.
-
Weitere Verbesserungen für die Anwendung von 177Lu-PSMA werden aktuell erforscht. Dazu gehören ein früherer Zeitpunkt, die Kombination mit anderen Therapien, die Anwendung von Alphastrahlern oder auch die Suche nach alternativen Targets für Patienten mit PSMA-negativer Erkrankung.
Das Prinzip der Theragnostik
Die interne Radioligandentherapie (RLT) erlebt seit der Publikation der zwei positiven Phase-III-Studien NETTER-1 und VISION einen enormen Zuwachs. Das Grundprinzip der dort untersuchten Ansätze besteht darin, ein Molekül, das an ein bestimmtes Target bindet (z.B. einen Rezeptor auf einer Tumorzelle), mit einer radioaktiven Substanz, also einem Nuklid, zu markieren. Je nachdem, welches Nuklid man dabei verwendet, kann man sich die unterschiedlichen Eigenschaften der Nuklide zunutze machen.
Gallium-68 (68Ga) oder Fluor-18 (18F) sind Nuklide, die ein Positron emittieren. Dieses Positron kann man mittels eines Positronenemissionstomografen (PET) detektieren und somit das Molekül für die Visualisierung von Metastasen nutzen. Dank der sehr hohen Sensitivität und Spezifität hat sich der PET-Tracer 68Ga-PSMA-11 beim Staging und bei der Detektion von frühen Rezidiven beim Prostatakarzinom (PCa) schnell etabliert. Verwendet man statt des 68Ga-Moleküls Lutetium-177 (177Lu), kann man zusätzlich einen β--Zerfall direkt an der Tumorzelle erzielen. So können Metastasen gezielt lokal bestrahlt werden. Die Anwendung der gleichen Substanz für die Diagnose und die Therapie hat den Begriff der «Theragnostik» geprägt.
Das prostataspezifische Membranantigen (PSMA) wurde schon in den 1980er-Jahren als mögliches Target für Diagnostik und Therapie erkannt und erforscht. Aber erst die deutlich verbesserte, schnellere Biodistribution der in Heidelberg entwickelten kleinen Moleküle (PSMA-11/PSMA-617) hat dank der exzellenten Bildqualität zuerst zu einem Durchbruch in der Diagnostik und dann auch zu einer breiten Anwendung in Heilversuchen geführt.1
Aktuelle Anwendung
Der VISION-Trial
2021 wurden die Daten des VISION-Trials publiziert, der ersten randomisierten, multizentrischen Phase-III-Studie mit Lu-PSMA-617.2 Die zwei primären Endpunkte, ein verlängertes Überleben sowie eine verlängerte progressionsfreie Zeit, wurden beide erreicht. Die insgesamt 831 Patienten wurden 2:1 randomisiert und erhielten entweder Lu-PSMA-617 oder den «Standard of Care», der aber keine Taxane enthalten durfte.
Die Patienten wurden mittels einer 68Ga-PSMA-PET/CT eingeschlossen und mussten mindestens eine Läsion haben, die eine PSMA-Anreicherung in 1,5-facher Höhe der Anreicherung in der Leber aufwies, sowie keine morphologisch abgrenzbaren und gleichzeitig PSMA-negativen Metastasen. Unter der Lu-PSMA-617-Therapie wurde ein vier Monate längeres medianes Überleben erreicht und sie zeichnete sich durch eine gute Verträglichkeit aus. In den nun beim ESMO-Jahrestreffen 2022 präsentierten Daten fielen die von den Patienten selber angegebenen Lebensqualitäts- und Schmerz-Scores im Therapiearm signifikant besser aus als im Kontrollarm.
Die Studie führte zu intensiven Diskussionen. Einerseits bezüglich des Designs (Qualität des Kontrollarms, Drop-out-Rate im Kontrollarm), andererseits aber auch bezüglich der Einschlusskriterien. Durch den relativ niedrig gewählten Cut-off für die PSMA-Anreicherung (1,5-fache Höhe der Anreicherung in der Leber) qualifizierten sich die meisten der Patienten für die Studie (82%). Bei nur 18%, die nicht für die Behandlung infrage kamen, wurde diskutiert, ob man das PSMA-PET/CT überhaupt durchführen sollte.
Andererseits haben mehrere Gruppen gezeigt, dass die Aktivität in der PSMA-PET/CT ein sehr guter Marker für das Ansprechen auf die 177Lu-PSMA-617-Therapie ist, und daraus gefolgert, dass man zukünftig vielleicht eher die Einschlusskriterien etwas enger fassen sollte.
Keine Mismatch-Läsionen:die TheraP-Studie
Noch einen Schritt weiter geht die Gruppe vom Peter MacCallum Cancer Centre in Australien. Sie empfiehlt, bei jedem Patienten eine PSMA- und eine Fluorodeoxyglucose(18F-FDG)-PET/CT durchzuführen und nur Patienten mit 177Lu-PSMA zu behandeln, die keine sogenannten Mismatch-Läsionen aufweisen (d.h. keine PSMA-negativen, aber FDG-positiven Herde). Mit diesem Ansatz versucht man, Patienten zu erkennen, die Tumoranteile aufweisen, die das Target nicht mehr exprimieren, aber einen hohen Stoffwechselumsatz haben und somit von der 177Lu-PSMA-Behandlung im aggressiveren Anteil des Tumors kaum profitieren würden.
Diese strengere Selektion könnte ein Grund dafür sein, warum die Phase-III-Studie TheraP, in der 177Lu-PSMA-617 in der zweiten Linie mit Cabazitaxel verglichen wurde, eine höhere Ansprechrate aufwies als der VISION-Trial.3
Aktuelle Empfehlungen
Kritiker entgegnen, dass grosse Läsionen ohne PSMA-Anreicherung auch schon im CT erkannt werden können und dafür kein FDG benötigt wird. Für einige der gezeigten Fälle stimmt das sicher. Man darf aber nicht vergessen, dass viele Patienten v.a. ossäre Metastasen haben und dass die CT für die Beurteilung der Aktivität ossärer Läsionen äusserst schlecht ist, weil man nur die Knochenreaktion, nicht aber den eigentlichen Tumor sieht.
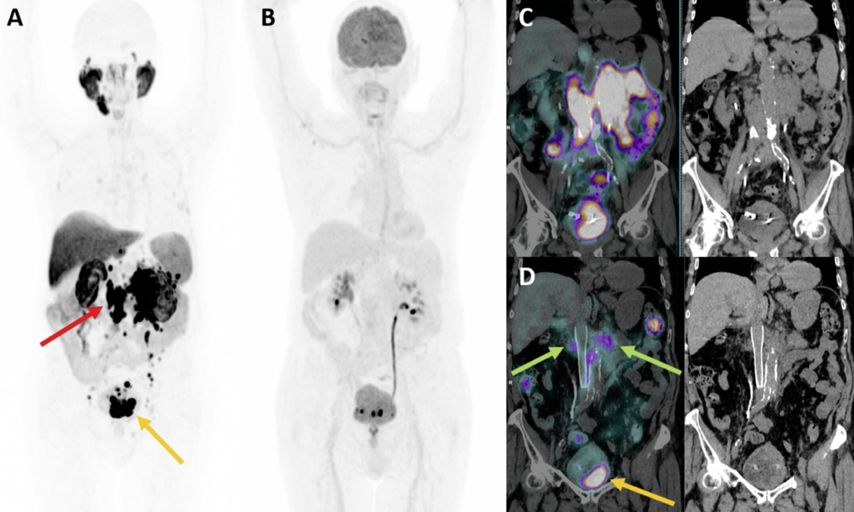
Die Anwendung der FDG-PET/CT ist aber in den meisten Instituten nur für fragliche Fälle reserviert, vor allem aus Kostengründen. Das zeigt sich im Beispiel des Patienten in Abbildung 1, der unter der palliativen Drittlinienbehandlung (Enzalutamid) sehr schnell progredient war und eine untere Einflussstauung aufwies.
Abb. 1: A: koronare Darstellung der 18F-PSMA-1007-PET mit ausgedehnten retroperitonealen Lymphknotenmetastasen (roter Pfeil) sowie einem grossen, stark PSMA-positiven Lokalrezidiv (oranger Pfeil). B: kein Hinweis auf starke metabolische Aktivität in der FDG-PET/CT. C: Im ersten posttherapeutischen 7400 MBq-Lu-PSMA-617-SPECT/CT kann eine starke Nuklidanreicherung bestätigt werden. D: Der dritte Posttherapie-Scan, wieder mit 7400 MBq-Lu-PSMA-617, zeigt eine sehr deutliche Abnahme an Grösse und Aktivität in den retroperitonealen Lymphknoten (grüne Pfeile) sowie eine partielle Reduktion im Bereich des Lokalrezidivs (oranger Pfeil)
Die aktuellen Empfehlungen der europäischen und der nordamerikanischen Gesellschaft für Nuklearmedizin lehnen sich eng an den VISION-Trial an. Sie empfehlen die Durchführung bei Patienten, die ein hormonresistentes Prostatakarzinom haben, das nach mindestens einer Therapielinie mit Taxanen einen Progress zeigt. Analog zum VISION-Trial soll die PSMA-Aktivität des Tumors mindestens der 1,5-fachen Höhe der Leberanreicherung entsprechen. Ein Maximum von sechs Dosen soll im Abstand von jeweils sechs Wochen injiziert werden. Pro Behandlung werden 7,4GBq empfohlen. Die Nierenfunktion darf nicht stark eingeschränkt sein (GFR>30ml/min) und das Blutbild sollte eine Thrombozytenzahl von mindestens 75Tsd/l und eine Leukozytenzahl von über 2,5Tsd/l aufweisen.4
Blick in die Zukunft
Es läuft eine grosse Zahl von Studien, mit denen man die Wirksamkeit der RLT für das PCa weiter verbessern will. Die Studien lassen sich in vier unterschiedliche Ansätze gruppieren:
1. Der erste, wohl naheliegende Ansatz ist die Anwendung der RLT bei Patienten in einem frühen Tumorstadium. Dazu laufen bereits mehrere Phase-III-Studien, welche die 177Lu-PSMA-Behandlung bei Chemotherapie-naiven Patienten direkt nach den hormonellen Behandlungen anwenden wollen (PSMAfore, SPLASH). Noch weiter geht der ADDITION-Trial, der 177Lu-PMSA-617 direkt mit einer Antihormontherapie und einem Androgenrezeptor-Blocker kombiniert. Sogar die Möglichkeit, mit 177Lu-PSMA-617 den Primärtumor lokal zu bestrahlen, wird bereits untersucht (LuTectomy). Die Daten dazu sind noch ausstehend.
2. Der zweite Ansatz erforscht, ob man Lu-PSMA in Kombination mit weiteren Therapien geben kann, um synergistische Wirkungen zu erzielen. Dazu laufen zahlreiche Studien, die beim hormonresistenten PCa 177Lu-PSMA mit Chemotherapie, PARP-Inhibitoren, Hormontherapie oder auch Immuntherapien kombinieren (Tab. 1).
Tab. 1: Übersicht über aktuell laufende Kombinationsstudien mit 177Lu-PSMA beim hormonresistenten PCa
3. Um die Wirkung der PSMA-RLT zu erhöhen, könnte man aber auch ein Nuklid mit einem höheren linearen Energietransfer benutzen, wie zum Beispiel einen Alphastrahler (Actinium-225 [225Ac]). In Südafrika wurde bei 53 Patienten 225Ac-PSMA angewendet. Ein PSA-Abfall von >50% wurde bei 91% der Patienten erreicht, diese hatten ein medianes progressionsfreies Überleben von 22 Monaten.5
Diese drei Ansätze funktionieren nur, wenn der Tumor eine hohe PSMA-Expression aufweist. Ca. 10% der Prostatakarzinome sind aber PSMA-negativ. Deshalb ist die weitere Erforschung von komplementären Targets, die man bei PSMA-negativen Tumoren angehen könnte, zentral.
4. Hierzu gibt es für das PCa aktuell vor allem eine vielversprechende Möglichkeit über den Gastrin-Releasing-Peptid-Rezeptor (GRPR). In einer Studie mit über 100 Patienten konnte gezeigt werden, dass PSMA in der Detektion von signifikantem PCa zwar sensitiver ist als GRPR, aber auch in ca. 10% der Fälle falsch negativ, und dass mit der Kombination von beiden Tracern alle Tumoren detektiert wurden. Dies deutet auf die Möglichkeit einer komplementären Anwendung von PSMA und GRPR auch für therapeutische Ansätze hin.
Literatur:
1 Ahmadzadehfar H et al.: Early side effects and first results of radioligand therapy with (177)Lu-DKFZ-617 PSMA of castrate-resistant metastatic prostate cancer: a two-centre study. Eur J Nucl Med Mol Imaging 2015; 5(1): 114 2 Sartor O et al.: Lutetium-177-PSMA-617 for metastatic castration-resistant prostate cancer. N Engl J Med 2021; 385(12): 1091-103 3 Hofman MS et al.: [(177)Lu]Lu-PSMA-617 versus cabazitaxel in patients with metastatic castration-resistant prostate cancer (TheraP): a randomised, open-label, phase 2 trial. Lancet 2021; 397(10276): 797-804 4 Kratochwil C et al.: EANM procedure guidelines for radionuclide therapy with (177)Lu-labelled PSMA-ligands ((177)Lu-PSMA-RLT). Eur J Nucl Med Mol Imaging. 2019; 46(12): 2536-44 5 Sathekge M et al.: mCRPC patients receiving (225)Ac-PSMA-617 therapy in the post-androgen deprivation therapy setting: response to treatment and survival analysis. J Nucl Med 2022; 63(10): 1496-502
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...