PFS-Verlängerungen beim Prostata-, Mikrobiome beim Nierenzellkarzinom
Autor:
MR Dr. Franz Stoiber
Abteilung für Urologie und Andrologie
Salzkammergut Klinikum Vöcklabruck
E-Mail: franz.stoiber@icloud.com
Im Folgenden werden die klinisch relevanten uroonkologischen Highlights zur Therapie des Prostata- und Nierenzellkarzinoms vom ASCO-Jahrestreffen 2023 präsentiert. Die diesjährigen Teilnehmerzahlen vor Ort näherten sich wieder denen von vor der Pandemie an.
Das rezidivierte lokal fortgeschrittene Prostatakarzinom
STARTAR, eine Phase-II-Studie von T. Zang, untersuchte die Therapieintensivierung im biochemischen Rezidiv einer Hochrisikopopulation nach radikaler Prostatektomie (RPE) mit Androgendeprivation (ADT)/Apalutamid für 36 Wochen/Salvage-Radiotherapie (sRT) und anschließender Docetaxel-Chemotherapie.1 Der PSA-Wert lag bei Studieninitiierung bei 0,58.
Das PSA-PFS (progressionsfreies Überleben) nach drei Jahren erreichten 72% der Patienten. Bei 38/39 der Probanden normalisierte sich der Testosteronspiegel nach drei Jahren, bei 50% bereits nach 15 Monaten.
In der zuletzt am GU-ASCO-Jahrestreffen 2023 vorgestellten FORMULA-509-Studie (sRT/ADT/Abirateron/Apalutamid für sechs Monate) lag die PSA-PFS-Rate nach drei Jahren bei 67% in der Kohorte mit einem Ausgangs-PSA-Wert von >0,5.2
In einer weiteren Referenzstudie, der Studie STREAM, betrug die PSA-PFS-Rate gar nur 54% mit der Kombination ADT/Enzalutamid für sechs Monate.3
Die Patientenselektion beim postoperativen biochemischen Rezidiv basiert bisher nur auf klinischen Relaps-Risikoprofilen und keinerlei genomisch getriggerten.
Der gegenwärtige „standard of care“ (SOC) mit ADT und RT, deren Beginn und Dauer ebenso noch Gegenstand der Diskussion sind, bleibt für eine noch zu definierende Hochrisikopopulation offensichtlich unzureichend.
Daher bedarf es einer breiteren Evidenz für eine Intensivierung mit additiven ARTA (gegen den Androgenrezeptor gerichtete Substanzen) und die Wertigkeit von Docetaxel.
Das hormonsensitive Prostatakarzinom
A. Bossi stellte den zweiten Teil der Phase-III-Studie PEACE-1 vor, in dem der Stellenwert der Radiotherapie in der De-novo/„Low volume“-Gruppe bei 592 Patienten mit hormonsensitivem Prostatakarzinom (HSPC) untersucht wurde, die den aus der ersten Publikation von K. Fizazi bekannten Therapiestandard mit oder ohne Abirateron erhielten.4 Das Follow-up wies 73 Monate auf.
Der SOC bestand aus ADT+Docetaxel, die Radiotherapie wurde mit 74Gy normal fraktioniert und höher dosiert als in den Studien HORRAD und STAMPEDE, die in einer Metaanalyse einen Überlebensvorteil in der „Low volume“-Patientengruppe zeigten.
Dies war nun in der Studie PEACE-1 nicht der Fall, allerdings fiel das rPFS (radiologisches progressionsfreies Überleben) mit einer HR von 0,5 hoch signifikant aus und lag für die Therapieintensivierung mit Abirateron und der RT bei einem Median von 7,5 Jahren.
Der fehlende Gesamtüberlebensvorteil könnte unter anderem auch damit zu erklären sein, dass im Gegensatz zur STAMPEDE-Studie mit nur 18% Patienten mit Docetaxel-Therapie nun ein intensiviertes systemisches Therapieregime bereits einen so hohen Überlebensvorteil vorlegte, dass mit der additiven Radiotherapie keine Signifikanz mehr zu erreichen war.
Im Unterschied zu den beiden vorgenannten Studien war allerdings das Auftreten von schwerwiegenden urogenitalen Nebenwirkungen, wie etwa palliativ notwendigen Prostataresektionen oder Harnableitungen, als klinisch bedeutsamer sekundärer Endpunkt in der RT-Gruppe signifikant geringer.
Dies war unabhängig vom Tumorvolumen sowohl in der „Low volume“-Population als auch in der Gesamtpopulation zu beobachten. Die Addition der RT wäre somit auch für eine noch zu definierende selektionierte „High volume“-Kohorte eine Option.
Das Intervall bis zur Kastrationsresistenz verlängerte sich ebenfalls signifikant für beide Kohorten mit lediglich gering erhöhter, nicht radiotherapieinduzierter Nebenwirkungsrate.
Ob diese Patienten im Falle einer Progression ins kastrationsresistente Stadium dann von einer Kombination mit einem neuerlichen ARTA und einem PARP-Inhibitor in der ersten Linie profitieren, hängt wohl auch vom Mutationsstatus der HRR-Gene ab, obwohl sowohl die PROPEL-Studie mit Olaparib und Abirateron als auch die Studie TALAPRO-2 mit Enzalutamid/Talazoparib in „All-comer“-Kohorten ein signifikant längeres PFS erreichten als mit dem jeweiligen ARTA alleine.
Das nichtmetastasierte kastrationsresistente Prostatakarzinom
In einem Real-World-Vergleich von einer Studiengruppe um A. Morgans und N. Shore konnte nachgewiesen werden, dass im Setting des nichtmetastasierten kastrationsresistenten Prostatakarzinoms (nmCRPC) das Progressionsrisiko zur Kastrationsresistenz mit Darolutamid geringer war als mit Apa oder Enza (18% vs. 28%).5
Vor allem war die Zeit bis zum Therapieabbruch unter Darolutamid länger als mit den anderen beiden ARTA, nicht zuletzt auch deswegen, da unter Darolutamid weniger unerwünschte Arzneimittelwirkungen (AE; 25% vs. 29%) auftraten als unter Apalutamid und Enzalutamid.
Das metastasierte kastrationsresistente Prostatakarzinom
K. Fizazi berichtete über die zweite Kohorte eben dieser eigentlich zwei Phase-III-Studien umfassenden TALAPRO-2-Studie, die knapp 400 Patienten einschloss und nun ausschließlich Patienten mit einem metastasierten kastrationsresistenten Prostatakarzinom (mCRPC) mit HRR-Mutation rekrutierte.6 Nur 8% bzw. 29% waren mit Abirateron bzw. Docetaxel im hormonsensitiven Stadium vortherapiert.
Die häufigsten Genalterationen, die prospektiv sowohl im Gewebe als auch im Blut bestimmt wurden, waren BRCA2, ATM, CDK12, CHECK2 und BRCA1.
Talazoparib/Enzalutamid reduzierte das radiografische Progressionsrisiko signifikant um 55%, ohne das mediane rPFS noch zu erreichen, das im Kontrollarm bei 13,8 Monaten lag. Die größten Effekte sah man in den Subgruppen der alleinigen BRCA2-Mutation, mit einer HR von 0,2, und auch bei Patienten mit CDK12- und BRCA1-Mutation. Jene mit ATM- oder CHECK2-Alterationen profitierten jedoch nicht.
Das Gesamtüberleben zeigte mit einer HR von 0,69 zwar einen Trend zugunsten der Kombination, war aber noch nicht reif genug. Sämtliche sekundären Endpunkte wie die Zeit bis zur Chemotherapie, zur PSA-Progression, das PFS2 wie auch das objektive Ansprechen (67,1% vs. 40%) favorisierten die Talazoparib/Enzalutamid-Kombination. Die Kombination verlängerte auch die Zeit bis zum Auftreten einer Verschlechterung der Lebensqualität.
Neben einer Anämie in knapp 43% der Fälle waren die Neutropenie mit 18% und die Thrombopenie mit 5% die häufigsten AE von Grad 3/4. Die Anämie trat nach median 3,2 Monaten auf und zwang 4% der Talazoparib-Patienten zum Therapieabbruch.
Somit zeigten alle drei Kombinationsregime mit einem PARP-Inhibitor und einem ARTA einen deutlichen PFS-Vorteil mit einem Trend zu einem längeren Gesamtüberleben.
Ob Patienten profitieren, die eine moderne Doublet- oder gar Tripeltherapie im mHSPC(metastasiertes hormonsensitives Prostatakarzinom)-Setting erhielten, muss in weiteren Studien mit aktuellen Therapieregimen geklärt werden.
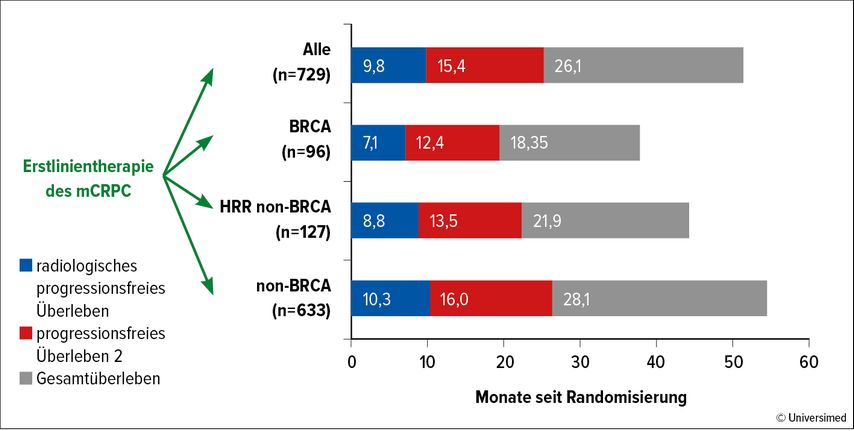
D. Olmos bestätigte anhand des aus fünf Studien bestehenden CAPTURE-Projekts, dass beim mCRPC im Rahmen der DDR-Alteration die BRCA1/2-Mutationen, die mit einer 13%igen Prävalenz die häufigsten gegenüber 17,4% aller non-BRCA-HRR-Mutationen sind, mit der schlechtesten Prognose ausgestattet sind.7
Sowohl das rPFS, das PFS2 und das Gesamtüberleben waren für die Patienten mit BRCA-Mutation mit 18 vs. 28 Monate gegenüber den Patienten ohne HRR-Mutation deutlich kürzer.
In der Subgruppenanalyse war es unerheblich, ob in der Erstlinie mit ARTA oder Taxanen behandelt wurde, ob es sich um mono- oder biallelische, um somatische oder Keimzell- oder um BRCA1- oder BRCA2-Mutationen handelte (Abb. 1). Dies bestätigte wiederum den unbedingten Zwang der Testung im metastasierten Stadium.
Das metastasierte Nierenzellkarzinom
Adjuvante Therapie
R. J. Motzer präsentierte aufschlussreiche Subgruppenanalysen der Kohorte A in der hinsichtlich des primären Endpunktes DFS negativen CheckMate-914-Studie zummetastasierten Nierenzellkarzinom (mRCC), die die adjuvante Immuntherapie-Kombination Nivolumab+Ipilimumab mit Placebo verglich.8 Er konnte zeigen, dass vorhandene tumorspezifische Charakteristika wie sarkomatoide Komponenten, hohes Tumorstadium und eine hohe PD-L1-Expression sehr wohl einen DFS-Benefit für die IO-Kombination bedeuten könnten. Die Patientenzahlen in diesen Subgruppen waren allerdings sehr klein, sodass die Ergebnisse natürlich nur hypothesengenerierend sein können.
Frühzeitige Therapieabbrüche (<6 Zyklen) führten zu einem kürzeren DFS, waren aber nicht hauptausschlaggebend für das Nichterreichen des Studienendpunktes. Die Ipilimumab-Dosierung von 1mg/kg KG wurde dabei alle sechs Wochen, die Nivolumab-Dosis von 240mg alle zwei Wochen verabreicht.
Dies bedeutet, dass trotz des nicht verlängerten DFS die IO-Kombination in bestimmten Subpopulationen doch eine deutliche Wirksamkeit entfaltet und weiter in Studien geprüft werden sollte.
Ausstehend ist noch die Kohorte B, in der das DFS bei Nivolumab-Monotherapie vs. die IO-Kombination und Placebo verglichen wird.
Erstlinientherapie
B. I. Rini und T. Hutson stellten das Follow-up nach vier bzw. fünf Jahren der Studie KEYNOTE-426 mit Pembrolizumab/Axitinib bzw. der Studie CLEAR mit Pembrolizumab/Lenvatinib vor, die die bekannten klinischen Erfolgsparameter wie komplettes Ansprechen (CR), Gesamtansprechrate (ORR), PFS und auch das Gesamtüberleben (OS) für Patienten mit mRCC mit einem intermediären/hohen Risiko der vorangegangenen Follow-ups zugunsten der TKI/IO-Kombinationstherapie gegenüber Sunitinib bestätigten.8,9
Die kontroverse Diskussion drehte sich einerseits um die Ansprechdauer, die in der CLEAR-Studie mit 41% in 36 Monaten und in der Studie KEYNOTE-426 mit 28% nach fünf Jahren doch deutlich unter den 56% der Studie CheckMate-214 mit Nivolumab+Ipilimumab nach fünf Jahren liegt.
Andererseits bleiben beide Studien trotz des langen Nachbeobachtungsintervalls die Antwort bezüglich OS und auch Ansprechdauer in der günstigen Risikogruppe schuldig, sodass hier weiterhin mehrere Therapieoptionen wie TKI-Monotherapie, IO-Monotherapie, TKI/IO-Kombinationstherapie und die aktive Überwachung möglich scheinen.
L. Albiges argumentierte dabei deutlich für eine TKI/IO-Kombination, da sowohl die außergewöhnlichen Ansprechraten von über 55–73% der Studien KEYNOTE-426, CheckMate-9ER und CLEAR und die mit unter 10% niedrigen PD(fortschreitende Erkrankung)-Raten einen eindeutigen relevanten klinischen Benefit für individuelle Patienten darstellen, auch wenn die OS-Daten (noch) keine Signifikanz zeigen.
Zwei und mehr Therapielinien
Die Frage, ob eine Rechallenge mit einer Immuntherapie nach einer immunbasierten Vortherapie in der ersten oder zweiten Linie eine Effektivität besitzt, musste T. K. Choueiri in der Studie COMPACT-03 negativ beantworten, denn die Addition von Atezolizumab zu Cabozantinib war mit keinem Vorteil im PFS und im OS, in der ORR und der PD-Rate gegenüber dem alleinigen TKI Cabozantinib verbunden.10
Die Performance des Cabozantinib-Vergleichsarms war mit einer Ansprechrate von 40% besser als in der Zweitlinien-Zulassungsstudie METEOR für Cabozantinib mit 21% und der CABOSUN-Studie mit 29%.
Kritikpunkt war die Wahl von Atezolizumab, einem PD-L1-Inhibitor, als Kombinationspartner von Cabozantinib, obwohl diese Inhibitoren (Atezolizumab und Avelumab) in der Therapie des mRCC keine Rolle spielen.
Weiters war die „Wash-out“-Phase relativ kurz, sodass eine protrahierte Rezeptorblockade aus der Vortherapie die neuerliche IO-Wirkung beeinflussen kann und eine Effizienz eines Checkpoint-Inhibitors zu einem späteren Zeitpunkt denkbar wäre.
Mit der Kombinationstherapie beobachtete man mehr Nebenwirkungen von Grad 3/4 (55% vs. 47%) und mehr behandlungs- und immunassoziierte Todesfälle (3 bzw. 2) mit einer Verdoppelung der schwerwiegenden unerwünschten Ereignisse und einer doppelten Abbruchrate der Cabozantinib-Medikation.
Die immunbasierten Rechallenge-Phase-II-Studien mit Nivolumab+Ipilimumab konnten ebenfalls lediglich ein Ansprechen von 4–14% aufweisen, sodass eine TKI-Monotherapie in der Zweitlinie weiterhin als SOC gilt. Einen endgültigen Ausschluss einer TKI/IO-Kombination bedeutet diese Studie für dieses Stadium allerdings noch nicht.
Eine weitere Klärung könnte vielleicht die laufende TiNivo-2-Studie bieten.
Erstlinientherapie des metastasierten nichtklarzelligen Nierenzellkarzinoms
Die von C. H. Lee präsentierte Studie KEYNOTE-B61 setzt in der Erstlinientherapie des metastasierten nichtklarzelligen Nierenzellkarzinoms (mnccRCC) mit der TKI/IO-Kombination Pembrolizumab+Lenvatinib neue Maßstäbe und wird trotz lediglich einer Phase II mit 158 Patienten und einem kurzen Follow-up von 15 Monaten als neue Therapieoption neben Cabozantinib+Nivolumab oder Cabozantinib-Monotherapie angesehen.11
Alle histologischen Varianten hatten eine objektive Ansprechrate von 49%, wobei erwartungsgemäß die chromophoben Tumoren mit 28% das geringste Ansprechen aufwiesen. Die papillären und Translokationstumoren zeigten sogar eine ORR von 54% bzw. 67%. Die DCR (Krankheitskontrollrate) ist mit 82% klinisch herausragend, das PFS setzt mit 17,9 Monaten einen neuen Maßstab und liegt im Bereich des klarzelligen Karzinoms. Das OS war noch nicht erreicht, wobei aber 76% der Patienten nach >12 Monaten noch ein Ansprechen zeigten, 88% irgendeine Tumorreduktion aufwiesen und nur 11% eine PD als bestes Ansprechen hatten.
Mit 44% waren außergewöhnlich viele Patienten in der günstigen IMDC-Risikogruppe, mit einer allerdings der ORR der intermediären/schlechten Risikogruppe nahezu identen Ansprechrate.
12% hatten einen sarkomatoiden Anteil, 58% waren PD-L1-positiv mit einem CPS >1, sodass diese Charakteristika die außerordentlich guten Daten erklären könnten. Nur 3,2% mussten das gesamte Regime abbrechen, 34% benötigten eine Lenvatinib-Dosisreduktion und 65% hatten eine Nebenwirkung von Grad 3/4, sodass das Toxizitätsprofil dem entsprach, das man von der CLEAR-Studie mit Lenvatinib und Pembrolizumab kennt.
KEYNOTE-B61 ist damit die größte Studie, gefolgt von jener mit Cabozantinib+Nivolumab, ebenfalls von C. H. Lee, die mehr als 40 Patienten rekrutierte und ein Follow-up von 34 Monaten, eine ORR von 41% und ein PFS von 13 Monaten erreichte, allerdings mit Ausschluss von chromophoben Tumoren.
B. A. McGregor versuchte, die Tripelkombination CaNI (Cabozantinib+Nivolumab+Ipilimumab), deren Effizienz und Sicherheitsprofil schon beim metastasierten ccRCC in der Erstlinientherapie nicht überzeugen konnten, beim mnccRCC einzusetzen. Sie zeigte dieselben Probleme auf wie in der COSMIC-Studie.12
Die Ansprechraten waren mit einer DCR von 77% und einer PD von 23% nach einem Follow-up von erst 10 Monaten bescheiden, die Dosierung war aufgrund der Nebenwirkungen kompromittiert: Nur 44% erhielten vier Zyklen Ipilimumab, 89% der Patienten erforderten eine Cabozantinib-Dosisreduktion und 61% erhielten gar keine Nivolumab-Erhaltungstherapie.
74% erlebten eine Nebenwirkung von Grad 3/4 mit 10% kardiogener Natur, 44% benötigten hoch dosierte Steroidgaben und 21% brachen die Therapie nebenwirkungsbedingt ab.
Die Wertigkeit des Mikrobioms
Die Wertigkeit des Mikrobioms in der Immuntherapie des mRCC steigt bei den letzten Kongressen immer mehr. Das war auch bei diesem ASCO-Jahrestreffen der Fall.
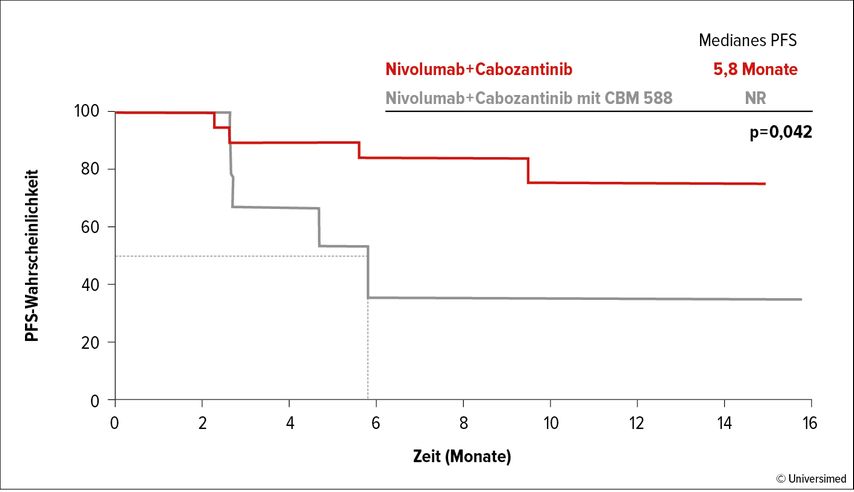
In einer richtungsweisenden, sehr kleinen (n=30), randomisierten Studie untersuchte die Gruppe um S. Pal und H. Ebrahimi die Kombination Nivolumab+Cabozantinib vs. Nivolumab+Cabozantinib mit CBM 588, einem oral verfügbaren bakteriellen Produkt eines Clostridium-butyricum-Stammes.13
Dieses wird im oberen Darmtrakt vervielfältigt und setzt Butyrat frei. Dadurch ändert sich die Zusammensetzung der Flora mit Zunahme unter anderem von Lactobacillus und Bifidobacterium.
Der primäre Endpunkt, das Ausmaß der Bifidobakterienstämme nach zwölf Wochen zu erhöhen, wurde nicht erreicht. Letztendlich konnte aber das mediane PFS im experimentellen Arm gegenüber den 5,8 Monaten im Vergleichsarm verlängert werden und war noch nicht erreicht (Abb. 2). Die Initiierung einer Phase-III-Studie wird diskutiert.
Abb. 2: Der sekundäre Endpunkt progressionsfreies Überleben (PFS) bei Nivolumab+Cabozantinib vs. Nivolumab+Cabozantinib mit CBM 588. Modifiziert nach Ebrahimi H et al.13
Literatur:
1 Zhang T et al.: Primary analysis of STARTAR: a phase 2 salvage trial of androgen receptor (AR) inhibition with androgen deprivation therapy (ADT) and apalutamide with radiation therapy (RT) followed by docetaxel in men with PSA recurrent prostate cancer (PC) after radical prostatectomy (RP). ASCO 2023; Abstr. #5016 2 Nguyen P et al.: FORMULA-509-Studie: sRT/ADT/Abirateron/Apalutamid für 6 Monate. GU-ASCO 2023; Abstr. #303 3 Bitting RL et al.: Phase II trial of enzalutamide and androgen deprivation therapy with salvage radiation in men with high-risk prostate-specific antigen recurrent prostate cancer: the STREAM trial. Eur Urol Oncol 2021; 4(6): 948-54 4 Bossi A et al.: Prostate irradiation in men with de novo, low-volume, metastatic, castration-sensitive prostate cancer (mCSPC): results of PEACE-1, aphase 3 randomized trial with a 2x2 design. ASCO 2023; Abstr. #LBA 5000 5 Morgans A et al.: Comparative real-world (RW) evidence on darolutamide (Daro), enzalutamide (Enza), and apalutamide (Apa) for patients (Pts) with nonmetastatic castration-resistant prostate cancer (nmCRPC) in the United States: DEAR. ASCO 2023; Abstr. #5097 6 Fizazi K et al.: TALAPRO-2: phase 3 study of talazoparib (TALA) + enzalutamide (ENZA) versus placebo (PBO) + ENZA as first-line (1L) treatment for patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) harboring homologous recombination repair (HRR) gene alterations. ASCO 2023; Abstr. #5004 7 Olmos D et al.: Presence of somatic/germline homologous recombination repair (HRR) mutations and outcomes in metastatic castration-resistant prostate cancer (mCRPC) patients (pts) receiving first-line (1L) treatment stratified by BRCA status. ASCO 2023; Abstr. #5003 8 Motzer RJ et al.: Adjuvant nivolumab plus ipilimumab vs placebo for patients with localized renal cell carcinoma at high risk of relapse after nephrectomy: subgroup analyses from the phase 3 CheckMate 914 (part A) trial. ASCO 2023; Abstr. #4506 9 Rini BI et al.: Pembrolizumab plus axitinib versus sunitinib as first-line therapy for advanced clear cell renal cell carcinoma: 5-year analysis of KEYNOTE-426. ASCO 2023; Abstr. #4501 10 Choueiri TK et al.: Efficacy and safety of atezolizumab plus cabozantinib vs cabozantinib alone after progression with prior immune checkpoint inhibitor (ICI) treatment in metastatic renal cell carcinoma (RCC): primary PFS analysis from the phase 3, randomized, open-label CONTACT-03 study. ASCO 2023; Abstr. #LBA 4500 11 Lee CH et al.: First-line lenvatinib + pembrolizumab treatment across non-clear cell renal cell carcinomas: results of the phase 2 KEYNOTE-B61 study. ASCO 2023; Abstr. #4518 12 McGregor BA et al.: Phase II study of cabozantinib (Cabo) with nivolumab (Nivo) and ipilimumab (Ipi) in advanced renal cell carcinoma with variant histologies (RCCvh). ASCO 2023; Abstr. #4520 13 Ebrahimi H et al.: Effect of CBM588 in combination with cabozantinib plus nivolumab for patients (pts) with metastatic renal cell carcinoma (mRCC): arandomized clinical trial. ASCO 2023; Abstr. #LBA104
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...