Personalisiertes Screening für die Brustkrebsfrüherkennung
Autoren:
Dr. med. Sophie Dellas
Leitende Ärztin abdominelle und onkologische Diagnostik/Mammadiagnostik
Klinik für Radiologie und Nuklearmedizin
Universitätsspital Basel
Prof. Dr. med. Athanassios Dellas
Von 2013 bis 2019 Aufbau und Leitung des Brustkrebs-Früherkennungsprogramms für den Kanton Basel-Stadt
Departement Klinische Forschung
Universität Basel
Korrespondenz:
E-Mail: sophie.dellas@usb.ch
Brustkrebs ist die weltweit häufigste Krebs-Todesursache bei Frauen und die zweithäufigste Krebs-Todesursache bei Frauen in den entwickelten Ländern.1,2 Fortschritte in der Behandlung und das Mammografie-Screening haben zu einer Reduktion der Brustkrebssterblichkeit geführt. Die Brustkrebsfrüherkennung der Zukunft ist kein «One size fits all»-populationsbasiertes Mammografie-Screening.
Keypoints
-
«One size fits all»-Mammografie-Screening ist nicht die Zukunft der Brustkrebsfrüherkennung.
-
Fortschritte auf dem interdisziplinären Gebiet der Genomik und beim Risiko-Profiling werden einen Wechsel zu personalisierten Screening-Programmen auf der Basis des individuellen Risikoprofils einleiten.
-
Auf der Grundlage partizipativer Entscheidungsfindung werdenFrauen mit erhöhtem Risiko für Brustkrebs ein individuelles Vorgehen zum personalisierten Mammografie-Screening mit ihren Ärzten definieren.
Seit der Implementierung des ersten Brustkrebs-Screeningprogramms vor mehr als einem halben Jahrhundert in New York3 wurden weltweit zahlreiche Mammografie-Screeningprogramme aufgebaut. Die Programme der einzelnen Länder unterscheiden sich hinsichtlich der Zielgruppen. Meist handelt es sich um populationsbasierte Programme ohne Berücksichtigung des persönlichen Erkrankungsrisikos einer Frau. Zusätzlich zu diesen populationsbasierten Programmen existieren in zahlreichen Ländern Empfehlungen zur Brustkrebsfrüherkennung bei Frauen mit hohem und sehr hohem Risiko für eine Brustkrebserkrankung. Populationsbasiertes Screening «one size fits all» hat ausser der gewünschten Mortalitätsreduktion auch Nachteile. Die Idee des personalisierten Brustkrebs-Screenings ist es, das Verhältnis von Nutzen und Nachteilen eines Screeningprogramms durch Berücksichtigung weiterer Risikofaktoren und neuer Technologien der Bildgebung zu optimieren.4
Empfehlungen für das populationsbasierte Screening
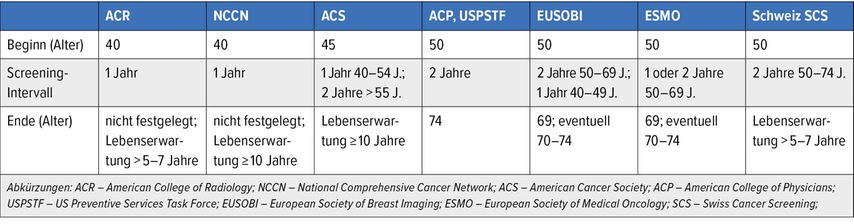
In den meisten Ländern Europas ist das Mammografie-Screening in 1- bis 2-jährlichen Intervallen etabliert (Tab. 1). Lediglich Grossbritannien und Malta offerieren das Screening im Abstand von 3 Jahren. Das Alter der Frauen wird in allen europäischen Programmen als einziger Risikofaktor berücksichtigt. Das Screening beginnt zwischen dem 40. und 50. Lebensjahr und endet mit 64 bis 74 Jahren.5 In den USA empfiehlt die US Preventive Services Task Force (USPTIF) das Mammografie-Screening 2-jährlich für Frauen von 50–74 Jahren, wenn sie ein durchschnittliches Erkrankungsrisiko haben.6
Pro und Kontra des populationsbasierten Screenings
Die Mammografie ist die einzige bildgebende Modalität, für welche in randomisierten klinischen Trials eine Reduktion der Brustkrebsmortalität von 25% bis 30% nachgewiesen werden konnte. Die Teilnahme am Mammografie-Screening führt ausserdem zu einem Stage-Shift. Das heisst, die im Programm nachgewiesenen Karzinome haben ein niedrigeres Tumorstadium und benötigen eine weniger intensive Behandlung mit hieraus resultierender besserer Lebensqualität für die betroffenen Frauen. Nachteile des Screenings sind falsch positive Befunde von bis zu 10% mit erforderlicher Abklärung durch zusätzliche Bildgebung und Biopsien, falsch negative Befunde, Intervallkarzinome, Abklärung und Behandlung von nicht malignen Zufallsbefunden sowie Überdiagnose und Überbehandlung kleiner Malignome, welche ohne Screening zu Lebzeiten der Frau weder entdeckt noch behandelt worden wären.
Risiko-Assessment und Risiko-Management
Vor Einführung eines risikobasierten Screenings ist eine Reihe von Fragen zu beantworten:
-
Wann und wie oft und durch wen soll das Risiko-Assessment erfolgen?
-
Welche Risikofaktoren sollen in das Assessment einbezogen werden?
-
Welche Schwellenwerte werden für die Risikostratifizierung festgelegt?
-
Wie viele Risikogruppen gibt es?
-
Wer soll ein Screening erhalten, wann, wie oft und mit welchen Methoden soll es durchgeführt werden?
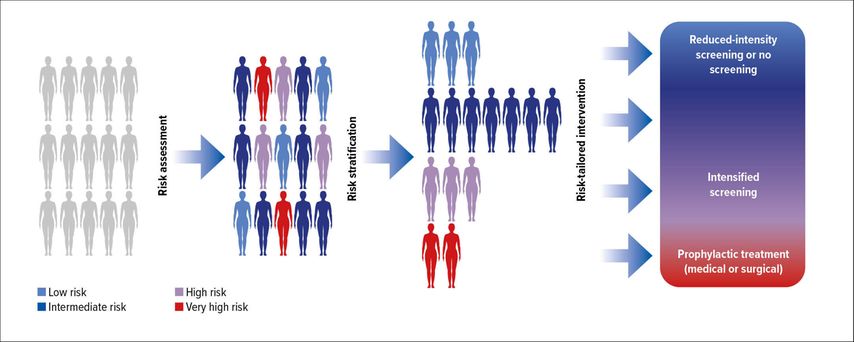
Neben der Identifikation von Frauen mit einem hohen Risiko für eine Brutkrebserkrankung müssen auch diejenigen Frauen identifiziert werden, deren Erkrankungsrisiko sehr gering ist (Abb. 1). Sollten Frauen mit einem geringen Risiko in grösseren Abständen zum Screening gehen oder sollte ihnen wegen des Überwiegens der Nachteile von der Teilnahme am Screening abgeraten werden?7
Abb. 1: Risikostratifiziertes Brustkrebs-Früherkennungsprogramm. Vor Teilnahme an einem personalisierten Brustkrebs-Früherkennungsprogramm wird für teilnehmende Frauen mit einem validierten Tool das individuell geschätzte Risiko für Brustkrebs bestimmt. Entsprechende Risikogruppen erlauben eine gezielte Intervention. Dieses Vorgehen könnte für einige Frauen zum Beginn des Mammografie-Screenings in einem jüngeren Alter führen, unterschiedliche Screening-Intervalle zur Folge haben oder die Anwendung zusätzlicher Imaging-Modalitäten, wie MRI, erfordern. Frauen mit sehr hohem Risiko für Brustkrebs würden das Angebot für eine prophylaktische onkologische oder chirurgische Behandlung erhalten (nach Pashayan et al.)7
Modelle zur Risikoberechnung
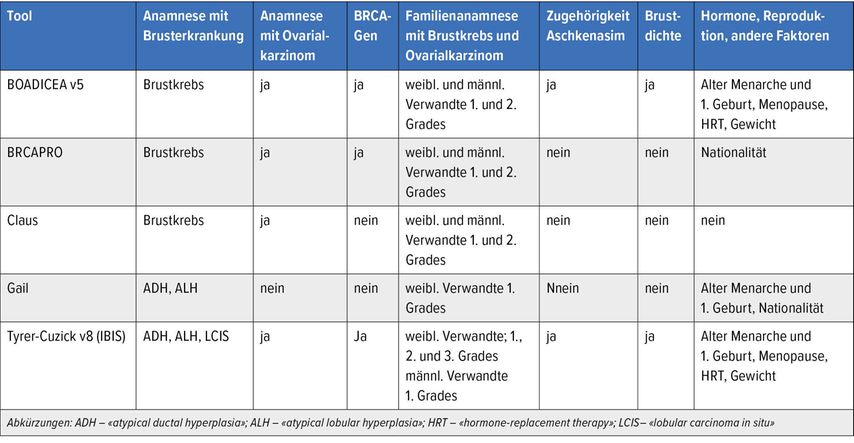
Es steht eine Reihe von Modellen zur Verfügung, mit deren Hilfe das individuelle Brustkrebserkrankungsrisiko einer Frau ermittelt werden kann (Tab. 2). Das Risiko wird als Lebenszeitrisiko angegeben und als Erkrankungsrisiko während eines kürzeren Zeitraumes von maximal 2–10 Jahren. Die Modelle beziehen unterschiedliche Risikofaktoren ein und sind für unterschiedliche Populationen validiert. Die bekanntesten Modelle sind das Gail-Modell8 für Frauen ohne relevantes familiäres Risiko, während das Claus-Modell9, das IBIS-Modell (Tyrer-Cuzick)10, BOADICEA11 und BRCAPRO12 für Frauen mit einem familiären Risiko für Brustkrebs und/oder Ovarialkarzinom geeignet sind. Von den genannten Tests berücksichtigen nur BOADICEA v5 und IBIS v8 die Brustdichte als Risikofaktor.
Brustdichte als Risikofaktor
Eine mammografisch hohe Brustdichte bringt zwei Probleme mit sich. Zum einen ist sie mit einem höheren Brustkrebsrisiko assoziiert. Zum anderen reduziert sie die Sensitivität der Mammografie und ist so die Ursache einer höheren Rate von Intervallkarzinomen. Da nur ein Viertel der Frauen mit dichter Brust ein hohes Intervallkarzinomrisiko hat, sollte die Brustdichte nicht als alleiniger Risikofaktor für das Risikoassesment verwendet werden. Sie sollte mit dem Alter und anderen klinischen Risikofaktoren in Risikomodellen kombiniert verwendet werden, um das Verhältnis von Nutzen und Nachteilen des Screenings zu optimieren.13
Gentests zur Risikoermittlung
Genetische Varianten, die mit erhöhtem Brustkrebsrisiko vergesellschaftet sind, können in pathogene Varianten (PV) mit hoher Penetranz, PV mit moderater Penetranz und Single-Nukleotide-Polymorphismen (SNP) unterteilt werden. PV mit hoher Penetranz haben ein relatives Risiko von 5 bis >20. Hierzu gehören unter anderem BRCA1, BRCA2, PTEN, CDH1 und TP53. PV mit moderater Penetranz (ATM; BRIP1; CHEK2; PALB2) sind mit einem relativen Risiko von 2 bis 5 assoziiert. SNP sind nur mit einem sehr kleinen relativen Risiko von <1,5 vergesellschaftet. Derzeit sind mehrere Hundert solcher SNP bekannt. Multiple SNP in Panels und polygene Risikoscores könnten künftig als Tool zur Berechnung des individuellen Risikos eingesetzt werden14,15 und zur Entscheidungsfindung für ein individualisiertes Screening beitragen.16
Personalisiertes Screening für die Brustkrebsfrüherkennung
In Europa und in den USA wurden in den vergangenen Jahren mehrere randomisierte prospektive Trials lanciert, welche das risikoadaptierte Screening mit dem populationsbasierten Screening vergleichen. Es soll der Nachweis erbracht werden, dass risikoadaptiertes Screening zumindest gleichwertig oder aber besser als populationsbasiertes Screening hinsichtlich des Tumornachweises, der Kosteneffektivität und der Akzeptanz ist. Der italienische Tailored Breast Screening Trial (TBST; NCT02619123) wurde 2015 begonnen und verwendet ausschliesslich die mammografische Dichte zur Risikostratifizierung. «My Personal Breast Screening» (MyPeBS; https://mypebs.ei/; NCT03672331) läuft seit 2019 in 5 europäischen Staaten. Das Risikoassessment erfolgt mit modifizierten Risikorechnern (Mammorisk™ und Tyrer-Cuzick™), die ausser den bekannten Risikofaktoren auch die Brustdichte und polygene Risikoscores in die Kalkulation einbeziehen. Der «Women Informed to Screen Depending on Measures of Risk» (WISDOM) Trial wurde 2016 in den USA begonnen. In die Risikoberechnung gehen neben den klinischen Risikofaktoren auch die Brustdichte und genetische Informationen ein.17,18
Risikoadaptierte Bildgebung
Seit der Einführung der ersten Screeningprogramme ist die Mammografie unverändert Methode der Wahl. Sie ist gut verfügbar, die Kosten sind relativ gering und die Wirksamkeit der Methode für die Brustkrebsfrüherkennung ist erwiesen. Eine Reihe neuer Technologien der Bildgebung steht sowohl für die Abklärung suspekter Befunde als auch für den Einsatz im Screening zur Verfügung. Mit digitaler Tomosynthese, Ultraschall und automatisiertem Brustultraschall (ABUS), Kontrastmittelmammografie und MRT können Karzinome nachgewiesen werden, welche mit 2D-Mammografie dem Nachweis entgehen. Jede dieser Methoden hat spezifische Vor- und Nachteile. Für jede einzelne Methode ist der Beweis zu erbringen, dass sie für den Einsatz im Screening geeignet ist und für welche Population sie vorteilhaft eingesetzt werden kann.19
Potenzielle Nachteile des risikoadaptierten Screenings
Der offensichtliche Nachteil eines risikobasierten Screenings ist die Komplexität im Vergleich zu einem populationsbasierten Screening. Der Prozess der Risikoermittlung sowie die Notwendigkeit der periodischen Reevaluation des Risikos und der daraus folgenden Anpassungen der Screeningempfehlungen sind eine Herausforderung für das medizinische Personal. Die Empfehlungen sind weniger leicht zu kommunizieren und zu verstehen als die einheitliche Empfehlung in einem populationsbasierten Programm. Die Folgen könnten eine geringere Akzeptanz seitens der Frauen und eine geringere Teilnahmerate sein. Weitere mögliche Folge des personalisierten Screenings könnte die Definition einer neuen «Low Risk»-Kategorie sein, mit der Empfehlung von weniger häufigen Screeninguntersuchungen oder dem gänzlichen Verzicht auf die Teilnahme am Screening. Gefahren dieser personalisierten Vorgehensweise liegen in der Verstärkung sozioökonomischer Unterschiede, der Auslösung von Angst und in der Stigmatisierung aufgrund des Risikos oder der Nichtteilnahme am Screening.7
Zusammenfassung
Es gibt klare Evidenz, dass die aktuelle Screeningpopulation mit Modellierungswerkzeugen, welche die Brustdichte, klinische Risikofaktoren und die Bestimmung der SNP umfassen, nach Risikoprofilen stratifiziert werden kann. Personalisiertes Screening aufgrund des individuellen Risikos einer Frau hat das Potenzial, einerseits relevante Malignome in einem frühen Tumorstadium zu entdecken und andererseits Überdiagnosen und daraus folgende Übertherapien zu vermeiden. Aktuelle klinische Trials evaluieren die Effektivität eines risikobasierten Screenings und der verfügbaren Bildgebungstechnologien, die Akzeptanz seitens der Frauen und die Kosteneffektivität dieser Programme.
Literatur:
1 Sung H et al.: Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021; 71: 209-49 2 Ferlay J et al.: Cancer statistics for the year 2020: An overview. Int J Cancer 2021; 149: 778-89 3 Strax P et al.: Value of mammography in reduction of mortality from breast cancer in mass screening. Am J Roentgenol Radium Ther Nucl Med 1973; 117: 686-89 4 Morris EA: What is the future of breast cancer screening? Health Management 2018; 18: 292-96 5 Peintinger F: National breast screening programs across Europe. Breast Care (Basel) 2019; 14: 354-58 6 Saccarelli CR et al.: Is It the era for personalized screening? Radiol Clin N Am 2021; 59: 129-38 7 Pashayan N et al.: Personalized early detection and prevention of breast cancer: ENVISION consensus statement. Nat Rev Clin Oncol 2020; 17: 687-705 8 Gail Breast Cancer Risk Assessment Tool: NIH National Cancer Institute; 2021. Online unter: https://bcrisktool.cancer.gov/ 9 Claus EB et al.: Autosomal dominant inheritance of early-onset breast cancer. Implications for risk prediction. Cancer 1994; 73: 643-51 10 Tyrer-Cuzick/IBIS Risk Assessment Tool v8.0b: Wolfson Institute of Preventive Medicine, Queen Mary University of London; 2021. Online unter: https://ibis.ikonopedia.com 11 CanRisk Web Tool/BOADICEA v5: University of Cambridge; 2021. Online unter: https://www.canrisk.org/ 12 BRCAPRO: U.T. Southwestern Medical Center at Dallas. Online unter: http://www4.utsouthwestern.edu/breasthealth/cagene 13 Kerlikowske K, Bibbins-Domingo K: Toward risk-based breast cancer screening. Ann Intern Med 2021; 174: 710-11 14 Mavaddat N et al.: Prediction of breast cancer risk based on profiling with common genetic variants. J Natl Cancer Inst 2015; 107 15 Mavaddat N et al.: Polygenic risk scores for prediction of breast cancer and breast cancer subtypes. Am J Hum Genet 2019; 104: 21-34 16 Lo Gullo R et al.: Combining molecular and imaging metrics in cancer: radiogenomics. Insights Imaging 2020; 11: 17 17 Esserman LJ et al.: The WISDOM Study: breaking the deadlock in the breast cancer screening debate. NPJ Breast Cancer 2017; 3: 34 18 Eklund M et al.: The WISDOM Personalized Breast Cancer Screening Trial: simulation study to assess potential bias and analytic approaches. JNCI Cancer Spectr 2018; 2: pky067 19 Gilbert FJ, Selamoglu A: Personalised screening: is this the way forward? Clin Radiol 2018; 73: 327-33
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...