Organerhalt beim Rektumkarzinom, Interdisziplinarität zugunsten der Lebensqualität
Autor:innen:
Prof. Dr. Cihan Gani
Jakob Ehlers
Dr. Simon Böke
Prof. Dr. Michael Bitzer
Prof. Dr. Rüdiger Hoffmann
Dr. Stefano Fusco
PD Dr. Robert Bachmann
PD Dörte Wichmann
Universitätsklinikum
Klinik für Radioonkologie, Tübingen
Korrespondenz:
Prof. Dr. med. Cihan Gani
Stellvertretender ärztlicher Direktor
Ärztlicher Leiter des MVZ des Universitätsklinikums
Klinik für Radioonkologie, Tübingen
E-Mail: cihan.gani@med.uni-tuebingen.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Weiterentwicklungen in der multimodalen Therapie, der Immuntherapie und der Präzisionsstrahlentherapie ermöglichen immer mehr Patient:innen eine organerhaltende Therapie ihres Rektumkarzinoms.
Die zunehmende Intensivierung der multimodalen Therapie des lokal fortgeschrittenen Rektumkarzinoms hat über die letzten Jahrzehnte zu einer kontinuierlichen Senkung der Rate der häufig nur schwer behandelbaren Lokalrezidive geführt.1 Diese multimodale Therapie besteht aus neoadjuvanter Radiochemotherapie mit nachfolgender operativer Sanierung des Tumors und gegebenenfalls einer adjuvanten Chemotherapie.
Jedoch sind die Einschränkungen der Lebensqualität erheblich. Von einer schweren Ausprägung des „low anterior resection syndrom“ („major LARS“) berichtet noch Jahre nach Abschluss der Therapie mehr als die Hälfte der Patient:innen, bei denen ein Schließmuskelerhalt operativ möglich war.2
Heutzutage gilt es als anerkannt, dass bei Patient:innen, bei denen nach einer Vorbehandlung kein Hinweis auf ein vitalen Tumorrest mehr besteht, die Operation zugunsten einer engmaschigen Verlaufskontrolle ausgelassen werden kann.3 Während mit einer „Standard“-Radiochemotherapie der Anteil der Patient:innen, die eine klinische Komplettremission erreichen und in einen „Watch&wait“-Ansatz übergeführt werden können, bei nur 10–15% liegt, konnten neue innovative Ansätze in den letzten Jahren zu einer deutlichen Erhöhung dieser Quote führen.
Der vorliegende Artikel soll einen Überblick über diese Ansätze geben.
Definition der klinischen Komplettremission
Die diagnostischen Modalitäten der Wahl für die Beurteilung des Ansprechens auf eine Strahlentherapie von Rektumtumoren sind die Rektoskopie, die Kernspintomografie und die digitalrektale Untersuchung. Die zum Einsatz kommenden Kriterien variieren zwischen Studien, es besteht aber weitestgehender Konsens, dass eine klinische Komplettremission vorliegt, wenn sich bei der digitalrektalen Untersuchung und der Rektoskopie kein palpabler Resttumor mehr zeigt und morphologisch nur noch ein kleines Ulkus oder eine weißliche Narbe vorliegt.3
Die Kernspintomografie ist vor allem für die Beurteilung der umliegenden Lymphknoten von Relevanz. Lymphknoten, die nach einer Radiochemotherapie im Kurzachsen-Durchmesser kleiner als 5mm dargestellt werden, haben ein geringes Risiko für ein residuellen Tumorbefall.4
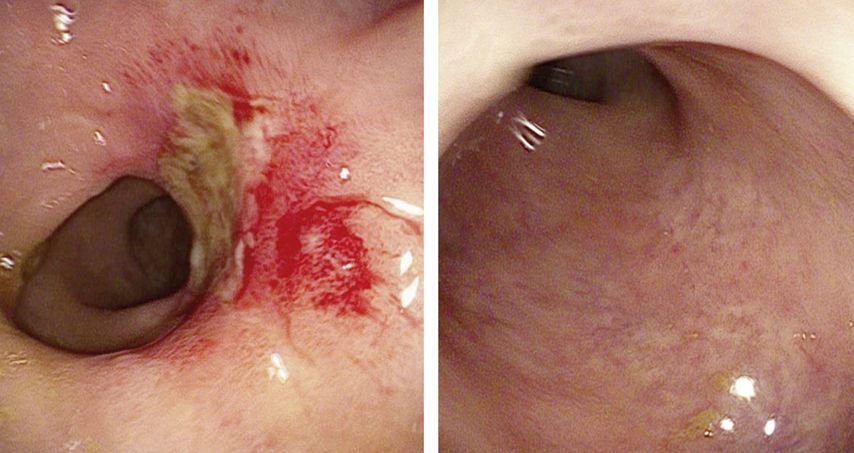
Vermehrt wird in der Literatur auch die „nahe klinische Komplettremission“ berichtet.5 Beispiele für diese zwei Graduierungen sind in Abbildung 1 illustriert. Unter der „nahen klinischen Komplettremission“ versteht man ein sehr gutes Ansprechen auf die Radiochemotherapie, jedoch mit verbliebenen nodulären Erscheinungen oder fibrinbelegten Ulzera in der Rektoskopie.
Abb. 1: Beispiel für eine „nahe klinische Komplettremission“ nach TNT (links), die sich binnen dreier Monate zu einer vollständigen „klinischen Komplettremission“ entwickelt hat (rechts)
In vorangegangenen Studien konnte gezeigt werden, dass sich bei einem relevanten Anteil der Patient:innen diese Residuen nach drei weiteren Monaten der Nachuntersuchung zu einer vollständigen klinischen Komplettremission zurückbilden können. Patient:innen, die weder die Kriterien einer klinischen Komplettremission noch die einer nahen klinischen Komplettremission erfüllen, sollten wie gehabt der Tumorchirurgie zugeführt werden.
Der Stellenwert einer diagnostischen Biopsie ist limitiert. Im Falle einer negativen Biopsie steht die Frage des „sampling error“ im Raum und bei einer positiven Biopsie kann nicht ausgeschlossen werden, dass noch eine weitere Regression histologisch folgt.
Therapiekonzepte mit dem Ziel des Organerhalts
Totale neoadjuvante Therapie
Lange Zeit bestand die gängige Sequenz in der Therapie des lokal fortgeschrittenen Rektumkarzinoms aus einer Radiochemotherapie, gefolgt von der Resektion und der adjuvanten Chemotherapie. Die adjuvante Chemotherapie war jedoch in allen größeren Studien mit einer nur limitierten Compliance assoziiert und ihr Nutzen konnte nicht belegt werden.6 Das Paradigma der totalen neoadjuvanten Therapie („TNT“) sah daher vor, dass diese Chemotherapie nicht mehr postoperativ, sondern z.B. zwischen einer Strahlentherapie und der Operation erfolgt.7,8
Die Rationale hierfür besteht in einer erwartbaren besseren Compliance, da die Patient:innen zu diesem Zeitpunkt noch keinen operativen Eingriff hinter sich hatten. Darüber hinaus können Mikrometastasen potenziell früher und effektiver behandelt werden und am Primärtumor kann eine deutlichere Tumorregression erzielt werden.
Zwei prospektive Phase-III-Studien konnten diese Hypothesen belegen und etablierten die TNT für Patient:innen mit einem hohen Risiko für ein Rezidiv als neuen Standard. Beide Studien rekrutierten, als die „Watch&wait“-Strategie noch nicht etabliert war, sodass fast alle Patient:innen in den Studien operativ reseziert wurden. Hierdurch konnte jedoch auch die lokale Wirksamkeit am Primärtumor belegt werden.
Die Rate an pathologisch kompletten Remissionen lag bei beiden Studien mit fast 28% weit über dem, was zuvor erreicht werden konnte. Die TNT wurde damit auch eine interessante Option für Patient:innen, die eine klinische Komplettremission mit nachfolgendem Verzicht auf die Operation anstreben.
In der Folge konnte die kürzlich publizierte OPRA-Studie zeigen, dass nach der Sequenz aus Radiochemotherapie gefolgt von vier Monaten FOLFOX (Folinsäure, Fluorouracil und Oxaliplatin) mehr als die Hälfte der Patient:innen ohne totale mesorektale Exzision im Verlauf lokal saniert bleibt.9
Ein ähnliches Ergebnis konnte die von der Universitätsklinik Tübingen durchgeführte multizentrische CAO/ARO/AIO-16-Studie zeigen: Hier erzielten nach einer totalen neoadjuvanten Therapie 40% der Patient:innen eine klinische Komplettremission. In dieser Studie steht das Follow-up aktuell noch aus.10
Immuntherapie
Für großes Aufsehen sorgte im letzten Jahr eine kleine prospektive Studie mit zwölf Patient:innen mit Rektumkarzinomen im Stadium II oder III und einer nachgewiesenen Mikrosatelliteninstabilität.11
Es war bereits von anderen Tumorentitäten bekannt, dass solche Tumoren mit einer hohen genetischen Instabilität sehr gut auf eine Immuntherapie ansprechen.12 Daher war das Ziel der Studie zunächst, mit einer Immuntherapie, in diesem Fall mit Dostarlimab, ein Ansprechen zu erreichen. Eine Radiochemotherapie war vorgesehen, wenn nach der Immuntherapie noch keine klinische Komplettremission erreicht worden war, und eine Operation wiederum nach der Radiochemotherapie, wenn weiterhin ein Residuum bestand.
Tatsächlich erreichten alle Patient:innen bereits nach Abschluss der Immuntherapie die klinische Komplettremission, von den Patient:innen wurde bisher niemand operiert oder bestrahlt. Auch wenn die Nachbeobachtungszeit noch sehr kurz ist, sind die Daten trotz der geringen Größe der Kohorten in sich so konsistent, dass die Immuntherapie durchaus als individuell zu diskutierende Therapieoption bei dieser kleinen Subgruppe der Patient:innen mit Rektumkarzinomen infrage kommt.
Dosiseskalierte Strahlentherapie
Während sich die TNT bei den lokal fortgeschrittenen Stadien auch durch die Senkung des Fernmetastasierungsrisiko als Therapie der Wahl für organerhaltende Therapiekonzepte herauskristallisiert hat, ist bei den frühen Stadien eine lokale Intensivierung der Therapie sinnvoll. So können bei geringem Fernmetastasierungsrisiko die Nebenwirkungen der systemtherapeutischen Komponente minimiert werden.
Allerdings hatte sich in der Vergangenheit die Applikation hoher Strahlendosen im Bereich des kleinen Beckens als schwierig herausgestellt.13 Hauptproblem war hierbei die große Lagevariabilität der Tumoren und der gesunden Organe, die mit den „konventionellen“ Bestrahlungsgeräten eine sichere Erfassung des Tumorvolumens erschwerte. Daher mussten entweder sehr große Volumina bestrahlt und somit auch gesunde Gewebe wie Blase und nicht befallene Rektumschleimhaut mit hohen Dosen belastet werden, oder die applizierte Dosis musste abgesenkt werden.
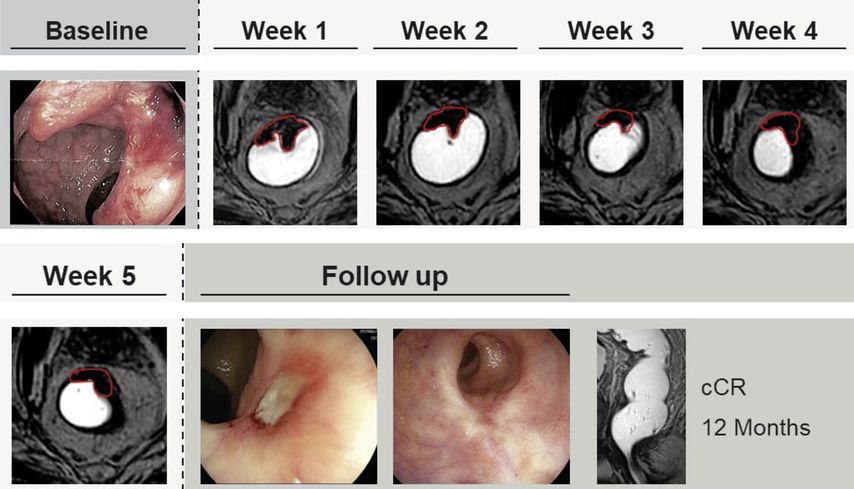
Dies änderte sich durch die Einführung der online MR-geführten, adaptiven Strahlentherapie vor einigen Jahren. Durch diese Technologie können insbesondere bei frühen Tumoren sehr hohe Strahlendosen mit einer Präzision im Millimeterbereich appliziert werden. Erste Fallserien zeigten sehr vielversprechende Signale mit Komplettremissionsraten im hohen zweistelligen Prozentbereich.14,15Ein exemplarischer Patientenkasus ist in Abbildung 2 dargestellt. Auch für die Brachytherapie konnten zuletzt in prospektiven Studien solche Ansprechraten gezeigt werden.16
Abb. 2: Beispiel eines Patienten, der nach einer dosiseskalierten Radiatio eines cT3-cN0-Tumors im distalen Rektum eine klinische Komplettremission (cCR) erreichte. Die wöchentlichen MRT-Aufnahmen unter Therapie zeigen das dosiseskalierte Volumen. Im Follow-up in der Endoskopie lassen sich dann zunächst eine „nahe klinische Komplettremission“ und anschließend eine vollständige Regression erkennen. Modifiziert nach Böke S et al.15
Nachsorgestrategie
Elementarer Teil der Beratung der Patient:innen, wenn nach klinischer Komplettremission keine Tumoroperation erfolgt, ist die Notwendigkeit einer engmaschigen Verlaufskontrolle mittels MRT und Endoskopie. Das Risiko für „local regrowth“ liegt bei den lokal fortgeschrittenen Stadien bei ca. 25–30%, die meisten Ereignisse treten in den ersten zwei Jahren auf.17
Dementsprechend wird in den ersten zwei Monaten eine Verlaufskontrolle mittels MRT und nachfolgend mit Rektoskopie alle 3–4 Monate empfohlen, ab dem dritten Jahr kann das Intervall dann gestreckt werden. Im vierten und fünften Jahr sind sechsmonatliche Kontrollen sicherlich ausreichend. Ziel dieser Verlaufskontrollen ist es, ein „local regrowth“ möglichst frühzeitig zu erkennen und im Idealfall durch ein weiteres lokales Verfahren behandeln zu können.
Wichtig ist auch die prospektive Erfassung der Organfunktion und der Lebensqualität. Während zunehmend Erfahrungswerte für die Wahrscheinlichkeit des Erreichens eines Organerhalts vorliegen, ist die Organfunktion hierunter noch nicht ausreichend untersucht. Die ersten zur Verfügung stehenden Daten zeigen jedoch eine deutlich bessere Organfunktion bei Patient:innen, die organerhaltend behandelt werden.2,18,19
Zusammenfassung: optimale Ergebnisse durch interdisziplinäre Zusammenarbeit
Organerhaltende Strategien erfordern eine enge Zusammenarbeit aller beteiligten Fachdisziplinen: beginnend bei der Diagnostik über die Therapie bis hin zur Beurteilung des Ansprechens und der Nachsorge.
Erfreulicherweise stehen inzwischen verschiedene Möglichkeiten zur Verfügung, Patient:innen mit einem Rektumkarzinom den Organerhalt anstrebenden Therapiemaßnahmen zuzuführen. Die Entscheidung, welche dieser Optionen schlussendlich zum Einsatz kommt, erfolgt nach interdisziplinärer Beratung unter Berücksichtigung der Präferenz der Patient:innen.
Literatur:
1 Sauer R et al.: Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol 2012; 30(16): 1926-33 2 Rooney MK et al.: Patient-reported bowel function and bowel-related quality of life after pelvic radiation for rectal adenocarcinoma: the impact of radiation fractionation and surgical resection. Clin Colorectal Cancer 2023; 22(2): 211-21 3 Fokas E et al.: International consensus recommendations on key outcome measures for organ preservation after (chemo)radiotherapy in patients with rectal cancer. Nat Rev Clin Oncol 2021; 18(12): 805-16 4 Heijnen LA et al.: Nodal staging in rectal cancer: why is restaging after chemoradiation more accurate than primary nodal staging? Int J Colorectal Dis 2016; 31(6): 1157-62 5 Custers PA et al.: Defining near-complete response following (chemo)radiotherapy for rectal cancer: systematic review. Br J Surg 2022; 110(1): 43-9 6 Glynne-Jones R et al.: Chronicle: results of a randomised phase III trial in locally advanced rectal cancer after neoadjuvant chemoradiation randomising postoperative adjuvant capecitabine plus oxaliplatin (XELOX) versus control. Ann Oncol 2014; 25(7): 1356-62 7 Bahadoer RR et al.: Short-course radiotherapy followed by chemotherapy before total mesorectal excision (TME) versus preoperative chemoradiotherapy, TME, and optional adjuvant chemotherapy in locally advanced rectal cancer (RAPIDO): a randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22(1): 29-42 8 Conroy T et al.: Neoadjuvant chemotherapy with FOLFIRINOX and preoperative chemoradiotherapy for patients with locally advanced rectal cancer (UNICANCER-PRODIGE 23): a multicentre, randomised, open-label, phase 3 trial. Lancet Oncol 2021; 22(5): 702-15 9 Smith JJ et al.: Organ preservation in rectal adenocarcinoma: a phase II randomized controlled trial evaluating 3-year disease-free survival in patients with locally advanced rectal cancer treated with chemoradiation plus induction or consolidation chemotherapy, and total mesorectal excision or nonoperative management. BMC Cancer 2015; 15: 767 10 Gani C et al.: OC-0833 Total neoadjuvant therapy for organ preservation in rectal cancer: The CAO/ARO/AIO-16 phase II trial. Radiother Oncol 2022; 170: S751 11 Cercek A et al.: PD-1 blockade in mismatch repair-deficient, locally advanced rectal cancer. N Engl J Med 2022; 386(25): 2363-76 12 He Y et al.: The role of DNA mismatch repair in immunotherapy of human cancer. Int J Biol Sci 2022; 18(7): 2821-32 13 Couwenberg AM et al.: Efficacy of dose-escalated chemoradiation on complete tumor response in patients with locally advanced rectal cancer (RECTAL-BOOST): a phase 2 randomized controlled trial. Int J Radiat Oncol Biol Phys 2020; 108(4): 1008-18 14 Gani C et al.: A novel approach for radiotherapy dose escalation in rectal cancer using online MR-guidance and rectal ultrasound gel filling – rationale and first in human. Radiother Oncol 2021; 164: 37-42 15 Boeke S et al.: Online MR guided dose escalated radiotherapy for organ preservation in distal rectal cancer. Clin Transl Radiat Oncol 2022; 37: 153-6 16 Gerard JP et al.: Neoadjuvant chemoradiotherapy with radiation dose escalation with contact x-ray brachytherapy boost or external beam radiotherapy boost for organ preservation in early cT2-cT3 rectal adenocarcinoma (OPERA): a phase 3, randomised controlled trial. Lancet Gastroenterol Hepatol 2023; 8(4): 356-67 17 Van der Valk MJM et al.: Long-term outcomes of clinical complete responders after neoadjuvant treatment for rectal cancer in the International Watch & Wait Database (IWWD): an international multicentre registry study. Lancet 2018; 391(10139): 2537-45 18 Maas M et al.: Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer. J Clin Oncol 2011; 29(35): 4633-40 19 Custers PA et al.: Long-term quality of life and functional outcome of patients with rectal cancer following a watch-and-wait approach. JAMA Surg 2023; 158(5): e230146
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...