Operative Therapie des primären Ovarialkarzinoms
Autorinnen:
Dr. Charlotte von Bülow1
Priv.-Doz. Dr. Katharina Prieske2
Dr. Anna Jaeger1
Prof. Dr. Barbara Schmalfeldt1
1Klinik und Poliklinik für Gynäkologie
Universitätsklinikum Hamburg-Eppendorf
2Dysplasiezentrum Hamburg
am Krankenhaus Jerusalem
Korrespondenz:
E-Mail: c.buelow@uke.de
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Ovarialkarzinom ist noch immer die führende gynäkologische Todesursache. In den letzten Jahren konnte jedoch eine kontinuierliche Verbesserung der Behandlungsqualität verzeichnet werden. Welche intra- und perioperativen Maßnahmen hierbei eine übergeordnete Rolle spielen, wird imfolgenden Artikel dargestellt.
Keypoints
-
Die Qualität der Primäroperation ist ein wichtiger und beeinflussbarer Prognosefaktor in der Therapie des frühen und fortgeschrittenen Ovarialkarzinoms.
-
Bei Vorliegen eines fortgeschrittenen Krankheitsstadiums (FIGO IIB–IV) ist die makroskopische Tumorfreiheit anzustreben, da diese mit einem signifikant längeren Überleben einhergeht.
-
Beim frühen Ovarialkarzinom steht das akkurate Staging im Vordergrund. Auf Basis des Tumorstadiums wird die weitere operative und systemische Therapie festgelegt.
Das epitheliale Ovarialkarzinom ist trotz seiner relativen Seltenheit die zweithäufigste maligne Erkrankung der weiblichen Genitalorgane und die führende gynäkologische Todesursache in Deutschland. Etwa eine von 75 Frauen erkrankt im Laufe ihres Lebens am Ovarialkarzinom. Wegen fehlender Frühsymptome wird die Erkrankung häufig erst im fortgeschrittenen Stadium diagnostiziert, womit in der Regel eine schlechte Gesamtprognose einhergeht.
Die Behandlungsqualität des Ovarialkarzinoms konnte in Deutschland über die letzten 15 Jahre erfreulicherweise kontinuierlich erhöht werden. 2016 zeigt sich für die FIGO-Stadien III/IV ein medianes progressionsfreies Überleben (PFS) von 20,7 Monaten vs. 12,7 Monate im Jahr 2004.1 Ein entscheidender Faktor für die Verlängerung von PFS und Gesamtüberleben (OS) ist die optimale Tumorreduktion in der Primäroperation. Neben der operativen Radikalität ist das interdisziplinäre prä-/peri- und postoperative Management der Patientinnen ein weiterer Baustein für eine erfolgreiche und komplikationsarme Behandlung.
Präoperative Diagnostik
Die transvaginale Sonografie des kleinen Beckens ist das apparative Mittel der Wahl zur Einschätzung von Größe und Morphologie des Adnexbefundes und nimmt in der Diagnostik den höchsten Stellenwert ein. Ergänzend ist präoperativ eine Bildgebung per Computertomografie (CT) oder Magnetresonanztomografie (MRT) des Thorax und Abdomens zur Einschätzung der Tumorausbreitung von Nutzen. Die Bestimmung des Tumormarkers CA 125 sollte als individueller Parameter zur Therapieverlaufskontrolle dienen.
Operative Therapie des fortgeschrittenen Ovarialkarzinoms
Das Ziel der Primäroperation ist die vollständige Entfernung aller makroskopisch sichtbaren Tumormanifestationen. Analysen der Arbeitsgemeinschaft für gynäkologische Onkologie (AGO) zeigen, dass Patientinnen mit vollständiger Tumorresektion im Median >5 Jahre länger leben als Patientinnen mit einem Tumorrest. Doch auch wenn keine makroskopische Tumorfreiheit erzielt werden kann, profitieren Patientinnen von der maximal möglichen Tumorreduktion: Ein Tumorrest von 1–10mm geht gegenüber einem postoperativen Tumorrest von >1cm mit einem Überlebensvorteil von knapp sieben Monaten einher.2
Intraoperatives Vorgehen
Die mediane Längslaparotomie ermöglicht eine vollständige Begutachtung der intraabdominalen Tumorausbreitung zur Beurteilung der Operabilität. Hierfür bedarf es großer Erfahrung des jeweiligen gynäkologisch onkologischen Operateurs. Sollte der postoperative Tumorrest auf >1cm eingeschätzt werden, ist von der absoluten Radikalität des Eingriffs abzusehen und die weiteren operativen Schritte sollten entsprechend angepasst werden.
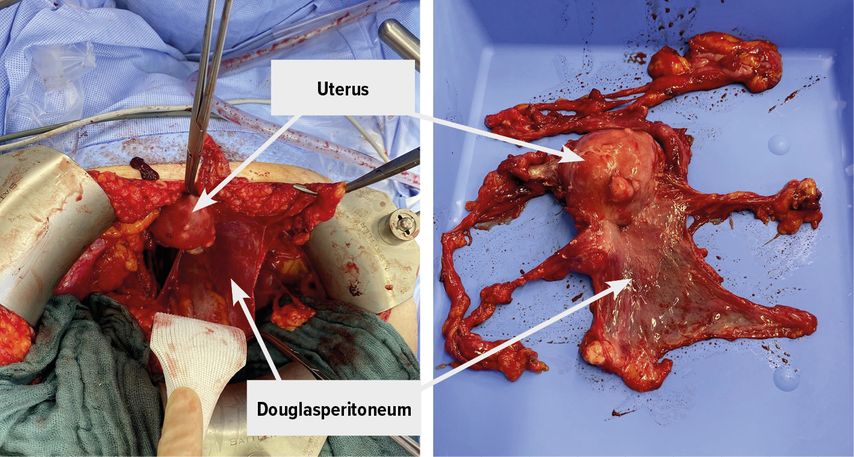
Die sorgfältige Exploration der gesamten Bauchhöhle umfasst die Inspektion und Palpation der Zwerchfellkuppeln, von Leber, Bursa omentalis, parakolischer Rinne, Dick- und Dünndarm, Omentum majus und minus und des retroperitonealen und paraaortalen Lymphabflussgebietes. Außerdem wird die Aspiration einer Peritonealzytologie bzw. Aszites zur zytologischen Untersuchung vorgenommen. Alle sichtbaren peritonealen Tumorabsiedlungen werden reseziert, bei ausgedehnter peritonealer Metastasierung kann dies die (sub)totale Exzision des Peritoneum parietale einschließlich des Zwerchfellperitoneums umfassen (Abb. 1).
Abb. 1: Präparation des Douglasperitoneums und entsprechendes Präparat: Uterus und Douglasperitoneum mit Peritonealkarzinose
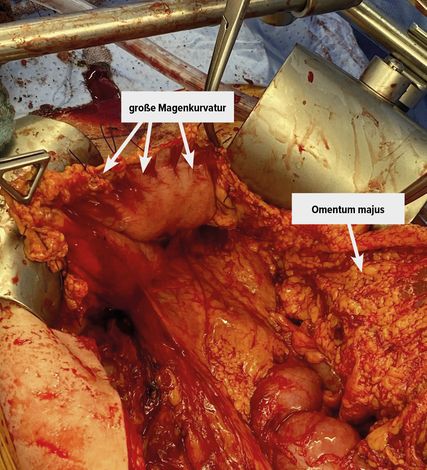
Abb. 2: Präparation des Omentum majus: Das Netz ist bereits von der großen Magenkurvatur abgesetzt. Anschließend erfolgt die Milz-nahe Präparation
Wesentlicher OP-Schritt neben der Hysterektomie mit beidseitiger Adnektomie ist die infragastrische Omentektomie bis zum unteren Milzpol unter Schonung der Gefäßarkaden der großen Magenkurvatur (Abb. 2). Durch Abpräparation des Omentums vom Colon transversum kommt es zur Eröffnung der Bursa omentalis, wodurch die Exploration von Pankreas, Lig. hepatoduodenale und des retroperitonealen Raumes um den Truncus coeliacus ermöglicht wird.
Beim fortgeschrittenen Ovarialkarzinom kann das Omentum durch eine tumoröse Umwandlung als „omental cake“ imponieren, in diesem Fall ist die Omentektomie frühzeitig durchzuführen, auch um einen möglicherweise inoperablen Tumorbefall im Oberbauch besser einschätzen zu können. Bei Vorliegen eines Konglomerattumors aus Uterus, Adnexen und Kolon sollte eine En-Bloc-Resektion unter Mitnahme des befallenen Kolonsegments erfolgen.
Grenzen der Operabilität sind bei großflächiger Beteiligung der Dünndarmserosa und des Dünndarmmesenteriums am Übergang zur Serosa, bei Befall der Mesenterialwurzel oder des Truncus coeliacus und bei diffuser Infiltration des Magens oder Pankreas gegeben. Die Indikation für eine Darmresektion zur Vorbeugung einer Obstruktion bei drohenden Darmstenosen besteht unabhängig vom zytoreduktiven OP-Ergebnis.3
Lymphonodektomie beim fortgeschrittenen Ovarialkarzinom
Eine lymphatische Metastasierung liegt in 44–55% über alle FIGO-Stadien hinweg vor.4,5 Der Stellenwert der systematischen Lymphonodektomie (LNE) beim fortgeschrittenen Ovarialkarzinom wurde in der AGO-Studie „Lymphadenectomy in Ovarian Neoplasms“ (LION) untersucht. Die Ergebnisse zeigen sowohl im Gesamtüberleben (65,5 Monate mit LNE vs. 67,2 Monate ohne LNE) als auch im progressionsfreien Intervall keinen signifikanten Unterschied zwischen einer systematischen LNE und einem Verzicht hierauf.
Darüber hinaus war die LNE vor allem mit einer erhöhten Morbidität verbunden.6 Entsprechend soll auf eine systematische LNE ab Stadium FIGO IIB verzichtet werden, sofern die Lymphknoten palpatorisch und makroskopisch unauffällig sind. Bei vergrößerten und tumorsuspekten Lymphknoten ist die gezielte Resektion dieser Lymphknoten vorgesehen.
Operative Therapie des frühen Ovarialkarzinoms
Auch in den frühen Krankheitsstadien FIGO IA–IIA, bei denen die Erkrankung auf Ovar und Uterus begrenzt bleibt, ist die operative Therapie zum Zweck des Stagings prognostisch relevant. Wenn eine frühe Diagnose und Behandlung erfolgen, sind die relativen Überlebensraten mit 89% im Stadium FIGO I und 77% im Stadium FIGO II gut.7
Obligate operative Schritte beim frühen Ovarialkarzinom sind die Längsschnittlaparotomie zur Inspektion und Palpation der gesamten Abdominalhöhle, die Entnahme einer Peritonealzytologie sowie von Peritonealbiopsien aus unauffälligen Regionen und aus allen auffälligen Lokalisationen. Nach Hysterektomie und Adnektomie erfolgt die infragastrische Omentektomie und die Appendektomie bei auffälliger Appendix. Bei der Adnektomie ist auf das hohe Absetzen des ovariellen Gefäßbündels zu achten, da die lymphogene Dissemination entlang der ovariellen Gefäßbündel in die paraaortalen Lymphknotenstationen erfolgt.
Eine systematische LNE ist beim frühen Ovarialkarzinom weiterhin obligat durchzuführen. Die lymphogene Dissemination kann frühzeitig stattfinden, daher wird im Stadium FIGO IA–IIA die Lymphknotenentnahme primär aufgrund der diagnostischen Gültigkeit empfohlen: Nur durch die systematische LNE mit histologischer Untersuchung kann der Nodalstatus korrekt bestimmt und das Tumorstadium entsprechend definiert werden.3 Dadurch werden bei bis zu 20–25% der vermeintlich frühen Ovarialkarzinome okkulte Lymphknotenmetastasen nachgewiesen.
Bei positivem Nodalstatus erfolgt ein „Upstaging“ in das fortgeschrittene FIGO-Stadium III mit weitreichender Konsequenz für die nachfolgende Systemtherapie.8 Entsprechend geht ein komplettes operatives Staging auch mit einem signifikant längeren progressionsfreien und Gesamtüberleben einher.9
Enhanced Recovery After Surgery
Ein weiterer Ansatzpunkt zur Optimierung des (peri)operativen Outcomes stellt das ERAS(„Enhanced Recovery After Surgery“)-Programm dar.10 Mit dem Ziel einer verbesserten postoperativen Rehabilitation wurde ein multimodaler Ansatz konzipiert, welcher perioperative Stressfaktoren und eine katabole Stoffwechsellage minimiert. Wichtige Bestandteile hierfür sind ein präoperatives Kohlenhydrateladen, ein striktes Volumenmanagement intraoperativ, ein postoperativ früher Kostaufbau zur Aufrechterhaltung der normalen gastrointestinalen Funktion sowie eine rasche Mobilisation und multimodale Analgesie.11
Internationale Studien zum ERAS-Protokoll konnten konsistente Erfolge darlegen: eine um einen Tag schnellere Erholung der Darmtätigkeit (p<0,001), eine suffiziente Analgesie unter reduzierter Opioiddosis sowie ein um ca. drei Tage (p<0,001) verkürzter Krankenhausaufenthalt bei guter Zufriedenheit seitens der Patientinnen. Die Rate der postoperativen Komplikationen sowie die der Rehospitalisierung blieben unverändert.12,13
Literatur:
1 Harter P et al.: Frauenarzt 2020; 3: 182-288 2 Du Bois et al.: Cancer 2009; 115(6): 1234-44 3 Siewert J et al.: Praxis der Viszeralchirurgie: onkologische Chirurgie. 3. Auflage. Heidelberg: Springer, 2010. 4 Harter P et al.: Int J Gynecol Cancer 2007; 17(6): 1238-44 5 Morice P et al.: J Am Coll of Surg 2003; 197(2): 198-205 6 Harter P et al.: J Clin Oncol 2017; 35(suppl 15): 5500 7 Robert Koch-Institut und Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (Hrsg.): Krebs in Deutschland 2015/ 2016. Häufigkeiten und Trends. 12. Auflage. 2019 8 Trimbos B et al.: JNatl Cancer Inst 2010; 102(13): 982-7 9 Trimbos B et al.: Journal of the National Cancer Institute 2010; 102(13): 982-7 10 Modesitt SC et al.: Obstet Gynecol 2016; 128(3): 457-66 11 Nelson G et al.: Gynecol Oncol 2016; 140(2): 323-32 12 Kalogera E et al.: Obstet Gynecol 2013; 122(2.1): 319-28 13 Nelson G et al.: Gynecol Oncol 2014; 135(3): 586-94
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...