Onkologische Forschung: ein Überblick
Bericht:
Dr. Andreas Billich
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Beim diesjährigen OeGHO-Kongress fasste Prim. Dr. Georg Pall (Schwarzach) neue Entwicklungen in der Therapie von Tumorerkrankungen zusammen, die in den vergangenen Monaten publiziert oder auf Kongressen präsentiert wurden.
Zielgerichtete Therapie mit niedermolekularen Wirkstoffen
Das fortgeschrittene nichtkleinzellige Bronchialkarzinom (aNSCLC) stand im Mittelpunkt des Vortrags von Prim. Dr. Georg Pall. Da beim aNSCLC eine Vielzahl genetischer Treiber bekannt ist, stellt das aNSCLC-Adenokarzinom eine prototypische Erkrankung für die Anwendung von zielgerichteten Therapien dar.
EGFR-Mutation
Im Falle von EGFR-mutierten Tumoren ist in der metastasierten Situation der Tyrosinkinasehemmer (TKI) Osimertinib der Standard in der Erstlinientherapie; eine wirksame und gut verträgliche Therapie mit allerdings begrenzter Wirkdauer.
Die Studie FLAURA2 zeigte nun, dass die Kombination von Osimertinib mit einer Platindoublette schon in der Erstlinie gegenüber dem TKI allein einen relevanten Vorteil hinsichtlich des progressionsfreien Überlebens (PFS) bietet (HR: 0,62; Verlängerung des medianen PFS [mPFS] von 16,7 auf 25,0 Monate).1 Der Vorteil war vor allem bei Patient:innen mit initialen ZNS-Metastasen ausgeprägt (HR: 0,47). Ob die Verlagerung der Kombination mit einer Chemotherapie (CTx) aus der Zweit- in die Erstlinie das Gesamtüberleben (OS) der Patient:innen verlängert, bleibt noch zu beobachten.
Einen alternativen Ansatz verfolgte die MARIPOSA-Studie, die die Kombination des EGFR-TKI Lazertinib mit einem bispezifischen Anti-EGFR/MET-Antikörper (Amivantamab) beim aNSCLC in der Erstlinie untersuchte.2 Die Kombination bot ebenfalls einen relevanten PFS-Vorteil gegenüber Osimertinib allein (HR: 0,70; mPFS: 23,7 vs. 16,6 Monate), bei derzeit noch unklarem OS-Vorteil. Erkennbar ist hier jedoch, wie auch mit der CTx-Kombination, ein gravierender Nachteil, wie Pall hervorhob: Die Kombinationen weisen deutlich mehr Nebenwirkungen auf als die sehr gut verträglichen TKI alleine. Unerwartet war die Zunahme thromboembolischer Ereignisse mit Amivantamab+Lazertinib.
Die MARIPOSA2-Studie verfolgte die Strategie, Kombinationen beim EGFR-mutierten aNSCLC erst in der Zweitlinie nach Osimertinib-Versagen einzusetzen.3 Hier war der PFS-Vorteil von Amivantamab+CTx gegenüber einer CTx allein durchaus beeindruckend, wie Pall befand (HR: 0,48). Die Triple-Therapie Amivantamab+Lazertinib+CTx bot gegenüber der dualen Therapie angesichts höherer Nebenwirkungsraten keinen weiteren Vorteil.
EGFR-Exon-20-Insertion
NSCLC-Tumoren mit den seltenen EGFR-Exon-20-Insertionen sprechen schlecht auf eine TKI-Therapie an. Bislang konnte nach CTx in der Erstlinie Amivantamab als Monotherapie gegeben werden. Jetzt gibt es aus der PAPILLON-Studie Ergebnisse, die gemäß Pall die Praxis ändern: Amivantamab+CTx in der Erstlinie war der CTx allein hinsichtlich PFS klar überlegen (HR: 0,40).4 In Zukunft sollten daher bereits vor der Erstlinientherapie mittels NGS etwaige Exon-20-Insertionen identifiziert werden, um die beste Therapie wählen zu können.
ROS1-Translokation
Bei aNSCLC mit der seltenen ROS1-Translokation stehen mit Crizotinib und Entrectinib schon zwei TKI für die Erstlinie zur Verfügung. Neu ist Repotrectinib, das in einer einarmigen Studie bei ROS1-TKI-naiven Patient:innen eine hohe Ansprechrate (79%) und ein langes mPFS (35,7 Monate) zeigte.5 Das PFS ist in dieser Studie im historischen Vergleich gegenüber den bisherigen TKI-Optionen in etwa verdoppelt, wie Pall erläuterte.
KRAS-G12C-Mutation
Bei aNSCLC mit KRAS-G12C-Mutation ist bereits der Inhibitor Sotorasib in der Zweitlinie zugelassen. Sotorasib war in einer Studie etwas besser als der Standard Docetaxel;6 doch war der Benefit nicht so überzeugend wie gehofft, wie Pall kommentierte. Neu ist der KRAS-G12C-Inhibitor Divarasib mit ersten Daten unter anderem beim aNSCLC und auch beim Kolorektalkarzinom.7
Gliome & RCC
Abseits vom NSCLC präsentierte Pall ein Highlight aus der Therapie der Gliome. In der INDIGO-Studie zeigte der Isocitrat-Dehydrogenase(IDH)-Hemmer Vorasidenib bei Patient:innen mit IDH-mutierten Tumoren, die keine sofortige intensive Therapie benötigten, gegenüber Placebo einen signifikanten mPFS-Vorteil (27,7 vs. 11,1 Monate; HR: 0,39) und schob die Notwendigkeit einer Folgetherapie für die meisten Patient:innen weit hinaus, und dies bei moderater Toxizität.8
Beim klarzelligen Nierenzellkarzinom (ccRCC) wurden rezent erstmals Phase-II-Daten zu einem neuen Therapiekonzept vorgestellt. Der HIF2α-Inhibitor Belzutifan zeigte sich bei bereits stark vorbehandelten ccRCC-Patient:innen gegenüber Everolimus bezüglich PFS in klarem Vorteil.9
Antikörper-Wirkstoff-Konjugate
Urothelkarzinom
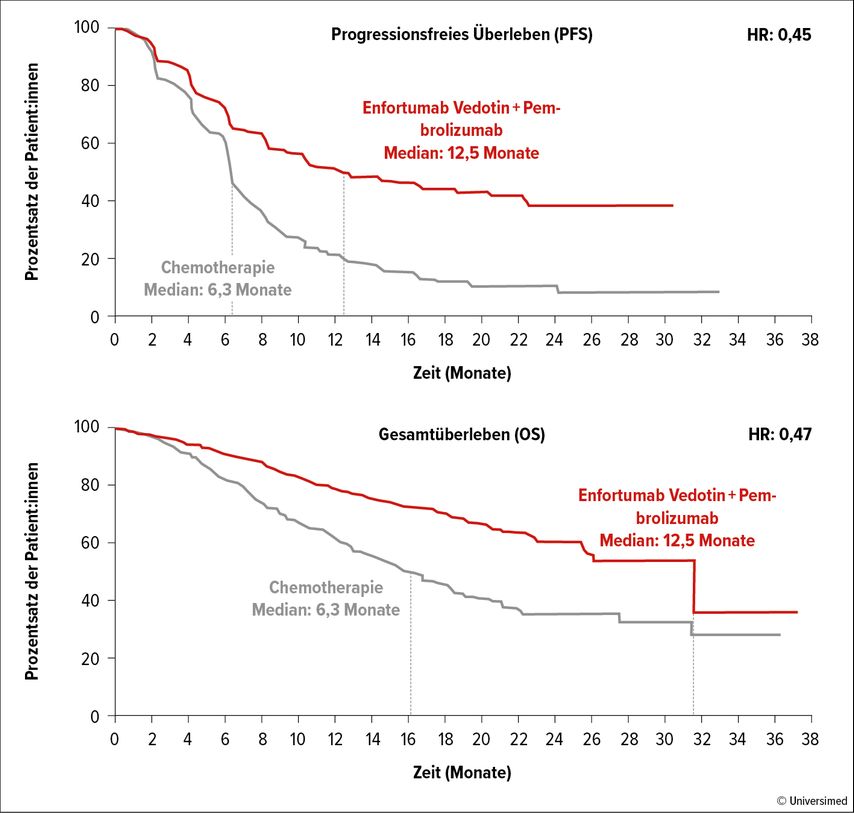
Ein besonderes Highlight stellt laut Pall das Ergebnis der KEYNOTE-A39-Studie mit Enfortumab Vedotin (EV)+Pembrolizumab beim fortgeschrittenen oder metastasierten Blasenkarzinom in der Erstlinie dar.10 EV ist ein Antikörper-Wirkstoff-Konjugat (ADC), das gegen das Protein Nectin-4 gerichtet ist, das auf der Mehrzahl der Urothelkarzinome exprimiert wird.
In der Studie zeigte sich ein dramatischer Vorteil der Kombination hinsichtlich mPFS im Vergleich zu einer CTx (12,5 vs. 6,3 Monate; HR: 0,45), was sich bereits in einen OS-Benefit übersetzte (HR: 0,47; Abb. 1). Auch diese Therapie geht mit gewissen Nebenwirkungen einher (Polyneuropathie, Hauttoxizität, Hyperglykämie), die aber gegen CTx-assoziierte Toxizitäten abzuwägen sind. Die Empfehlung für EV+Pembrolizumab in der Erstlinie hat bereits Eingang in die ESMO-Guidelines gefunden.11
Abb. 1: Progressionsfreies Überleben (PFS) und Gesamtüberleben (OS) in der Studie KEYNOTE-A39 mit Enfortumab Vedotin (EV)+Pembrolizumab beim fortgeschrittenen oder metastasierten Blasenkarzinom (modifiziert nach Powles T et al.)10
Ovarialkarzinom
Das platinresistente Ovarialkarzinom stellt eine schwierige Behandlungssituation mit wenigen Therapieoptionen dar. Die Phase-III-Studie MIRASOL verglich das ADC Mirvetuximab Soravtansin (MV) mit einer CTx.12 Die ADC-Therapie zeigte Vorteile beim PFS (HR: 0,65) und Gesamtansprechen (ORR: 42 vs. 16%), die sich auch in ein längeres OS übersetzten (HR: 0,67).
Anzumerken ist hier, dass es sich um selektierte Patient:innen handelte, deren Tumoren mit einer begleitenden Diagnostik positiv für das Target von MV (Folat-Rezeptor α) getestet waren; weiters ist die unter MV auftretende Augentoxizität zu beachten, der in der Studie schon prophylaktisch begegnet wurde.
Mammakarzinom
Das HER2-gerichtete ADC Trastuzumab Deruxtecan ist schon in verschiedenen Situationen in der Therapie des Mammakarzinoms zugelassen. Eine neue Substanz ist das gegen Trop2 gerichtete Datopotamab Deruxtecan, das in einer ersten Phase-III-Studie bei fortgeschrittenem HER2-negativem, HR-positivem Mammakarzinom in später Therapielinie einen PFS-Vorteil gegenüber CTx bot (HR: 0,63).13
NSCLC
Datopotamab Deruxtecan wurde auch beim aNSCLC in später Therapielinie untersucht.14 Im Vergleich zu Docetaxel zeigte sich in einer randomisierten Phase-III-Studie ein moderater PFS-Vorteil des ADC (HR: 0,75), getrieben von guter Wirksamkeit bei Patient:innen mit nichtsquamösen Tumoren (HR: 0,63), wohingegen jene mit Plattenepithelkarzinomen keinen Benefit hatten.
Immuntherapie
Kolorektalkarzinom (CRC)
Beim Mikrosatelliten-instabilen (MSIhigh) metastasierten CRC hat sich die Immuntherapie (ITx) mit Pembrolizumab als Monotherapie in der Erstlinie etabliert, obgleich ein signifikanter OS-Vorteil nicht gezeigt werden konnte.15 Mit Spannung erwartet wurde das Ergebnis der Studie CheckMate 8HW, die im gleichen Setting die Wirksamkeit einer dualen ITx mit Nivolumab (Anti-PD-1) und Ipilimumab (Anti-CTLA4) mit einer Standard-CTx verglich.16 Nach ersten Daten zeigte die kombinierte ITx einen, wie Pall befand, beeindruckenden Vorteil beim mPFS (nicht erreicht vs. 5,1 Monate; HR: 0,21), der in allen Subgruppen auftrat. OS-Daten liegen derzeit noch nicht vor.
Magenkarzinom (GC)
Bei der nicht allzu großen Gruppe des HER2-positiven GC ist CTx+Anti-HER2-Antikörper (Trastuzumab) schon seit einiger Zeit der Standard in der Erstlinie. Diesem Regime wurde in der Studie KEYNOTE-811 eine ITx mit Pembrolizumab zugefügt.17 Eine Interimsanalyse zeigte, dass die ITx das mPFS gegenüber Placebo velängerte (10,0 vs. 8,1 Monate; HR: 0,73), wobei der Vorteil bei Tumoren mit einem PD-L1-Score ≥1 etwas deutlicher ausfiel (HR: 0,71). Patient:innen mit PD-L1-negativen Tumoren profitierten nicht von der Zugabe von Pembrolizumab.
Urothelkarzinom
Beim fortgeschrittenen oder metastasierten Blasenkarzinom in der Erstlinie wurde die Kombination aus ITx (Nivolumab)+CTx (Gemcitabin+Cisplatin) mit der CTx alleine in der Studie CheckMate 901 verglichen.18 Beim OS ergab sich ein signifikanter Vorteil für die Kombination (HR: 0,78). Pall kommentierte, dass der Benefit durch die oben erwähnte Kombination von Enfortumab Vedotin mit Pembrolizumab aber deutlich höher lag, so dass Nivolumab+CTx wohl nur in Fällen zum Einsatz kommen wird, in denen die Kombination ADC+ITx, aus welchen Gründen auch immer, nicht verabreicht werden kann.
Therapie früher Stadien
Die Erkenntnisse aus Studien zu neuen Therapien zur Behandlung fortgeschrittener/metastasierter Stadien von Tumorerkrankungen sollten, wie Pall ausführte, auch in frühe Stadien übertragen werden, in denen die Therapien möglicherweise einen noch größeren Erfolg haben könnten. Dies wurde vor allem auch beim NSCLC eingehend untersucht.
Das in der Therapie des EGFR-mutierten aNSCLC etablierte Osimertinib wurde in der ADAURA-Studie auch im adjuvanten Setting untersucht, d.h. nach Operation der primär resektablen Tumoren und bei manchen Patient:innen auch nach adjuvanter CTx.19 Die Studie zeigte in diesem Setting sehr früh einen klaren Vorteil von Osimertinib (gegenüber drei Jahren) vs. Placebo, der sich auch in der finalen Analyse des krankheitsfreien Überlebens (DFS) nach einer medianen Nachverfolgungszeit von 44 Monaten bestätigte: Bei Patient:innen im Stadium II/IIIA betrug das DFS 65,8 Monate mit Osimertinib vs. 28,1 Monate mit Placebo (HR: 0,23). Ein Teil des positiven Effekts von Osimertinib ging zwar nach Absetzen der Therapie nach drei Jahren verloren, doch zeigte sich trotzdem ein, wie Pall konstatierte, klinisch relevanter OS-Benefit (HR: 0,49). Bei NSCLC-Patient:innen mit ALK-Mutation wurde in der ALINA-Studie die adjuvante CTx mit einer adjuvanten ALK-Inhibitortherapie (Alectinib für zwei Jahre) verglichen.20 Hier zeigte sich die zielgerichtete Therapie der CTx bezüglich DFS deutlich überlegen (HR: 0,24), ohne dass in der Nachverfolgung bislang ein negativer Effekt des Absetzens von Alectinib offensichtlich wäre.
Bei resektablem NSCLC ohne therapeutisch adressierbare Mutationen ist die Operation plus (neo)adjuvanter CTx seit Langem die einzige Option im frühen Stadium. Die CTx hat dabei nur einen moderaten Zusatznutzen; sie ist bekanntermaßen mit Toxizität verbunden und nach einer Operation sind viele Patient:innen gar nicht in der Lage, die CTx zu tolerieren. Wie könnte man hier die ITx integrieren?
Eine Strategie ist, die ITx an eine adjuvante CTx anzuschließen. In den Studien IMPower010 mit Atezolizumab21 und KEYNOTE-09122 zeigte sich ein positiver Effekt der zusätzlichen ITx. Dieser war aber nicht sehr groß, wie Pall kommentierte.
Die Tendenz ist heute daher, die ITx in das neoadjuvante Setting zu verlagern. Die Studie CheckMate 816 setzte eine neoadjuvante Kombination aus CTx und Nivolumab beiPatient:innen mit primär resektablem NSCLC ein.23 Damit wurde eine signifikante Verlängerung des DFS verglichen mit der CTx alleine erreicht (HR: 0,63). Die Studie zeigte auch, dass durch die Zugabe der ITx zur neoadjuvanten CTx die Anzahl der Patient:innen, die vor der Operation verstarben, nicht anstieg.
Gleich fünf Studien untersuchten die Wirksamkeit einer neoadjuvanten CTx plus ITx mit verschiedenen Checkpoint-Inhibitoren vor und nach der Operation.24–28 Die Studien zeigten hinsichtlich des ereignisfreien Überlebens einen signifikanten Benefit von perioperativer ITx plus neoadjuvanter CTx gegenüber der neoadjuvanten CTx allein sowie signifikant höhere pathologische Remissionsraten durch die neoadjuvante ITx.
Nun ist zu entscheiden: Soll man die ITx adjuvant, neoadjuvant oder perioperativ einsetzen? Eine definitive Antwort kann derzeit nicht gegeben werden, doch scheinen laut Pall im indirekten Studienvergleich die neoadjuvanten Konzepte etwas besser zu sein als die adjuvanten. Die Studienergebnisse mit Nivolumab im neoadjuvanten und im perioperativen Setting waren sehr ähnlich.23,26
Quelle:
Session „Best of Oncology“ bei der Frühjahrstagung 2024 der Österreichischen Gesellschaft für Hämatologie & Medizinische Onkologie (OeGHO), 6. April 2024, Wien
Literatur:
1 Planchard D et al.: Osimertinib with or without Chemotherapy in EGFR-Mutated Advanced NSCLC. N Engl J Med 2023; 389(21): 1935-48 2 Cho BC et al.: Ann Oncol 2023; 34(Suppl. 2): S1306 3 Passaro A et al.: Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study. Ann Oncol 2024; 35(1): P77-90 4 Girard N et al.: Ann Oncol 2023; 34(Suppl. 2): S1304 5 Drilon A et al.: Repotrectinib in ROS1 fusion-positive non-small-cell lung cancer. N Engl J Med 2024; 390(2): 118-31 6 De Langen AJ et al.: Sotorasib vs. docetaxel for previously treated non-small-cell lung cancer with KRASG12C mutation: a randomised, open-label, phase 3 trial. Lancet 2023; 401(10378): 733-46 7 Sacher A et al.: Single-agent divarasib (GDC-6036) in solid tumors with a KRAS G12C mutation. N Engl J Med 2023; 389(8): 710-21 8 Mellinghoff IK et al.: INDIGO: A global, randomized, double-blinded, phase 3 study of vorasidenib vs. placebo in patients with residual or recurrent grade 2 glioma with an IDH1/2 mutation. J Clin Oncol 2023; 41(Suppl. 17): Abstr. #LBA1 9 Albiges L et al.: Belzutifan vs. everolimus in participants (pts) with previously treated advanced clear cell renal cell carcinoma (ccRCC): randomized open-label phase III LITESPARK-005 study. Ann Oncol 2023; 34(Suppl. 2): S1329-30 10 Powles T et al.: Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med 2024; 390(10): 875-88 11 Powles T et al.: ESMO Clinical Practice Guideline interim update on first-line therapy in advanced urothelial carcinoma. Ann Oncol 2024; 12 Moore KN et al.: Mirvetuximab soravtansine in FRα-positive, platinum-resistant ovarian cancer. N Engl J Med 2023; 389(23): 2162-74 13 Bardia A et al.: LBA11: Datopotamab deruxtecan (Dato-DXd) vs chemotherapy in previously-treated inoperable or metastatic hormone receptor-positive, HER2-negative (HR+/HER2–) breast cancer (BC): Primary results from the randomised phase III TROPION-Breast01 trial. Ann Oncol 2023; 34(Suppl. 2): S1264-5 14 Ahn MJ et al.: Datopotamab deruxtecan (Dato-DXd) vs docetaxel in previously treated advanced/metastatic (adv/met) non-small cell lung cancer (NSCLC): results of the randomized phase 3 study TROPION-Lung01. Ann Oncol 2023; 34(Suppl. 2): S1305-6 15 Cervantes A et al.: Metastatic colorectal cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol 2023; 34(1): 10-32 16 Andre T et al.: Nivolumab (NIVO) plus ipilimumab (IPI) vs chemotherapy (chemo) as first-line (1L) treatment for microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC): first results of the CheckMate 8HW study. J Clin Oncol 2024; 42(Suppl. 3): Abstr. #LBA768 17 Janjigian YY et al.: Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet 2023; 402(10418): 2197-208 18 Van der Heijden MS et al.: Nivolumab plus gemcitabine-cisplatin in advanced urothelial carcinoma. N Engl J Med 2023; 389(19): 1778-89 19 Herbst RS et al.: Adjuvant osimertinib for resected EGFR-mutated stage IB-IIIA non-small-cell lung cancer: updated results from the phase III randomized ADAURA trial. J Clin Oncol 2023; 41(10): 1830-40 20 Solomon BJ et al.: LBA2: ALINA: Efficacy and safety of adjuvant alectinib versus chemotherapy in patients with early-stage ALK+ non-small cell lung cancer (NSCLC). Ann Oncol 2023; 34(Suppl. 2): S1295-6 21 Felip E et al.: Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet 2021; 398(10308): 1344-57 22 O‘Brien M et al.: Pembrolizumab vs. placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol 2022; 23: 1274-86 23 Forde PM et al.: Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer. N Engl J Med 2022; 386(21): 1973-85 24 Heymach JV et al.: Perioperative durvalumab for resectable non-small-cell lung cancer. NEngl J Med 2023; 389(18): 1672-84 25 Wakelee H et al.: Perioperative pembrolizumab for early-stage non-small-cell lung cancer. N Engl J Med 2023; 389(6): 491-503 26 Cascone T et al.: CheckMate 77T: phase III study comparing neoadjuvant nivolumab (NIVO) plus chemotherapy (chemo) vs neoadjuvant placebo plus chemo followed by surgery and adjuvant NIVO or placebo for previously untreated, resectable stage II–IIIb NSCLC. Ann Oncol 2023; 34(Suppl. 2): S1295 27 Lu S et al.: Perioperative toripalimab + platinum-doublet chemotherapy vs chemotherapy in resectable stage II/III non-small cell lung cancer (NSCLC): interim event-free survival (EFS) analysis of the phase III Neotorch study. J Clin Oncol 2023; 41(Suppl. 36): 425126 28 Yue D et al.: RATIONALE-315: Event-free survival (EFS) and overall survival (OS) of neoadjuvant tislelizumab (TIS) plus chemotherapy (CT) with adjuvant TIS in resectable non-small cell lung cancer (NSCLC). Ann Oncol 2024; 35(3): P332-3
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...