NSCLC im Fokus
Autor:
Dr. med. Sebastian Kraus
Stadtspital Zürich, Standort Triemli
Oberarzt, Klinik für medizinische Hämatologie und Onkologie, Zürich
E-Mail: sebastian.kraus@stadtspital.ch
Im Folgenden präsentiere ich meine Highlights vom ESMO-Kongress 2024 zum Thema Thoraxonkologie. Es wurden erneut innovative, vielversprechende und spannende Therapieansätze präsentiert, wobei ich mich in meiner Zusammenfassung auf Studien zum nichtkleinzelligen Lungenkarzinom (NSCLC) konzentrieren werde.
CCTG BR.31: Durvalumab adjuvant
Im perioperativen Setting wurden die Ergebnisse der Studie CCTG BR.31 gezeigt.1 Hier wurde, ähnlich dem Design der Studien PEARLS und IMpower010, die adjuvante Gabe des PD-L1-Antikörpers Durvalumab über einen Zeitraum von zwölf Monaten bei Patient:innen mit NSCLC untersucht.
Durvalumab vs. Placebo wurde in einem Phase-III-Studiendesign nach platinhaltiger adjuvanter Chemotherapie verglichen. Der primäre Endpunkt, nämlich der Unterschied im krankheitsfreien Überleben (DFS) in der Patient:innengruppe mit PD-L1-Expression in den Tumorzellen, ≥25% bei EGFR- und ALK-Wildtyp, wurde nicht erreicht (HR: 0,935; p=0,642). Diese Resultate stehen im Widerspruch zu den positiven Daten der Studien PEARLS und IMpower010, in denen jeweils ein DFS-Vorteil durch die adjuvante Immuntherapie beobachtet werden konnte.2,3
Generell lässt sich jedoch hypothetisieren, insbesondere aufgrund der zahlreichen positiven Daten zur neoadjuvanten bzw. perioperativen Chemoimmuntherapie, dass ein neoadjuvanter Therapieansatz mit einer PD-(L)1-gerichteten Behandlung effizienter erscheint. Dies lässt sich am ehesten mit dem Vorhandensein von Tumorantigenen bei Therapiebeginn begründen, sodass eine Interaktion zwischen dem Immunsystem und den Tumorzellen stattfinden kann.1
mRNA-Impfung korreliertmit PD-L1-Expression
Eine interessante retrospektive Analyse untersucht die mögliche Assoziation zwischen mRNA-Impfungen gegen SARS-CoV-2 und der Hochregulation der PD-L1-Expression in Tumorzellen und eine damit einhergehende potenzielle Verbesserung des Therapieansprechens auf PD-(L)1-gerichtete Immuntherapie bei Patient:innen mit NSCLC.4
Die Ergebnisse dieser Untersuchung zeigen, dass mRNA-Impfungen gegen Covid-19 mit einer erhöhten PD-L1-Expression in den Tumorzellen korrelieren.
Dieses Phänomen wurde nicht bei Influenza- oder Pneumokokken-Impfungen beobachtet. Aufgrund dieser Beobachtungen wurde auch untersucht, ob sich die Therapieansprechrate nach mRNA-Impfungen verbessert. Tatsächlich konnte ein längeres Gesamtüberleben (OS) festgestellt werden, wenn die Immuntherapie innerhalb von 100 Tagen nach einer Covid-19-mRNA-Impfung begonnen wurde (adjustierte HR: 0,52).
Ähnliche OS-Ergebnisse wurden auch bei Melanompatient:innen beobachtet (adjustierte HR: 0,31). Weiterführende Studien, die diese spannenden Resultate prospektiv zu validieren versuchen, sind in Planung.
Kombination:Belrestotug und Dostarlimab
Auf dem Kongress wurden auch die ersten Daten der Studie GALAXIES Lung-201 zum neuen TIGIT-Antikörper Belrestotug in Kombination mit dem PD-1-Antikörper Dostarlimab vorgestellt.5 In dieser Phase-II-Studie untersuchte man therapienaive Patient:innen mit NSCLC ohne Treibermutationen mit einer hohen PD-L1-Expression (≥50% in den Tumorzellen).
Es konnte gezeigt werden, dass die Kombinationstherapie im Vergleich zur Dostarlimab-Gruppe eine deutlich höhere Gesamtansprechrate (ORR) aufweist, mit Werten von bis zu 76,7% in der höchsten Dosierungsstufe, während die ORR in der Dostarlimab-Kohorte bei 37,5% lag. Allerdings kam es auch zu mehr immunvermittelten Nebenwirkungen in den Behandlungsarmen mit der TIGIT-Therapie.
Diese vielversprechenden Ergebnisse führen dazu, dass die Kombination von Belrestotug und Dostarlimab nun in der Studie GALAXIES Lung-301 in einem Phase-III-Design weiter untersucht wird.
MARIPOSA-2:Amivantamab und Chemotherapie
Als Nächstes leite ich zu dem Gebiet des NSCLC mit Treibermutationen über und beginne dabei mit einem zweiten Zwischenbericht zum OS in der Studie MARIPOSA-2.6 In dieser Studie wurden der bispezifische, gegen MET und EGFR gerichtete Antikörper Amivantamab in Kombination mit Chemotherapie und Chemotherapie allein bei NSCLC mit typischen EGFR-Mutationen nach Krankheitsprogression unter Osimertinib (Osi) verglichen.
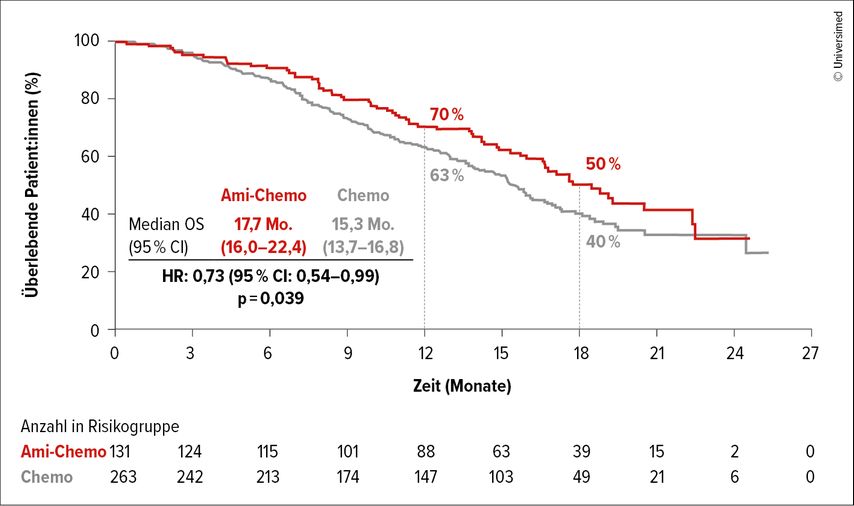
In der ersten Interimsanalyse des Gesamtüberlebens zeigte sich bereits ein Trend zu einem längeren Gesamtüberleben für die Kombination aus Amivantamab und Chemotherapie. Nun wurden Daten nach einer medianen Nachbeobachtungszeit von 18,1 Monaten präsentiert. In dieser Analyse zeigte die Kombination aus Amivantamab und Chemotherapie ein medianes Gesamtüberleben von 17,7 Monaten im Vergleich zu 15,3 Monaten, wobei 50% der Patient:innen in der Amivantamab-Gruppe und 40% in der Chemotherapie-Gruppe nach 18 Monaten noch lebten (HR: 0,73; p=0,039; Abb. 1). Auch die Zeit bis zur symptomatischen Progression, die Zeit bis zum Abbruch der Behandlung und die Zeit bis zur nächsten Therapie waren in der Amivantamab-+-Chemotherapie-Gruppe verlängert.
Abb. 1: Gesamtüberleben (OS): Die Kombination von Amivantamab und Chemotherapie zeigt weiterhin einen klaren Vorteil gegenüber Chemotherapie alleine(modifiziert nach Popat S et al.)6
Zusammenfassend bestätigen diese Nachbeobachtungsdaten die Überlegenheit der Kombination von Amivantamab und Chemotherapie im Vergleich zur alleinigen Chemotherapie in dieser Patient:innengruppe mit typischen EGFR-Mutationen nach Progression unter Osimertinib.
Resistenzmechanismenbei EGFR-Mutationen
Eine weitere Analyse betraf die Evaluation von Resistenzmechanismen bei Patient:innen mit typischen EGFR-Mutationen in einer explorativen Analyse der Studie MARIPOSA.7 In dieser wurden Amivantamab und Lazertinib, ein EGFR-TKI der dritten Generation, mit Osimertinib in der ersten Linie verglichen. Resistenzen gegen und Tumorprogression unter Behandlung mit Osimertinib treten früher oder später typischerweise auf.
Häufige Resistenzmechanismen gegenüber Osimertinib sind MET-Amplifikationen und EGFR-basierte Resistenzmechanismen, wie z.B. die EGFR-C797S-Mutation, die beide in der Amivantamab- und Lazertinib-Gruppe seltener vorkamen als unter Osimertinib (p=0,017 und p=0,014). Auch andere Resistenzmechanismen wie RAS/RAF-Mutationen, HER2-Amplifikationen und PI3K-Mutationen waren bei der Kombination von Amivantamab und Lazertinib nicht statistisch signifikant höher. Interessanterweise zeigte sich sogar unter Amivantamab und Lazertinib eine niedrigere Rate an TP53/RB1-Verlust, die mit einer Transformation in ein kleinzelliges Karzinom assoziiert ist.
Es scheint also, dass bei der Gabe von Amivantamab und Lazertinib das Spektrum und die Komplexität der Resistenzen im Vergleich zu Osimertinib verringert werden.
«Dose expansion»:Telisotuzumab Adizutecan
Darüber hinaus wurden Phase-I-Ergebnisse des neuen, gegen c-MET gerichteten Antikörper-Wirkstoff-Konjugats (ADC) Telisotuzumab Adizutecan (ABBV-400) vorgestellt.8 Wir wissen, dass eine Überexpression des c-MET-Proteins häufig bei NSCLC vorkommt und einen negativen prognostischen Faktor darstellt.
In dieser Dosiserweiterungsstudie wurden Ergebnisse nach einer «dose expansion» in einer vorbehandelten Patient:innengruppe mit nichtsquamösem EGFR-Wildtyp präsentiert. Die Patient:innen hatten im Median zwei vorherige Behandlungen, fast alle der 48 Patient:innen hatten bereits eine platinbasierte Chemotherapie und eine Immuntherapie erhalten.
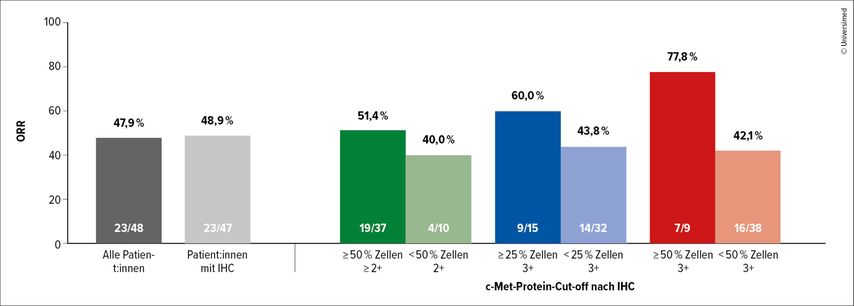
Bei einer medianen Nachbeobachtungszeit von 6,8 Monaten zeigte dieses neue ADC eine ORR von 47,9% und ein medianes PFS von 6,9 Monaten. Die Ansprechraten wurden über ein breites Spektrum von c-MET-Expressionen beobachtet, jedoch waren die besten ORR bei einer erhöhten Expression zu verzeichnen (Abb. 2).
Bezüglich der Toxizität traten am häufigsten gastrointestinale und hämatologische AE auf, aber auch Pneumonitis, respektive interstitielle Lungenerkrankungen (ILD), wurden bei 13% der Patient:innen beobachtet. Eine weitergehende Evaluierung dieses Medikaments ist geplant.9
PHAROS: Encorafenibund Binimetinib
Zu guter Letzt gab es ein Update zur Studie PHAROS, in der Patient:innen mit BRAF-V600E-Mutationen eine BRAF- und MEK-Inhibition mit Encorafenib und Binimetinib in einem Phase-II-Studiendesign erhielten. In der Gruppe mit 61 behandlungsnaiven Patient:innen konnte eine beeindruckende Gesamtansprechrate von 65,6% beobachtet werden, dies bei einer Ansprechdauer von 13 Monaten. Die mediane Dauer des Ansprechens betrug 13 Monate, das mediane Gesamtüberleben war noch nicht erreicht.
Eine weitere Kohorte mit vorbehandelten Patient:innen rekrutiert weiterhin.10 Diese Studie bestätigt die Wirksamkeit von Encorafenib und Binimetinib als Behandlungsoption für Patient:innen mit BRAF-V600E-mutiertem NSCLC.
Literatur:
1 Goss G et al.: CCTG BR.31: a global, double-blind placebo-controlled, randomized phase III study of adjuvant durvalumab in completely resected non-small cell lung cancer (NSCLC). Ann Oncol 2024; 35(Suppl 2): Abstr. #LBA48 2 O’Brien M et al.: Pembrolizumab versus placebo as adjuvant therapy for completely resected stage IB-IIIA non-small-cell lung cancer (PEARLS/KEYNOTE-091): an interim analysis of a randomised, triple-blind, phase 3 trial. Lancet Oncol 2022; 23(10): P1274-86 3 Felip E et al.: Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet 2021; 398(10308): P1344-57 4 Grippin AJ et al.: Association of SARS-COV-2 mRNA vaccines with tumor PD-L1 expression and clinical responses to immune checkpoint blockade. Ann Oncol 2024; 35(Suppl 2): S674-711 5 Spigel DR et al.: Interim analysis of GALAXIES Lung-201: phase II, randomized, open-label platform study of belrestotug plus dostarlimab in patients (pts) with previously untreated locally advanced/metastatic (LA/M) PD-L1 high (TPS >/=50%) non-small cell lung cancer (NSCLC). Ann Oncol 2024; 35(Suppl 2): Abstr. #LBA52 6 Popat S et al.: Amivantamab plus chemotherapy vs chemotherapy in EGFR-mutated, advanced non-small cell lung cancer after disease progression on osimertinib: second interim overall survival from MARIPOSA-2. Ann Oncol 2024; 35(Suppl 2): Abstr. #LBA54 7 Besse B et al.: Mechanisms of acquired resistance to first-line amivantamab plus lazertinib versus osimertinib in patients with EGFR-mutant advanced non-small cell lung cancer: an early analysis from the phase III MARIPOSA study. Ann Oncol 2024; 35(Suppl 2): Abstr. #LBA55 8 Hongge L, Wang M: MET oncogene in non-small cell lung cancer: mechanism of MET dysregulation and agents targeting the HGF/c-Met axis. Onco Targets Ther 2020; 25(13): 2491-510, https://pubmed.ncbi.nlm.nih.gov/32273721/ 9 De Miguel M et al.: ABBV-400, a c-Met protein-targeting antibody-drug conjugate (ADC), in patients (Pts) with advanced EGFR wildtype (WT) non-squamous (NSQ) non-small cell lung cancer (NSCLC): results from a phase I study. Ann Oncol 2024; 35(Suppl 2): Abstr. #1257MO 10 Planchard D et al.: Encorafenib plus binimetinib in patients (pts) with previously untreated BRAF V600E-mutant advanced non-small cell lung cancer (NSCLC): an open-label, multicenter phase II trial (IFCT-1904 ENCO-BRAF). Ann Oncol 2024; 35(Suppl 2): Abstr. #1259M0
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...