Nierenbeteiligung bei hämatologischen Malignomen
Autor:
OA PD Mag. Dr. Johannes M. Werzowa
Leitung Nephrologie und Dialyse
1. Medizinische Abteilung
Mein Hanusch-Krankenhaus, Wien
E-Mail: johannes.werzowa@oegk.at
Hämatologische Erkrankungen können komplexe nephrologische Krankheitsbilder erzeugen. Da das renale Überleben stark mit dem Gesamtüberleben der Patient:innen korreliert, ist es wichtig, nephrologische Begleiterscheinungen und Syndrome frühzeitig zu erkennen.
Keypoints
-
Hämatologische Malignome gehen oft mit einer akuten und/oder chronischen Schädigung der Nieren einher. Diese Schäden können z.B. durch das Malignom direkt, durch fehlgeleitete Immunreaktionen oder als Komplikation der onkologischen Therapie verursacht werden.
-
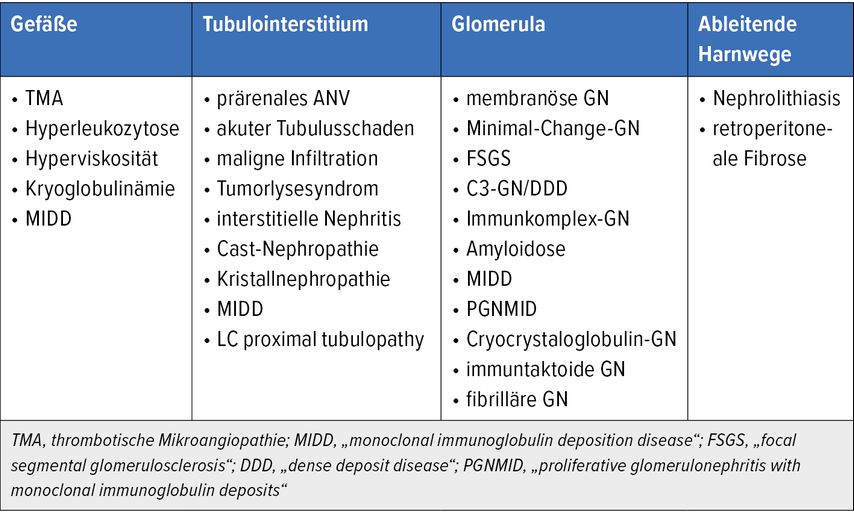
Alle Kompartimente der Niere können von den Schäden betroffen sein: Blutgefäße, Tubulointerstitium, Glomerula und ableitende Harnwege.
-
Komplikationen wie z.B. prärenales Nierenversagen oder Tumorlysesyndrom können ohne invasive Diagnostik erkannt und behandelt werden. Manchmal ist aber eine Nierenbiopsie zur Diagnostik unerlässlich, da sich aus dem Befund auch eine therapeutische Konsequenz ergeben kann. Dies trifft insbesondere häufig auf monoklonale Gammopathien zu, die vielgestaltige und ernste Schäden an den Nieren verursachen können.
Das Vorkommen hämatologischer Malignome nimmt weltweit zu. Häufig kommt es im Rahmen dieser Erkrankungen zu akuten wie auch chronischen Schädigungen der Niere. Das Gebiet der Onkonephrologie hat daher stark an Bedeutung gewonnen, auch aufgrund des zunehmenden Verständnisses der Zusammenhänge zwischen hämatoonkologischen Erkrankungen und Nierenerkrankungen.1
Die Mechanismen der hämatologischen Nierenschädigung sind vielfältig und ihre Manifestationen decken praktisch das gesamte Gebiet der Nephropathologie ab. Einschränkungen der Nierenfunktion haben einen starken negativen Einfluss auf die Lebensqualität sowie das Überleben der Erkrankten. Einerseits können diese Schädigungen durch die eingesetzten Therapien ausgelöst werden, andererseits können auch die Erkrankungen selbst durch unterschiedliche Mechanismen Nierenschäden bewirken.
Tabelle 1 gibt einen Überblick über mögliche Nierenkomplikationen hämatologischer Malignome (ohne Anspruch auf Vollständigkeit). Es können alle Kompartimente der Niere betroffen sein und ein und dieselbe Erkrankung kann gleichzeitig auch mehrere Kompartimente schädigen. Vom klinischen Standpunkt aus können die Schädigungen chronisch (Dauer >3 Monate) oder akut (Dauer <3 Monaten) sein; sie können sich durch Schädigungen der Gefäße (mikro- sowie makrovaskulär), des Tubulointerstitiums, der Glomerula und der ableitenden Harnwege manifestieren.2
Tab. 1: Mögliche Nierenkomplikationen hämatologischer Malignome (modifiziert nach Abramson M et al.)2
Die korrekte Diagnose der Nierenerkrankung kann in vielen Fällen einen entscheidenden Einfluss auf die Therapie und die Prognose der Betroffenen haben, dies trifft insbesondere auf das komplexe Gebiet der monoklonalen Gammopathien zu.
Im Folgenden werden exemplarisch Schädigungsmechanismen an unterschiedlichen Kompartimenten der Niere erläutert.
Schädigung der Nierengefäße
Hyperleukozytosen, Hyperviskositätssyndrom und Kryoglobulinämien
Hyperleukozytosen treten typischerweise bei akuten myeloischen und lymphatischen Leukämien auf. Kinder sind davon häufiger betroffen als Erwachsene. Durch die durch Hyperleukozytosen bedingte Viskositätserhöhung des Blutes kann es zu Mikrozirkulationsstörungen vieler Organsysteme einschließlich der Nieren kommen.
Auch das Hyperviskositätssyndrom, das durch hohe Immunglobulinkonzentrationen im Blut (meist IgM im Rahmen eines Morbus Waldenström) verursacht wird, kann zu Nierenschädigungen führen. Kryoglobulinämien vom Typ 1 (monoklonales IgG oder IgM), die bei lymphoproliferativen Erkrankungen beobachtet werden, können zur Okklusion der Nierengefäße mit hyalinen Thromben führen.
Entscheidend für die Prognose aller dieser Komplikationen ist eine rechtzeitige Therapie der zugrundeliegenden hämatologischen Erkrankung.
Thrombotische Mikroangiopathien
Thrombotische Mikroangiopathien (TMA) stellen einen weiteren Schädigungsmechanismus der kleinen Nierengefäße dar. Hämatologische Erkrankungen können (neben vielen anderen Ursachen) solche TMA in den Nierengefäßen auslösen. Durch Endothelschäden kommt es zur Thrombozytenaktivierung und zu mikrovaskulären Okklusionen, die wiederum zu einer Fragmentierung von roten Blutkörperchen führen (mikroangiopathische Anämie mit LDH-Anstieg und Thrombozytenverlust). Im Rahmen von hämatoonkologischen Erkrankungen sind jene TMA am relevantesten, die durch die Chemotherapie hervorgerufen werden.
Die Proteasom-Inhibitoren Bortezomib und insbesondere Carfilzomib sowie zahlreiche andere antineoplastische und immunmodulierende Substanzen können TMA auslösen. Es gibt in diesen Fällen Berichte über den erfolgreichen Einsatz des Komplement-Inhibitors Eculizumab, um den TMA entgegenzuwirken.
Lenalidomid kann über die Induktion von ADAMTS13-Antikörpern eine thrombotisch-thrombozytopenische Purpura (TTP) auslösen, die eine Indikation zum Plasmaaustausch darstellt. In allen Fällen ist das Absetzen des auslösenden Agens angezeigt. Manche solide Tumoren wie z.B. Adenokarzinome, aber auch monoklonale Gammopathien und primäre Myelofibrosen können direkt eine TMA auslösen. Auch hier besitzen Komplement-Inhibitoren eine therapeutische Bedeutung.3
Schädigung des Tubulointerstitiums
Prärenales akutes Nierenversagen (ANV) ist nicht ungewöhnlich im Rahmen von Infekten, die mit einer hämodynamischen Kompromittierung einhergehen, insbesondere bei Patient:innen, die zusätzlich nephrotoxischen Substanzen ausgesetzt sind. Weiters reagiert die Niere sehr empfindlich auf ionisierende Strahlung, die zum Beispiel im Rahmen einer myeloablativen Therapie vor Knochenmarktransplantation eingesetzt wird.
Eine Infiltration des Nierengewebes mit begleitender Einschränkung der Nierenfunktion tritt in erster Linie im Rahmen von Non-Hodgkin-Lymphomen (NHL) auf, insbesondere bei aggressiven Formen wie dem diffusen Large-B-Zell-Lymphom. Eine Reduktion der Tumormasse durch Chemotherapie führt in diesen Fällen zu einer Verbesserung der Nierenfunktion.4
Tumorlysesyndrom
Das Tumorlysesyndrom (TLS) ist eine potenziell lebensbedrohliche therapiebedingte Komplikation bei Tumoren mit hoher Tumormasse wie NHL, akuten Leukämien oder auch soliden Tumoren. Im Rahmen eines massiven Zellzerfalls von Tumorzellen durch zytoreduktive Therapien gelangen große Mengen an Harnsäure (aus Tumor-DNA stammend) und Phosphor in die Zirkulation.
Die plötzlich auftretenden hohen Konzentrationen dieser Elektrolyte führen zu Supersaturation und Kristallbindung in der Niere und den ableitenden Harnwegen. Es kommt zu Inflammation und Obstruktion im Tubulusapparat, die daraus resultierende Funktionseinschränkung der Niere führt zu einem weiteren Anstieg von Phosphat und Kalium im Serum. Aufgrund der hohen Serumphosphatwerte kommt es zur Ausfällung von Kalziumphosphat im Nierengewebe, was zur Ausbildung einer ausgeprägten sekundären Hypokalzämie mit entsprechenden Störungen der kardialen Reizleitung sowie neurologischen Symptomen führen kann. Die begleitende Hyperkaliämie erhöht das Arrhythmierisiko ebenfalls zusätzlich.
Besonders hoch ist das TLS-Risiko u.a. bei Burkitt-Lymphomen und akuten Leukämien. Sind aufgrund einer bestehenden chronischen Niereninsuffizienz (CNI) die Kalium- und Phosphatwerte bereits vor Chemotherapiebeginn erhöht, besteht ebenfalls ein höheres TLS-Risiko.
Präventiv sollte mit Therapiebeginn auf eine großzügige intravenöse Hydrierung geachtet werden (Harnproduktion von mindestens 100ml/m2/h anstreben). Auf die Gabe von Diuretika, insbesondere Thiaziden, sollte nach Möglichkeit verzichtet werden; ebenso auf die Substitution von Kalzium, außer bei symptomatischen Hypokalzämien zur Symptomkontrolle. Bei Zeichen von Volumenüberladung sollten Schleifendiuretika eingesetzt werden, manche Autor:innen empfehlen auch Mannitol. Auf eine Harnalkalisierung, die früher propagiert wurde, sollte verzichtet werden, da im alkalischen Harn Kalziumphosphat früher auskristallisiert.
Zur raschen Harnsäuresenkung, insbesondere bei Patient:innen mit hohem TLS-Risiko, hat sich Rasburicase etabliert (rekombinante Variante der Uratoxidase, die Harnsäure in unschädliches Allantoin umwandelt). Bei milden TLS-Verläufen kann Allopurinol zur Harnsäuresenkung eingesetzt werden. Unter Allopurinol-Therapie kommt es zu einem vermehrten Anfallen von Xanthin, das in hohen Konzentrationen auch zu Nierenschäden führen kann (Xanthin-Nephropathie). Daher sollte Allopurinol nur zur Prophylaxe eines TLS eingesetzt werden, aber nicht zur Therapie eines manifesten TLS. Weiters sind Allopurinol-Unverträglichkeiten keine Seltenheit. Rasburicase ist deutlich besser verträglich, Kontraindikationen sind lediglich Stillen/Schwangerschaft und eine bestehende Glukose-6-Phosphat-Dehydrogenase-Defizienz.5
Cast-Nephropathie
Die Cast-Nephropathie, oder exakter die Immunglobulin-Light-Chain-Cast-Nephropathie, ist die häufigste Nierenmanifestation des multiplen Myeloms (MM) und stellt ein Myelom-definierendes Ereignis dar. Etwa zwei Drittel der Patient:innen mit MM, die eine Nierenbeteiligung erleiden, haben eine Cast-Nephropathie. Man muss sie als zeitkritischen Notfall ansehen, da das Gesamtüberleben eng mit der Nierenprognose verknüpft ist.
Unter physiologischen Bedingungen werden freie Leichtketten („free light chains“ [FLC]) im Glomerulum filtriert und dann im proximalen Tubulus über den Megalin-Cubilin-Rezeptorkomplex rückresorbiert und abgebaut. Im Rahmen des MM kann die Kapazität dieses Systems überschritten werden und große Mengen von FLC gelangen in den Harn. Durch eine Interaktion mit dem im distalen Tubulus physiologisch vorkommenden Tamm-Horsfall-Protein kommt es zu Vernetzungen dieser Proteine und zu einem gelartigen Ausguss (Cast) der distalen Tubuli und des Sammelrohrs mit begleitender inflammatorischer Reaktion.
In der Harnanalyse fällt ein hoher Proteingehalt des Harns (Bence-Jones-Proteinurie) bei geringem Albuminanteil auf. Bei Patient:innen mit sehr hohen Serumkonzentrationen eines Leichtkettenparaproteins (>500mg/l) kann im Rahmen eines ANV mit hoher Wahrscheinlichkeit von einer Cast-Nephropathie ausgegangen werden, insbesondere wenn auch eine Bence-Jones-Proteinurie vorliegt. Eine Therapie muss prompt etabliert werden.
Hauptaugenmerk der Therapie muss auf der Bekämpfung des malignen B-Zell-Klons liegen, was heute in erster Linie mit dem Proteasom-Inhibitor Bortezomib plus Dexamethason in Kombination mit anderen Substanzen wie Lenalidomid und Daratumumab erfolgt. Zusätzlich sollten supportive Maßnahmen ergriffen werden, insbesondere das Meiden nephrotoxischer Substanzen wie NSAID und Aminoglykosiden. Auch ACE-Hemmer und Angiotensin-Rezeptor-Antagonisten sollten nicht verabreicht werden.
Eine Harnmenge von 3l/d sollte durch ausreichende Hydrierung aufrechterhalten werden, möglichst ohne den Einsatz von Schleifendiuretika, da diese die Cast-Bildung fördern können. Eine bestehende Hyperkalzämie muss behandelt werden, da auch sie nephrotoxisch wirkt. Hierzu sollen in erster Linie Hydrierung und bei hohen Kalziumwerten Bisphosphonate eingesetzt werden (z.B. Pamidronat als Einmalgabe, 90mg i.v. über zwei Stunden, keine Dosisreduktion bis zu einer eGFR von 30ml/min, darunter strenge Nutzen-Risiko-Abwägung) oder alternativ Denosumab.
Die Verwendung einer großporigen („high cut-off“) Dialysemembran zur extrakorporalen Entfernung von Paraprotein bei Patient:innen mit dialysepflichtigem Nierenversagen wird kontrovers diskutiert und gehört heute nicht mehr zu den Standardtherapieoptionen aufgrund des damit einhergehenden großen Verlusts an anderen Serumbestandteilen. Die Rolle von mittelporigen („medium cut-off“) Membranen in diesem Zusammenhang ist noch unklar.
Bei niedrigen Konzentrationen von Serum-Leichtketten kommen viele Differenzialdiagnosen zum Mechanismus der Nierenschädigung infrage, und die Indikation zur Nierenbiopsie sollte großzügig gestellt werden (siehe Abschnitt zur monoklonalen Gammopathie renaler Signifikanz [MGRS]).6,7
Schädigung der Glomerula
Die möglichen Läsionen die Glomerula betreffend sind sehr vielfältig. Es können praktisch alle nephropathologischen Schädigungsmuster der Glomerula bei hämatologischen Malignomen beobachtet werden.
AL-Amyloidose
Das (nach der Cast-Nephropathie) zweithäufigste Immunglobulin-assoziierte Schädigungsmuster der Niere ist die Leichtketten-Amyloidose (AL-Amyloidose). Hierbei kommt es zu in der Elektronenmikroskopie erkennbaren fibrillären Ablagerungen in den Glomerula, die sich in der Lichtmikroskopie mit Kongorot anfärben lassen.
Die AL-Amyloidose stellt von allen über 40 bekannten Amyloidosearten mit Abstand die häufigste dar (>85% der renalen Amyloidosen). Üblicherweise sind neben den Nieren (57%) auch Herz (75%), Nerven (22%), Leber (20%) und Darm (17%) betroffen. Zugrundeliegend ist zumeist eine monoklonale Gammopathie, ein MM oder eine andere hämatologische Erkrankung.
Klinisch äußert sich die Nierenbeteiligung zumeist durch eine massive Proteinurie (aber nicht überwiegend Bence-Jones-Protein) mit nephrotischem Syndrom. Eine Hämaturie tritt nicht auf (kein nephritisches Sediment) und die Betroffenen leiden aufgrund der häufigen kardialen Beteiligung oft unter arterieller Hypotonie. Ca. 25% der Betroffenen werden im Verlauf ihrer Erkrankung dialysepflichtig.
Entscheidend ist auch hier der frühzeitige Beginn mit einer Chemotherapie.8 Die besten Daten gibt es derzeit zu Daratumumab plus Cyclophosphamid, Bortezomib und Dexamethason (ANDROMEDA-Trial).9 Nach erfolgreicher hämatologischer Therapie ist eine Nierentransplantation bei Patient:innen mit terminaler Niereninsuffizienz möglich.
„Monoclonal immunoglobulin deposition diseases“
Eine weitere, wenn auch seltene renale Manifestation von paraproteinämischen Erkrankungen stellen die „monoclonal immunoglobulin deposition diseases“ (MIDD) dar, zu denen die „light chain“ (LCDD) und die „heavy chain deposition disease“ (HCDD) gehören. Hierbei kommt es zur unorganisierten Ablagerung von Leichtketten (und in 20% der Fälle von „heavy chains“) in den Glomerula, aber auch in anderen Kompartimenten der Niere.
Klinisch präsentiert sich die Erkrankung meist mit Hämaturie, Proteinurie (aber nicht nephrotisch) und arterieller Hypertonie. Unbehandelt führt diese Erkrankung zum terminalen Nierenversagen. Extrarenale Beteiligung wird in ca. 35% der Fälle beobachtet. Der Großteil der Betroffenen erfüllt die Kriterien für eine MGUS (monoklonale Gammopathie unklarer Signifikanz), ca. 20% haben ein zugrundeliegendes MM. Nach erfolgreicher Chemotherapie ist auch hier eine Nierentransplantation möglich, allerdings mit höheren Rekurrenz-Raten verglichen mit der AL-Amyloidose.10
Monoklonale Gammopathierenaler Signifikanz
Wie bereits erwähnt sind die renalen Komplikationen, die im Rahmen von B-Zell-Dyskrasien auftreten können, überaus vielfältig und klinisch relevant.
Von einer monoklonalen Gammopathie renaler Signifikanz (MGRS; im Gegensatz zur MGUS) spricht man dann, wenn eine Nierenläsion im Rahmen einer klonalen B-Zell-Proliferation auftritt, die mit dem produzierten monoklonalen Immunglobulin in Zusammenhang steht, bei gleichzeitig fehlenden Kriterien für den Beginn einer spezifischen hämatologischen Therapie. Da aber über 70% der Patient:innen mit einer MGRS unbehandelt ein terminales Nierenversagen erleiden, sind die rechtzeitige Diagnose und Therapie von großer Bedeutung.
Weiters sind extrarenale Beteiligungen (z.B. Haut, Augen, Herz, Leber, Nerven) häufig. Auch hier ebnet die korrekte nephrologische Diagnose den Weg zur Therapie dieser Komplikationen.11 In einer Studie aus Deutschland wurden 44 Patient:innen, die eine MGUS sowie eine eingeschränkte Nierenfunktion hatten, nierenbiopsiert. Es fanden sich bei diesen Patient:innen 16 unterschiedliche nephropathologische Diagnosen, darunter Cast-Nephropathie, AL-Amyloidose, MIDD, C3-Glomerulonephritis, membranoproliferative Glomerulonephritis, membranöse Glomerulonephritis, TMA, aber auch diabetische Nephropathie.12
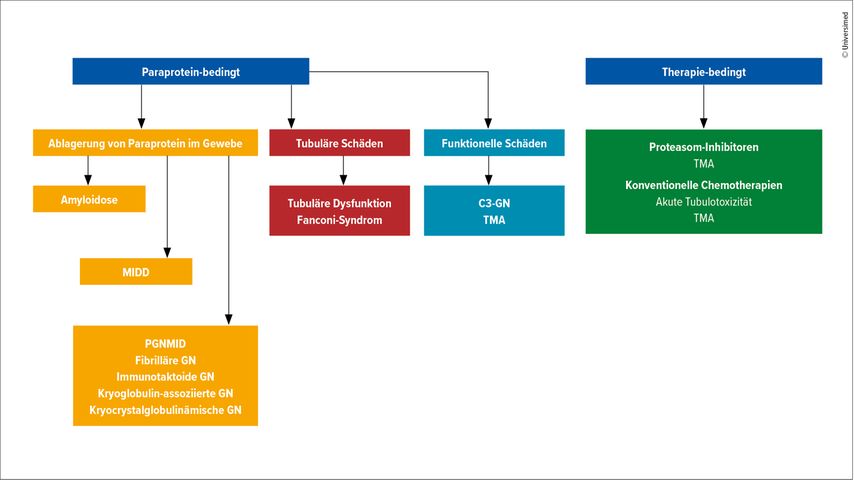
Bei weiteren 51 Patient:innen, die zum Zeitpunkt der Biopsie noch keine hämatoonkologische Diagnose hatten, konnte aufgrund des Nierenbiopsiebefundes eine Diagnose gestellt werden (z.B. MM oder AL-Amyloidose). Abbildung 1 bietet einen Überblick über die vielen Mechanismen der Nierenschädigung im Rahmen von monoklonalen Gammopathien.
Abb. 1: Nierenbeteiligung im Rahmen von monoklonalen Gammopathien (modifiziert nach Bonilla M et al.)11
Zusammenfassend gesagt, können hämatologische Erkrankungen komplexe nephrologische Krankheitsbilder erzeugen und in unklaren Fällen ist eine frühzeitige nephrologische Vorstellung sinnvoll, da das renale Überleben stark mit dem Gesamtüberleben der Patient:innen korreliert.
Literatur:
1 Bonilla M et al.: Onconephrology 2022: an update. Kidney360 2023; 4(2): 258-71 2 Abramson M, Mehdi A: Hematological malignancies and the kidney. Adv Chronic Kidney Dis 2022; 29(2): 127-40.e1 3 Bridoux F et al.: Kidney injury and disease in patients with haematological malignancies. Nat Rev Nephrol 2021; 17(6): 386-401 4 Da’as N et al.: Kidney involvement and renal manifestations in non-Hodgkin’s lymphoma and lymphocytic leukemia: a retrospective study in 700 patients. Eur J Haematol 2001; 67(3): 158-64 5 Howard SC et al.: Tumour lysis syndrome. Nat Rev Dis Primers 2024; 10(1): 58 6 Pratt G et al.: How I treat light chain cast nephropathy. Clin J Am Soc Nephrol 2024; 19(5): 650-2 7 Cosmai L, Gallieni M: High-cutoff hemodialysis therapy for patients with light chain cast nephropathy and AKI requiring dialysis: commentary. Kidney360 2023; 4(8): 1027-9 8 Anand S et al.: Light-chain (AL) amyloidosis for nephrologists-treatment standard. Nephrol Dial Transplant 2024; 40(1): 34-47 9 Kastritis E et al.: Daratumumab-based treatment for immunoglobulin light-chain amyloidosis. N Engl J Med 2021; 385(1): 46-58 10 Cassano Cassano R et al.: Light chain deposition disease: pathogenesis, clinical characteristics and treatment strategies. Ann Hematol 2024 11 Batko K et al.: The clinical implication of monoclonal gammopathies: monoclonal gammopathy of undetermined significance and of renal significance. Nephrol Dial Transplant 2019; 34(9): 1440-52 12 Klank D et al.: Histological findings in kidney biopsies of patients with monoclonal gammopathy – always a surprise. Diagnostics (Basel) 2022; 12(8): 1912
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...