Nicht nur beim Melanom: Checkpoint-Inhibitoren in der Dermatoonkologie
Bericht: Reno Barth
Die Einführung der Checkpoint-Inhibitoren hat die therapeutischen Optionen beim malignen Melanom erheblich bereichert. Mittlerweile wird diese Substanzgruppe auch zunehmend bei anderen Hauttumoren eingesetzt, wie in mehreren Sitzungen des diesjährigen Kongresses der European Association of Dermato Oncology (EADO) berichtet. Der Kongress fand gemeinsam mit dem World Congress of Melanoma in diesem Jahr virtuell statt.
Auch das Basalzellkarzinom ist mittlerweile, wie Prof. Dr. med. Ralf Gutzmer von der Medizinischen Hochschule Hannover ausführt, unter bestimmten Umständen eine Indikation für die Therapie mit einem Checkpoint-Inhibitor. Zwar sind diese Hauttumoren meist gut lokal therapierbar, doch suchen manche Patienten so spät den Arzt auf, dass der bereits weit fortgeschrittene Tumor chirurgisch oder mit Bestrahlung nicht mehr kontrollierbar ist. Hedgehog-Inhibitoren sind aktuell die einzige zugelassene und empfohlene Therapie in dieser Situation. Spricht der Patient nicht darauf an, bleiben derzeit nur experimentelle Therapien.
Vieles spricht in dieser Situation für den Einsatz von Checkpoint-Inhibitoren. So zeigt das Basalzellkarzinom eine erhebliche Mutationslast (TMB) und spricht auch auf topische Immuntherapien wie Imiquimod an. Weiters werden häufig tumorinfiltrierende Lymphozyten und PD-L1-/PD-1-Expression beobachtet. Diese Überlegungen werden mittlerweile auch durch klinische Daten gestützt. So zeigten zunächst kleine Fallserien, dass mit Checkpoint-Inhibitoren bei einem hohen Prozentsatz der Patienten zumindest partielle Remissionen oder eine Stabilisierung der Erkrankung erreicht werden können. Allerdings würden prospektive Daten dringend benötigt, so Gutzmer.
Diese wurden erstmals auf dem Jahreskongress der ESMO (European Society of Medical Oncology) 2020 für den PD-1-Inhibitor Cemiplimab in Form einer Phase-II-Studie an Patienten mit lokal fortgeschrittenem Basalzellkarzinom, bei denen es unter Therapie mit einem Hedgehog-Inhibitor zum Progress gekommen war, präsentiert.1
In die Studie waren 84 Patienten eingeschlossen, die 350mg Cemiplimab i.v. alle drei Wochen bis zur Progression erhielten. Primärer Endpunkt war die Ansprechrate. Diese fiel mit 31% (n=26, davon fünf komplette Remissionen) zwar nicht allzu hoch aus, Gutzmer weist jedoch auf die mit 41% relativ hohe Zahl an Krankheitsstabilisierungen hin. Da verzögertes Ansprechen bei Checkpoint-Inhibitoren bekannt ist, besteht die Chance, dass einige dieser Patienten noch in die Gruppe der Responder wechseln. Auch erwiesen sich – wie bei Checkpoint-Inhibitoren so oft – einmal erreichte Remissionen als sehr stabil. Auch Daten zum Einsatz von Cemiplimab beim metastasierten Basalzellkarzinom wurden mittlerweile präsentiert. Sie zeigen ein partielles Ansprechen bei 21% der Patienten, wobei es sich überwiegend um stabiles Ansprechen handelt.2 Es seien weitere Auswertungen dieser Studien abzuwarten, um den möglichen Stellenwert von Cemiplimab beim Basalzellkarzinom bewerten zu können, so Gutzmer. Eine Vorbehandlung könnte sich eher günstig auswirken. So zeigen etwas ältere Daten bereits, dass es unter Therapie mit Hedgehog-Inhibitoren zu einer Intensivierung des PD-1-Stainings kommt.3 Hedgehog-Inhibitoren dürften also proinflammatorische Effekte haben. Gutzmer geht jedoch davon aus, dass die Checkpoint-Inhibitoren auf Basis dieser Daten rasch Eingang in die klinische Routinebehandlung des fortgeschrittenen Basalzellkarzinoms finden werden. Die FDA (Federal Drug Administration) hat kürzlich in den USA die Zulassung für diese Indikation erteilt und auch in Europa sei es möglich, anhand dieser Daten in Einzelfällen eine Erstattung bewilligt zu bekommen, so Gutzmer. Wünschenswert wären Biomarker, die die Prädiktion eines Ansprechens auf eine Immuntherapie ermöglichen. In den Studien zu Cemiplimab beim Basalzellkarzinom hing das Ansprechen jedenfalls nicht von der PD-L1-Expression im Tumor ab.
Merkelzellkarzinom: virale Genese und schlechte Prognose
Das Merkelzellkarzinom ist ein seltener, aber aggressiver Hauttumor, von dem besonders ältere sowie immunsupprimierte Personen betroffen sind, wobei es sich, so Prof. Dr. med. Jürgen C. Becker vom Westdeutschen Tumorzentrum Essen, sowohl um iatrogene Immunsuppression z.B. nach Organtransplantation als auch um eine Beeinträchtigung des Immunsystems infolge hämatologischer Erkrankungen handeln kann. UV-Exposition ist ein weiterer Risikofaktor. Die Inzidenz des Merkelzellkarzinoms ist stärker mit dem geografischen Längengrad assoziiert als jene des Melanoms.4
Allerdings sind UV-assoziierte genetische Alterationen nicht der einzige Treiber in der Genese des Merkelzellkarzinoms. Vielmehr ist in der Mehrzahl der Fälle eine klonale Integration des Merkelzell-Polyomavirus (MCPyV) in das Wirtsgenom von Bedeutung. Dabei sei nach wie vor nicht geklärt, von welchen Zellen das Merkelzellkarzinom ausgeht, so Becker. Diskutiert werden unter anderem Stammzellen der Epidermis und der Haarfollikel. Die Merkelzellen, langsam adaptierende Mechanorezeptoren der Haut, sind es nach aktuellem Wissensstand jedenfalls nicht.
Allerdings sind nicht alle Merkelzellkarzinome MCPyV-positiv und es scheint auch rein UV-induzierte Merkelzellkarzinome zu geben. Die beiden Tumorformen weisen kaum unterscheidbare Phänotypen auf und sind beide in hohem Mass immunogen, was ein gutes Ansprechen auf Checkpoint-Inhibitoren nahelegt. Das Merkelzellkarzinom schreitet in Stadien vom lokal begrenzten Tumor über die regionale Progression bis zur Fernmetastasierung voran. Mit jedem Progressionsschritt wird die Prognose schlechter. Für den ungünstigsten Fall, ein nicht resektables, metastasiertes Merkelzellkarzinom, konnten in klinischen Studien mit den PD-1- bzw. PD-L1-Inhibitoren Pembrolizumab, Nivolumab und Avelumab Ansprechraten von 50 bis 70% in der First und 30 bzw. 50% in der Second Line erreicht werden.5,6 Becker betonte, dass es sich in vielen Fällen um ein anhaltend stabiles Ansprechen handelt. Diesbezüglich sind die Checkpoint-Inhibitoren zwar der Chemotherapie überlegen, jedoch unterstrich Becker, dass die Erfolge weniger dauerhaft sein dürften, als das bei anderen Tumoren beobachtet wird. Der Therapieerfolg erwies sich bislang als weder mit dem MCPyV-Status noch mit der PD-L1-Expression assoziiert. Es braucht daher unbedingt Biomarker als Prädiktoren für ein Ansprechen. Resistenzen gegenüber der Therapie können sowohl primär als auch sekundär auftreten. Von einer sekundären Resistenz sind 30 bis 40% der primären Responder betroffen, wobei die Resistenz bei 80% der Betroffenen bereits im ersten Jahr nach der Behandlung auftritt.5 Dies geschieht insbesondere nach dem Absetzen des Checkpoint-Inhibitors, wobei mit einer Wiederaufnahme der Therapie auch ein neuerliches Ansprechen erreicht werden kann. Eine Immunsuppression hat sich im klinischen Alltag als ungünstiger Prädiktor erwiesen. Im Gegensatz dazu sind die Chancen auf ein Ansprechen erhöht, wenn eine geringere Zahl an von Metastasierung betroffenen Organsystemen vorliegt.
Checkpoint-Inhibitoren im adjuvanten und neoadjuvanten Setting
Zunehmend findet die Immuntherapie mit Checkpoint-Inhibitoren auch im adjuvanten oder neoadjuvanten Setting beim lokal fortgeschrittenen Merkelzellkarzinom Anwendung, wie Prof. Dr. med. Mahtab Samimi vom Universitätsspital Tours in Frankreich ausführt. Der Bedarf ist hoch, da eine rein chirurgische Therapie inklusive Dissektion der Lymphbahn und bei Bedarf Strahlentherapie in diesem Stadium der Erkrankung mit einer 5-Jahres-Überlebens-Rate von lediglich 30% assoziiert ist und zum Zeitpunkt der Behandlung häufig bereits eine Mikrometastasierung besteht. An adjuvanten Optionen stehen Chemo- und Immuntherapie zur Verfügung. Zur Wirksamkeit der Chemotherapie fehlen jedoch prospektive Studien. Die verfügbaren retrospektiven Daten zeigen einen geringen Überlebensvorteil in den Stadien 1 und 2, aber keinen Vorteil im Stadium 3.7 Daher besteht aktuell keine Empfehlung für eine adjuvante Chemotherapie.
Was die Immuntherapie angeht, bestehe die Hoffnung, so Samimi, dass die Patienten profitieren, wenn Checkpoint-Inhibitoren nicht erst beim metastasierten Tumor, sondern bereits in früheren Stadien der Erkrankung eingesetzt würden. Dahinter steht einerseits die Rationale, Mikrometastasen kontrollieren zu können, andererseits erwartet man sich aber vom früheren Einsatz auch eine bessere Wirksamkeit und Verträglichkeit, da die Patienten zu diesem Zeitpunkt in einem besseren Allgemeinzustand sind und meist auch eine kompetentere Immunantwort aufweisen. Aktuell werden mehrere Studien mit unterschiedlichen Checkpoint-Inhibitoren durchgeführt. Daten werden in den kommenden Jahren sukzessive präsentiert werden. Bislang liegen nur Ergebnisse aus einer kleinen Studie mit Ipilimumab vor, die jedoch keinen Vorteil für die Immuntherapie zeigen konnte.8
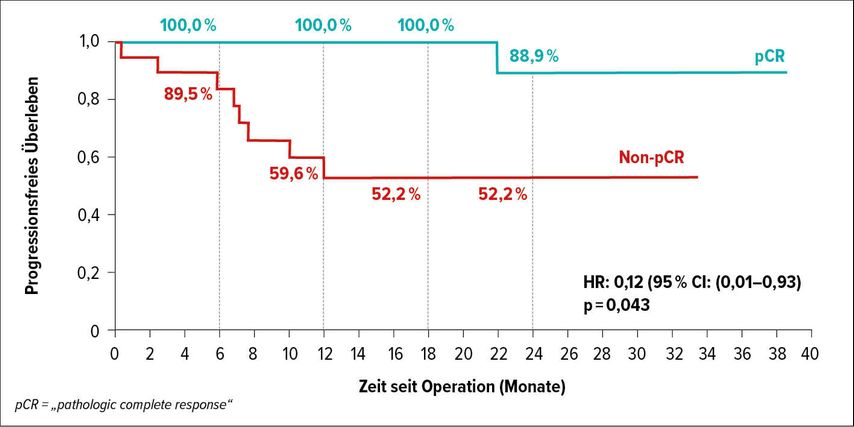
Bereits jetzt stelle sich jedoch die Frage, ob ein neoadjuvantes Vorgehen, das die Tumorlast bereits vor dem chirurgischen Eingriff reduziert, der adjuvanten Strategie nicht vorzuziehen wäre. Fallberichte, die auf ein besseres chirurgisches Outcome nach neoadjuvanter Chemotherapie hinweisen, wurden publiziert. Samimi bezweifelt jedoch, dass sich auf diesem Weg die langfristige Prognose verbessern lässt. Im Gegensatz dazu spricht vieles für eine neoadjuvante Therapie mit Checkpoint-Inhibitoren. So haben Operationen generell einen immunsuppressiven Effekt, was in der adjuvanten Situation dem Wirkmechanismus der Immuntherapien entgegenwirkt. Darüber hinaus ist nach der OP die Tumorlast sehr gering, was ebenfalls die Interaktion der Therapie mit Immunsystem und Tumor behindert. Erste Studiendaten gibt es aus der Studie CheckMate 358, die Nivolumab im neoadjuvanten Setting beim resezierbaren Merkelzellkarzinom untersuchte. In dieser Phase-I/II-Studie führte die Therapie mit Nivolumab bei rund der Hälfte der Patienten zum kompletten pathologischen Ansprechen, was bedeutet, dass im resezierten Gewebe kein Tumor nachweisbar war. Bei der grossen Mehrzahl der Patienten wurde eine Reduktion des Tumorvolumens beobachtet. Mit einer Beobachtungszeit von 20,3 Monaten war das Ansprechen auf die neoadjuvante Therapie mit dem rezidivfreien Überleben assoziiert. Das mediane rezidivfreie Überleben sowie das mediane Gesamtüberleben waren zum Beobachtungszeitpunkt nicht erreicht. Innerhalb von 22 Monaten kam es bei keinem Patienten mit komplettem Ansprechen zu einem Rezidiv (Abb. 1).9 Auch in CheckMate 358 wurden keine Biomarker identifiziert, die sich für eine Prädiktion des Ansprechens eignen.
Abb. 1: CheckMate 358: Ansprechen auf neoadjuvante Therapie als Prädiktor für PFS (nach Topalian et al.)9
Die unterschiedlichen Formen der Resistenz
Prof. Dr. med. Bastian Schilling von der Universität Würzburg betont, dass die Checkpoint-Inhibitoren bei vielen Patienten mit unterschiedlichen Tumoren zu langfristigen, stabilen Remissionen führen, dass jedoch auch primäre Resistenz im Sinne eines fehlenden Ansprechens sowie erworbene Resistenz im Sinne eines späteren Verlustes des Ansprechens beobachtet werden. Biomarker, die die Selektion jener Patienten erlauben, welche auf eine Immuntherapie ansprechen, werden daher dringend gesucht.
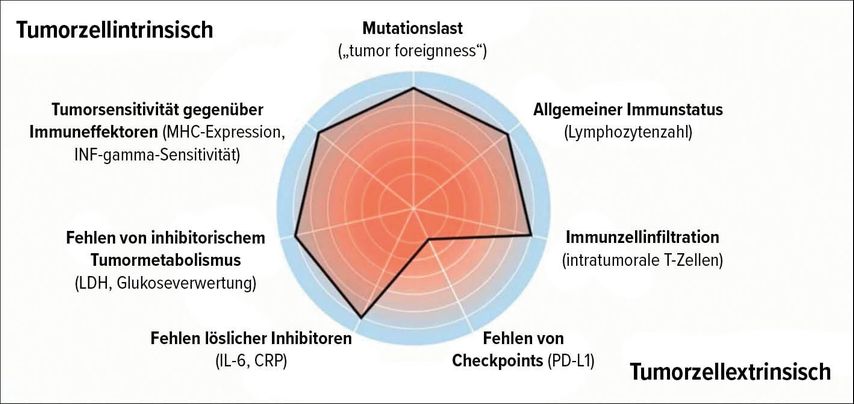
Studiendaten aus der Studie CheckMate 067 zeigen, dass die primäre Resistenz gegenüber Checkpoint-Inhibitoren das grössere Problem darstellt, während jene Patienten, die einmal auf eine Immuntherapie angesprochen haben, meist ein sehr stabiles Ansprechen zeigen.10 Als Ursachen für die primäre Resistenz kommen einerseits tumorintrinsische Faktoren wie bestimmte Onkogene und andererseits tumorextrinsische Faktoren zum Tragen. Diese wurden vor einigen Jahren im sogenannten «Cancer Immunogram» zusammengefasst (Abb. 2).11
Eine Determinante in diesem Konzept ist die Expression von PD-L1. Schilling: «Wenn wir einen Pathway blockieren und dieser Pathway bei dem konkreten Patienten keine Rolle spielt, dann wird die Blockade nicht zur Remission der Erkrankung führen.» Tatsächlich ist eine Assoziation der PD-L1-Expression mit dem Ansprechen auf eine PD-1-Blockade dokumentiert.12 Allerdings ist diese Assoziation nicht so stark, wie man annehmen könnte, und bei Weitem nicht alle Patienten mit PD-L1-Expression sprechen auf die Therapie mit PD-1-Inhibitoren an. Das Gleiche gelte für andere Checkpoints, so Schilling.
Ein weiterer wichtiger Faktor ist die Reaktion des Tumors auf Interferone. Diese spielen eine wichtige Rolle in der Signalübertragung, sobald eine T-Zelle mit einer Tumorzelle in Kontakt kommt. Bei Patienten mit Resistenz gegen Checkpoint-Inhibitoren konnte nachgewiesen werden, dass Mutationen im Tumor, die zur Resistenz gegenüber Interferon-gamma führen, hier eine wichtige Rolle spielen.13 Betroffen ist hier beispielsweise der JAK-STAT-Signalweg.
Ebenso ist die Mutationslast («tumor foreignness») wichtig für die Wirksamkeit von Immuntherapien. Kohortenanalysen von Melanompatienten zeigen, dass Patienten mit hoher Mutationslast etwas besser auf Checkpoint-Inhibitoren ansprechen.14 Deutlichere Assoziationen wurden jedoch zwischen dem Ansprechen auf eine Immuntherapie und verschiedenen Faktoren im peripheren Blut («soluble factors») gefunden. So erwiesen sich erhöhte Spiegel von Laktatdehydrogenase (LDH) als ungünstiger prognostischer Marker. Mehrere solcher Marker können zu einem Score kombiniert werden, wobei eine niedrige Zahl günstiger Faktoren mit sehr geringen Chancen auf Ansprechen assoziiert ist.15 Letztlich sei geboten, möglichst viele dieser Faktoren kombiniert zu betrachten. Schilling verweist auf eine Kohortenstudie mit 144 Patienten, deren Melanome vor der Exzision einer kompletten Exom- und Transkriptom-Sequenzierung unterzogen wurden.16 Die Daten zeigen u.a., dass die Rolle der Mutationslast aufgrund starker Störfaktoren weniger bedeutsam sein dürfte als zuvor angenommen. Gleichzeitig zeigen die Daten, dass Gene, die mit der Antigenpräsentation zu tun haben, sowie Mutationen im JAK-STAT-Signalweg einen wichtigen Einfluss auf das Ansprechen auf Checkpoint-Inhibitoren haben. Durch Kombination mehrerer Faktoren können Ansprechen und Risiko von Resistenzen mit einiger Sicherheit modelliert werden.16 Schilling betont jedoch, dass die Abschätzung der Chancen auf Ansprechen im klinischen Alltag nur von begrenzter Relevanz ist, da die meisten Patienten von dieser Therapie profitieren und es in den meisten Fällen auch keine Alternativen gibt.
Quelle:
17th EADO Congress, 15.–17. April, virtuell
Literatur:
1 Stratigos A et al.: ESMO-Kongress 2020, Abstr. #LBA47 2 Lewis K et al.: Journal for ImmunoTherapy of Cancer 2020; 8(Suppl 3): A260-1 3 Chang J et al.: JAMA Dermatol 2017; 153(4): 285-90 4 Stang A et al.: Eur J Cancer 2018; 94: 47-60 5 Nghiem P et al.: N Engl J Med 2016; 374(26): 2542-52 6 Kaufman HL et al.: Lancet Oncol 2016; 17(10): 1374-85 7 Bhatia S et al.: J Natl Cancer Inst 2016; 108(9): djw042 8 Becker J et al.: ASCO-Kongress 2018; Abstr. #9527 9 Topalian SL et al.: J Clin Oncol 2020; 38(22): 2476-87 10 Larkin J et al.: N Engl J Med 2019; 381(16): 1535-46 11 Blank CU et al.: Science 2016; 352(6286): 658-60 12 Daud A et al.: J Clin Oncol 2016; 34(34): 4102-9 13 Shin D et al.: Cancer Discov 2017; 7(2): 188-201 14 Cristescu R et al.: Science 2018; 362(6411): eaar359315 Martens A et al.: Clin Cancer Res 2016; 22(12): 2908-18 16 Liu D et al.: Nat Med 2019; 25(12): 1916-27
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...