„Nicht nur melanozytärer Hautkrebs“
Bericht:
Dipl.-Ing. Dr. Manuel Spalt-Zoidl
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die Behandlung maligner Hauterkrankungen stellt, bedingt durch ihre große Bandbreite und Heterogenität, eine Herausforderung im Therapiefeld der Dermatoonkologie dar. In der ersten Fortbildungsveranstaltung der Arbeitsgruppe Melanom und dermatologische Onkologie der ÖGDV berichteten Prof. Dr. Rainer Kunstfeld, Wien, und Prof. Dr. Reinhard Dummer, Zürich, über die Hintergründe dieser Krankheitsbilder und die Fortschritte in deren Behandlung.
Keypoints
-
Die chirurgische Entfernung stellt weiterhin den Goldstandard in der Behandlung des nichtmelanozytären Hautkrebses (NMSC) dar.
-
PD-1-Inhibitoren wie Cemiplimab zeigen vielversprechende Wirksamkeit in fortgeschrittenen Stadien des NMSC.
-
Kombinationen aus Immuncheckpoint- und zielgerichteten Therapien verlängern signifikant das Überleben bei fortgeschrittenem Melanom.
-
Trotz innovativer adjuvanter und neoadjuvanter Ansätze bleiben belastbare Langzeitüberlebensdaten bisher aus.
-
Die wachsende Zahl therapeutischer Optionen erfordert eine personalisierte Auswahl, um dem individuellen Krankheitsverlauf gerecht zu werden.
PD-1-Inhibition bei fortgeschrittenem weißem Hautkrebs
Der nichtmelanozytäre Hautkrebs (NMSC), auch bekannt als weißer Hautkrebs, ist die häufigste Krebserkrankung beim Menschen. NMSC umfasst ein breites Spektrum, von der aktinischen Keratose über alle Formen des kutanen Plattenepithelkarzinoms (SCC) bis hin zum Basalzellkarzinom (BCC), berichtet Univ.-Prof. Dr. Rainer Kunstfeld, Universitätsklinik für Dermatologie, MedUni/AKH Wien. Die aktinische Keratose stellt häufig einen Vorläufer des invasiven SCC dar.1
Der Goldstandard zur Behandlung des BCC und des kutanen SCC ist die vollständige chirurgische Exzision des Tumors, so Prof. Kunstfeld. Dies sei in weit fortgeschrittenen oder metastasierten Stadien allerdings nicht mehr möglich. In der Vergangenheit waren Chemotherapien die einzige Option, fortgeschrittene Krankheitsstadien zu behandeln. Im Median überlebten Patient:innen mit lokal fortgeschrittenem oder metastasiertem SCC allerdings nur 15,3 Monate (95%-KI: 10,4–21).2
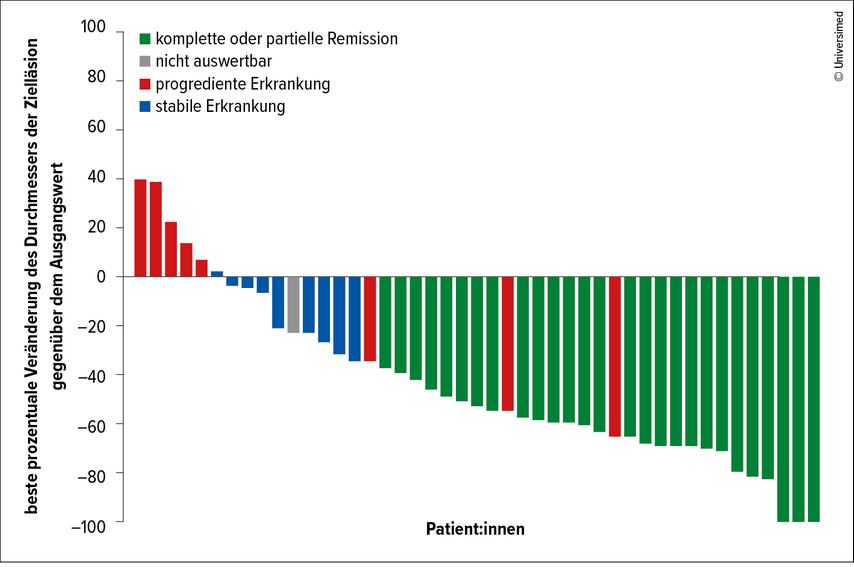
Heute stehen Dermatoonkolog:innen weitaus wirksamere Therapieoptionen zur Verfügung. Dank der hohen Mutationslast von weißem Hautkrebs spricht dieser sehr gut auf Immuntherapien an. So zeigte beispielsweise der PD-1-Inhibitor Cemiplimab in einer Kohorte von vorbehandelten Patient:innen mit weit fortgeschrittenem oder metastasiertem SCC eine Gesamtansprechrate (ORR) von 47% (95%-KI: 34–61). Ein Großteil der Patient:innen erreichte dabei eine komplette oder teilweise Remission ihres SCC (Abb. 1).3
Abb. 1: Beste Tumoransprechraten bei 45 Patient:innen, deren fortgeschrittenes SCC mit Cemiplimab behandelt wurde (modifiziert nach Midgen MR et al.)3
Auch bei der Behandlung des lokal fortgeschrittenen oder metastasierten BCC erreichte Cemiplimab bei Patient:innen, deren Erkrankung während der Behandlung mit einem Hedgehog-Signalweg-Inhibitor fortgeschritten war oder die diesen nicht vertragen hatten, eine ORR von 32% (95%-KI: 22–43) beziehungsweise 22% (95%-KI: 12–36).4, 5
Melanome: Heterogenität und adaptive Fähigkeiten als Erschwernisse in der Therapie
Die Behandlung und erfolgreiche Therapie von Melanomen stellen eine komplexe Herausforderung im Therapiefeld der Dermatoonkologie dar, berichtet Prof. Dr. Reinhard Dummer, emeritierter stellvertretender Klinikdirektor der dermatologischen Klinik, Universitätsspital Zürich. Als Hauptgrund dafür nennt er die Heterogenität dieser malignen Hauterkrankungen. Diese Heterogenität entsteht hauptsächlich durch die adaptiven Fähigkeiten und die transkriptionelle Plastizität von Melanomen, wie sie sonst nur bei Stammzellen bekannt sind. Zusätzlich wird die Heterogenität durch zahlreiche Treibermutationen erhöht.
Prof. Dummer betont, dass die Forschung zur Behandlung von Melanomen in den letzten Jahren große Fortschritte gemacht hat. In der Vergangenheit waren Fallberichte und retrospektive Analysen die vorherrschenden Datenquellen. Heute werden große, prospektive, randomisierte Studien durchgeführt. Diese liefern konsistente Langzeitergebnisse mit hoher Qualität und erlauben es, verlässliche Aussagen für Patient:innen zu treffen. Für Prof. Dummer nimmt die aktive Deeskalation einen hohen Stellenwert ein. Da jeder Eingriff, ob chirurgisch oder systemisch, Risiken birgt und mit Schmerzen und Kosten einhergeht, stellt er die Frage, auf welche Behandlungsschritte ohne Qualitätseinbußen verzichtet werden kann.
Immuntherapie des fortgeschrittenen Melanoms
Ähnlich wie das kutane SCC sprechen auch Melanome hervorragend auf Immuntherapien an. Beispielsweise erreichten Patient:innen mit fortgeschrittenen Melanomen, die mit dem PD-1-Inhibitor Nivolumab in Kombination mit Ipilimumab behandelt wurden, ein medianes Gesamtüberleben (OS) von 71,9 Monaten, verglichen mit 19,9 Monaten mit Ipilimumab allein. Dies entspricht einer HR nach zehn Jahren von 0,53 (95%-KI: 0,44–0,65).6
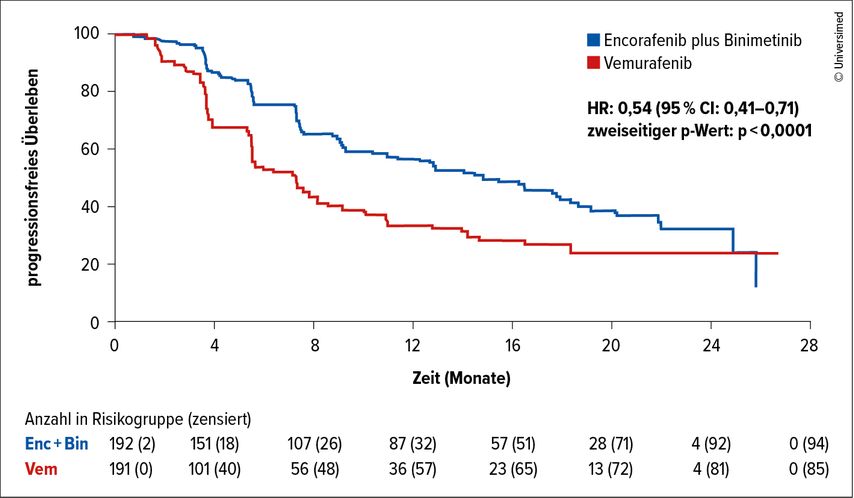
Das Verständnis für die Heterogenität von Melanomen und der zugrunde liegenden Biologie nimmt eine Schlüsselrolle in deren effektiver Behandlung und bei potenziellen Deeskalationsstrategien ein. So erreichten etwa Patient:innen mit BRAFV600-mutierten fortgeschrittenen Melanomen mit der Kombination der BRAF- und MEK-Inhibitoren Encorafenib und Binimetinib ein medianes progressionsfreies Überleben (PFS) von 14,9 Monaten (95%-KI: 11,0–18,5) im Vergleich zu 7,4 Monaten (95%-KI: 5,6–8,2) mit Vemurafenib allein (Abb. 2).7 Nach sieben Jahren betrugen die OS-Raten 27,4% (95%-KI: 21,2–33,9) für die Kombinationstherapie und 18,2% (95%-KI: 12,8–24,3) für die Monotherapie.8
Abb. 2: Kaplan-Meier-Plot der Behandlungsgruppen mit Encorafenib plus Binimetinib und Vemurafenib bei Patient:innen mit BRAFV600-mutierten, fortgeschrittenen Melanomen (modifiziert nach Dummer R et al.)7
Ergebnisse im adjuvanten Setting bislang eher enttäuschend
Ausgehend von den überzeugenden Studiendaten zu BRAFV600-mutierten fortgeschrittenen Melanomen sind die Langzeitüberlebensdaten mit der adjuvanten Therapie eher enttäuschend, berichtete Prof. Dummer. So waren 86% der Patient:innen, die eine Kombination aus Dabrafenib und Trametinib zur adjuvanten Behandlung des BRAFV600-mutierten Melanoms erhielten, nach drei Jahren noch am Leben. In der Placebogruppe überlebten 77%.9 Nach zehn Jahren war der Unterschied zwischen Verum und Placebo jedoch nicht länger signifikant. Nach diesem Zeitraum waren in der Verumgruppe 71% und in der Placebogruppe 69% der Patient:innen noch am Leben.10
Um diese Ergebnisse zu erklären, unterteilten Prof. Dummer und Kolleg:innen Patient:innen aus der Studie mit Dabrafenib plus Trametinib in vier Subgruppen. Diese Subgruppen umfassten Patient:innen mit einer hohen Menge an genetischen Veränderungen, gemessen an der „tumor mutational burden“ (TMB), und einer hohen Menge an Entzündungen, gemessen am Interferon-gamma-Spiegel (INFγ), Patient:innen mit einer niedrigen TMB und niedrigem IFNγ-Spiegel und die beiden Mischgruppen. Patient:innen mit hohem IFNγ-Spiegel und niedriger TMB profitierten am meisten von der Behandlung, mit einer HR des PFS von 0,31 (95%-KI: 0,16–0,60). Patient:innen mit niedrigem IFNγ-Spiegel, aber hohem TMB erlebten dagegen einen dramatischen Abfall der Wirksamkeit, mit einer HR von 0,88 (95%-KI: 0,40–1,93).11 Diese Auswertung verdeutlicht den großen Einfluss der Heterogenität auf den Behandlungserfolg und die Notwendigkeit, auch Bio- und Serummarker sorgfältig zu untersuchen, betonte Prof. Dummer.
Neoadjuvanz als wichtiger Schritt in Deeskalationsstrategie
Prof. Dummer betrachtet die neoadjuvante Therapie als wichtigsten Schritt in der Deeskalationsstrategie für die Behandlung von Melanomen und nennt die Immuntherapie als idealen Kandidaten dafür. So zeigte etwa der PD-1-Inhibitor Pembrolizumab im perioperativen Einsatz (neoadjuvant+adjuvant)bei operablen Melanomen im Stadium III oder IV nach zwei Jahren ein „event-free survival“ (EFS) von 72% (95%-KI: 64–80). Im Vergleich dazu erreichte Pembrolizumab im adjuvanten Setting allein lediglich ein PFS von 49% (95%-KI: 41–59).12
Zugelassene Therapien und Zukunftsaussichten
Heute sind 14 Moleküle für die Behandlung von metastasierten Melanomen zugelassen. Diese Arzneimittel können auch im adjuvanten, neoadjuvanten und palliativen Setting eingesetzt werden, wodurch sich ein relativ komplexes Behandlungsschema ergibt.13 Die passende individuelle Strategie für Patient:innen zu entwickeln, wird, so Prof. Dummer, den Schlüssel für die erfolgreiche Behandlung dieser heterogenen Erkrankung darstellen.
Prof. Dummer nennt auch eine Reihe vielversprechender Therapieansätze, die gegenwärtig in klinischen Studien untersucht werden. Hier führt er die individualisierte Neoantigentherapie mit dem personalisierten Vakzin mRNA-4157 in Kombination mit Pembrolizumab an.14 Auch Tebentafusp, ein bispezifischer T-Zell-Antikörper (BiTE), wurde kürzlich zur Behandlung des metastasierten Uveamelanoms zugelassen.15 Weitere Beispiele für neue Therapieansätze umfassen Kombinationen aus LAG-3-Inhibitoren und PD-1-Inhibitoren sowie Behandlungen mit tumorinfiltrierenden Lymphozyten.16
Quelle:
1. Fortbildungsveranstaltung der Arbeitsgruppe Melanom und dermatologische Onkologie (ADMO) der Österreichischen Gesellschaft für Dermatologie und Venerologie (ÖGDV), 28.2.2025, Salzburg
Literatur:
1 Ratushny V et al.: From keratinocyte to cancer: the pathogenesis and modeling of cutaneous squamous cell carcinoma. J Clin Invest 2012; 122(2): 464-72 2 Cowey CL et al.: Clinical outcomes among unresectable, locally advanced, and metastatic cutaneous squamous cell carcinoma patients treated with systemic therapy. Cancer Med 2020; 9(20): 7381-7 3 Migden MR et al.: PD-1 blockade with cemiplimab inadvanced cutaneous squamous-cell carcinoma. N Engl J Med 2018; 379(4): 341-51 4 Stratigos AJ et al.: Phase 2 open-label, multicenter, single-arm study of cemiplimab in patients with locally advanced basal cell carcinoma after hedgehog inhibitor therapy: Extended follow-up. J Am Acad Dermatol 2024; 90(2): 414-8 5 Lewis KD et al.: Final analysis of phase II results with cemiplimab in metastatic basal cell carcinoma after hedgehog pathway inhibitors. Ann Oncol 2024; 35(2): 221-8 6 Wolchok JD et al.: Final, 10-year outcomes with nivolumab plus ipilimumab in advanced melanoma. N Engl J Med 2025; 392(1): 11-22 7 Dummer R et al.: Encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF-mutant melanoma (COLUMBUS): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2018; 19(5): 603-15 8 Schadendorf D et al.: COLUMBUS 7-year update: A randomized, open-label, phase III trial of encorafenib plus binimetinib versus vemurafenib or encorafenib in patients with BRAF V600E/K-mutant melanoma. Eur J Cancer 2024; 204: 114073 9 Long GV et al.: Adjuvant dabrafenib plus trametinib in stage III BRAF-mutated melanoma. N Engl J Med 2017; 377(19): 1813-23 10 Long GV et al.: Final results for adjuvant dabrafenib plus trametinib in stage III melanoma. N Engl J Med 2024; 391(18): 1709-20 11 Dummer R et al.: Adjuvant dabrafenib plus trametinib versus placebo in patients with resected, BRAFV600-mutant, stage III melanoma (COMBI-AD): exploratory biomarker analyses from a randomised, phase 3 trial. Lancet Oncol 2020; 21(3): 358-72 12 Patel SP et al.: Neoadjuvant-adjuvant or adjuvant-only pembrolizumab in advanced melanoma. N Engl J Med 2023; 388(9): 813-23 13 Amaral T et al.: Cutaneous melanoma: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol 2025; 36(1): 10-30 14 Weber JS et al.: Individualised neoantigen therapy mRNA-4157 (V940) plus pembrolizumab versus pembrolizumab monotherapy in resected melanoma (KEYNOTE-942): a randomised, phase 2b study. Lancet 2024; 403(10427): 632-44 15 Hassel JC et al.: Three-year overall survival with tebentafusp in metastatic uveal melanoma. N Engl J Med 2023; 389(24): 2256-66 16 Mehta A et al.: Advancements in melanoma treatment: A review of PD-1 inhibitors, T-VEC, mRNA vaccines, and tumor-infiltrating lymphocyte therapy in an evolving landscape of immunotherapy. J Clin Med 2025; 14(4): 1200
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...