New (old) kids on the block and a new block
Nach Jahren der immer wiederkehrenden PD-L1-Blockade in immer wieder neuen Indikationen ohne Biomarker sind an dem diesjährigen ASCO-Meeting neue, innovative immunmodulierende Moleküle vorgestellt worden. Somit war der ASCO 2020 für mich ein wichtiger Kongress auf dem Weg zu noch effizienteren Immuntherapien gegen Krebs.
Keypoints
-
Neue Moleküle, zielend auf OX40, TIGIT, LAG-3, und bispezifische Antikörper sind klinisch vielversprechende Immunmodulatoren.
-
Avelumab nach einer erfolgreichen, platinhaltigen Chemotherapie beim metastasierten Urothelkarzinom ist ein neuer Therapiestandard.
-
Die Immun/Immun- oder Immunchemotherapie beim metastasierten Lungenkarzinom zeigt in unterschiedlichen Kombinationen und Therapiesequenzen Wirkung.
New (old) kids on the block in Phase I/II
Old kids
In der Session «Developmental Therapeutics» wurde wieder einmal der Versuch gestartet, überzeugende Argumente für die weitere Entwicklung von Vakzinestudien zu sammeln. Es wurden drei experimentelle Ansätze gezeigt.1–3 Es zeigen sich zusammenfassend auch am ASCO 2020 die seit Jahrzehnten bestehenden Probleme. Vakzinestudien sind immer noch in der Phase I/II; sie zeigen im besten Fall Hinweise auf immunologische Antworten; die Messung der immunologischen Antworten ist nicht standardisiert, und die klinischen Antworten sind weiterhin eher als gering anzusehen.
Eine Studie testete eine autologe Tumorzellvakzine als wiederholte, intradermale Injektionen.1 Erstaunlich, dass hier keine Kombination mit einem Checkpoint-Inhibitor oder einem Adjuvans verwendet wurde.
Eine weitere Studie nutzte einen oralen Vakzineansatz gegen VEGFR2.2 Das ist sicherlich innovativ, aber auch ein immunologisch sehr schwierig zu kontrollierender Ansatz. Patienten mit Glioblastomen wurden mit der oralen Vakzine gegen VEGFR2 und Avelumab behandelt, und es konnte ein Ansprechen bei 3 von 30 Patienten gesehen werden.
Die letzte Studie kombinierte nun mehrere immunmodulierende Ansätze.3 Es handelte sich um eine Tumorzellvakzine, die GM-CSF produziert und TGF-β möglichst in geringer Ausprägung sezerniert. Diese wurde bei Patientinnen mit Ovarialkarzinomen in Kombination mit Atezolizumab eingesetzt. Es zeigte sich, dass der vorherige alleinige Einsatz der Tumorzellvakzine, gefolgt von der Kombination Vakzine/Atezolizumab, die Wirksamkeit der Vakzine verbesserte im Vergleich zum vorherigen Einsatz von Atezolizumab, gefolgt von der Kombination.3
New kids
Meine vier persönlichen Highlights in Bezug auf neue Moleküle waren wie folgt:
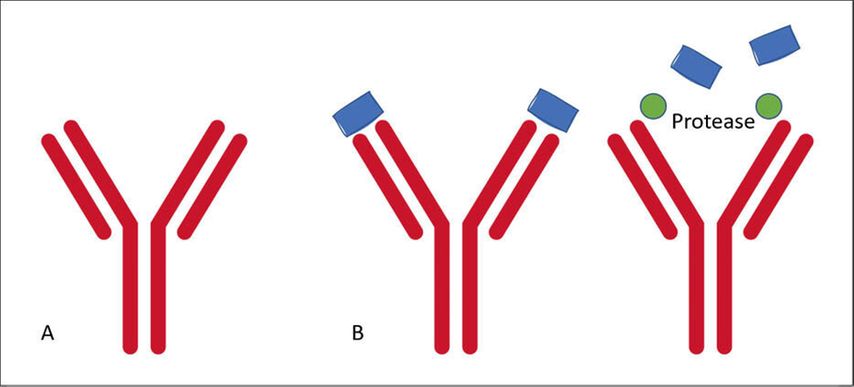
MEDI0562, ein humanisierter IgG1-agonistischer Anti-OX40-Antikörper, wurde mit den Checkpoint-Inhibitoren Durvalumab (Anti-PD-L1) oder Tremelimumab (Anti-CTLA4) getestet.4 Agonistische Antikörper simulieren einen natürlichen Liganden und geben somit ein aktivierendes Signal (Abb. 1A). Das steht im Gegensatz zu den bis jetzt benutzten antagonistischen Checkpoint-Inhibitoren und stellt somit eine neue Klasse an Immunmodulatoren dar. OX40 ist ein interessanter Rezeptor, der auf aktivierten T-Zellen exprimiert wird. Seine Stimulation führt zu einem verbesserten Überleben von aktivierten T-Zellen. Die Studie zeigte einen Anstieg Ki67-positiver, aktivierter T-Zellen nach Verabreichung von MEDI0562 und gab so einen Hinweis auf die Wirksamkeit dieses Ansatzes. Die optimale Sequenz und Kombination mit anderen Checkpoint-Inhibitoren müssen aber noch erarbeitet werden.
Abb. 1: A: agonistischer, humanisierter IgG1-anti-OX40-Antikörper; B: antagonistischer PD-L1 Probody CX-072, links inaktiv, rechts durch Protease aus dem Tumorgewebe aktiviert
Ein Problem von Checkpoint-Inhibitoren ist das autoimmune Wirkungsprofil in gesunden Geweben. Um dieses Problem zu adressieren, wurde der Probody CX-072 getestet.5 Ziel eines Probodys ist es, seine Wirkung nur im Zielgewebe zu entfalten, also nur im Tumorgewebe. Hierfür wurde ein PD-L1-Antikörper so verändert, dass er an PD-1 nur binden kann, nachdem Proteasen des Tumorgewebes den Antikörper aktiviert haben (Abb. 1B).
Ziel eines solchen Ansatzes ist es, Kombinationstherapien zu ermöglichen, die ansonsten zu viele Nebenwirkungen hätten. Die Studie verwendete den Probody CX-072 als Monotherapie und in Kombination mit Ipilimumab (Anti-CTLA4). Der Einsatz von CX-072 zeigte die für eine Phase-I-Studie übliche Wirksamkeit mit einer Ansprechrate von ca. 30% und somit die prinzipielle klinische Funktionalität des Moleküls.
Eine aus meiner Sicht in den nächsten Jahren sehr wichtig werdende Substanzklasse sind die bispezifischen Antikörper. Diese Moleküle können an zwei verschiedene Rezeptoren binden und somit neue und komplexere Immunmodulationen auslösen (Abb. 2).
MGD013 bindet als antagonistischer Antikörper und blockiert PD-1 und LAG-3.6 LAG-3 ist ebenfalls ein immunologischer Checkpoint auf T-Zellen; somit blockiert MGD013 gleichzeitig zwei Checkpoints. Das Nebenwirkungsprofil war vergleichbar mit jenem aus bekannten Studien, die einen Checkpoint-Inhibitor verwendet haben, und es gab keine neuen aussergewöhnlichen Nebenwirkungen. Das Ansprechen als Monotherapie lag bei 10% (TNBC, NSCLC, EOS).
Für die Lunge wurde in der ersten Linie ein Anti-TIGIT-Antikörper in Kombination mit Atezolizumab (Anti-PD-L1) vorgestellt.7 Auch TIGIT ist ein Immuncheckpoint. In einer randomisierten Phase-II-Studie wurden 135 Patienten mit Tiragolumab, einem antagonistischen IgG1-Antikörper gegen TIGIT, oder Placebo und Atezolizumab behandelt. Es zeigte sich für die Kombination ein PFS von 5,5 Monaten im Vergleich zu Atezolizumab mit 3,8 Monaten. Die ORR lag bei 37% für die Kombination versus 21% für den alleinigen Einsatz von Atezolizumab. Besonders gross war der therapeutische Effekt in der Gruppe von Patienten, deren Tumoren >50% PD-L1 exprimierten.
A new block beim Urothelkarzinom
Die JAVELIN-Bladder-100-Phase-III-Studie, präsentiert von Tom Powles in einer Plenary Session des ASCO, war sicherlich klinisch ein Highlight in Bezug auf die PD-L1-Blockade.8 In dieser Studie wurde Avelumab, ein PD-L1-blockierender IgG1-Antikörper, in einer für das metastasierte Urothelkarzinom neuen Therapiesituation getestet. In der Studie wurden zunächst alle Patienten mit einer Chemotherapie mit Cisplatin/Carboplatin und Gemcitabin behandelt. Dann kam die eigentliche Randomisierung in zwei Gruppen mit je 350 Patienten, aber nur für die Patienten, die auf die Therapie mit Cisplatin/Carboplatin und Gemcitabin eine «stable disease» oder ein Ansprechen gezeigt hatten. Eine Gruppe erhielt «best supportive care», was in dieser Situation heisst, dass eine alleinige Behandlung von Symptomen bis zur Progression und dem Einsatz einer weiteren palliativen Systemtherapie durchgeführt wurde. Der experimentelle Arm erhielt hier in dieser Zeit eine Therapie mit Avelumab. Man kann sich nun streiten, ob dies als Erhaltungstherapie oder frühe Zweitlinientherapie zu bezeichnen ist.
Die Studie konnte klar zeigen, dass der frühe Einsatz von Avelumab nach der Chemotherapie zu einem signifikant verlängerten Überleben geführt hat (medianes OS mit Avelumab + BSC vs. BSC alleine war 21,4 vs. 14,3 Monate). Dieser Vorteil war in allen vordefinierten Subgruppen zu sehen und ist somit ein überzeugendes Argument für den frühen Einsatz von Avelumab in dieser klinischen Situation.
Dieses Ergebnis ist interessant im Kontext der IMvigor130-Studie, die am ESMO-Kongress 2019 gezeigt wurde.9 Hier wurde Atezolizumab, ebenfalls ein PD-L1-blockierender Antikörper, in Kombination mit Cisplatin/Carboplatin und Gemcitabin in sofortiger Kombination beim metastasierten Urothelkarzinom getestet. Es konnte hier kein statistisch signifikanter Vorteil für den Einsatz von Atezolizumab in Bezug auf das Gesamtüberleben gezeigt werden (medianes OS mit Atezolizumab + Platinum/Gem vs. Placebo/Platin/Gem alleine war 15,7 vs. 13,1 Monate). Somit stellt sich die Frage, ob nicht das Ansprechen auf eine platinhaltige Erstlinientherapie ein prädiktiver Marker für das Ansprechen auf eine Checkpoint-Blockade sein könnte. Der immunologische Mechanismus ist wohl unbekannt, aber es könnte spekuliert werden, dass ein klinisches Ansprechen auf die platinhaltige Therapie das Tumorgewebe so verändert, dass eine therapeutische Immunantwort möglich wird. Zum Beispiel ist Gemcitabin durch experimentelle Daten bekannt dafür, dass es immunsuppressive myeloische Zellen abtötet. Ausserdem kann es die Expression von Tumorantigenen auf Tumorzellen unterstützen und verändern. Das sequenzielle Timing in der JAVELIN-100-Studie könnte hier der Schlüssel zum Erfolg gewesen sein.
Same, same, new, old story beimLungenkrebs
Für die Lunge wurden die Dreijahres-Überlebensdaten von CheckMate-227, Part 1, gezeigt.10 Hier zeigt sich weiter ein OS-Vorteil für die Kombinationstherapie aus Ipilimumab und Nivolumab gegenüber einer Chemotherapie bei der Erstlinienbehandlung des metastasierten NSCLC ohne Drivermutationen (33% vs. 22% für PD-L1 >1%). Mir persönlich scheint diese Kombination eine gute klinische Option bei Patienten zu sein, bei denen man keine Chemotherapie einsetzen kann oder möchte, da auch ein Vorteil nach drei Jahren besteht, auch wenn PD-L1 <1% exprimiert wird (34% vs. 15%).
CheckMate-9LA ist für mich schwierig einzuordnen, insbesondere die klinische Verortung der Anwendung im Alltag ist komplex.11 Es handelt sich um eine Phase-III-Studie, die randomisiert den Einsatz von zwei Zyklen platinhaltiger Chemotherapie in Kombination mit Ipilimumab und Nivolumab gegen die alleinige Chemotherapie (4 Zyklen) in der Erstlinie beim metastasierten NSCLC testet. Konzeptionell ist dieser Ansatz sicher klinisch und immunologisch interessant. So kann postuliert werden, dass Patienten, deren Tumoren eine sofortige Chemotherapie benötigen, diese bekommen und somit ein klinisch wichtiger erster Effekt gegen den Tumor möglich ist. Immunologisch kann der Chemotherapie-induzierte Zelltod der Tumorzellen einem Priming einer therapeutischen Immunantwort eventuell helfen. Das Gesamtüberleben verlängerte sich auch statistisch signifikant von 10,7 auf 14,1 Monate durch die Immunchemotherapie.
Im Kontext mit KEYNOTE-189 stellt sich nun die Frage, ob CheckMate-9LA einen klinischen Vorteil bringt. Der Chemotherapiearm von KEYNOTE-189 zeigte ein medianes Überleben von 11,3 Monaten und war somit vergleichbar mit CheckMate-9LA.12 Zum Zeitpunkt der Publikation war das mediane Überleben in KEYNOTE-189 im Immunchemotherapiearm (Pembrolizumab plus Chemotherapie) noch nicht erreicht. CheckMate-9LA bietet somit eventuell eine klinische Möglichkeit, gezielt mit nur zwei Zyklen Chemotherapie in eine Erstlinientherapie beim NSCLC ohne Drivermutation zu starten.
Dass das Konzept Immunchemotherapie nicht immer zu einer Verbesserung des Gesamtüberlebens führt, zeigt die CCTG-BR.34-Studie.13 Die Kombination von Durvalumab mit Tremelimumab (DT) zeigte mit oder ohne platinhaltige Chemotherapie ein ähnliches Gesamtüberleben (16,6 vs. 14,1 Monate).
Literatur:
1 Marcano EG et al.: Pilot study on outcome and antitumor efficacy of an autologous cancer cell vaccine applied in patients with advanced solid tumors. ASCO 2020, Abstr. #3000 2 Wick W et al.: Oral DNA vaccination targeting VEGFR2 combined with anti-PDL1 avelumab in patients with progressive glioblastoma: safety run-in results—NCT03750071. ASCO 2020, Abstr. #3001 3 Rocconi RP et al.: A phase I combination study of GMCSF/bi-shRNA(furin) DNA-transfected autologous tumor immunotherapy and atezolizumab in recurrent/refractory advanced-stage ovarian cancer: efficacy assessment in BRCA1/2-wt patients. ASCO 2020, Abstr. #3002 4 Goldman JW et al.: Safety and tolerability of MEDI0562 in combination with durvalumab or tremelimumab in patients with advanced solid tumors. ASCO 2020, Abstr. #3003 5 Thistlethwaite F et al.: PROCLAIM-CX-072: analysis of patients with advanced solid tumors receiving long-term treatment with CX-072, a PD-L1 probody therapeutic, as a single agent or in combination with ipilimumab. ASCO 2020, Abstr. #3005 6 Luke JJ et al.: A phase I, first-in-human, open-label, dose-escalation study of MGD013, a bispecific DART molecule binding PD-1 and LAG-3, in patients with unresectable or metastatic neoplasms. ASCO 2020, Abstr. #3004 7 Rodriguez-Abreu D et al.: Primary analysis of a randomized, double-blind, phase II study of the anti-TIGIT antibody tiragolumab (tira) plus atezolizumab (atezo) versus placebo plus atezo as first-line (1L) treatment in patients with PD-L1-selected NSCLC (CITYSCAPE). ASCO 2020, Abstr. #9503 8 Powles T et al.: Maintenance avelumab + best supportive care (BSC) versus BSC alone after platinum-based first-line (1L) chemotherapy in advanced urothelial carcinoma (UC): JAVELIN Bladder 100 phase III interim analysis. ASCO 2020, Abstr. #LBA1 9 Grande E et al.: IMVIGOR130: efficacy and safety from a phase 3 study of atezolizumab (ATEZO) as monotherapy or combined with platinum-based chemotherapy (PBC) vs placebo + PBC in previously untreated locally advanced or metastatic urothelial carcinoma (MUC). Ann Oncol 2019; 30(Suppl_5): v851-v934; Abstr. #2800 (ESMO) 10 Ramalingam SS et al.: Nivolumab + ipilimumab versus platinum-doublet chemotherapy as first-line treatment for advanced non-small cell lung cancer: three-year update from CheckMate 227 Part 1. ASCO 2020, Abstr. #9500 11 Reck M et al.: Nivolumab (NIVO) + ipilimumab (IPI) + 2 cycles of platinum-doublet chemotherapy (chemo) vs 4 cycles chemo as first-line (1L) treatment (tx) for stage IV/recurrent non-small cell lung cancer (NSCLC): CheckMate 9LA. ASCO 2020, Abstr. #9501 12 Rodriguez-Abreu D et al.: Final analysis of KEYNOTE-189: pemetrexed-platinum chemotherapy (chemo) with or without pembrolizumab (pembro) in patients (pts) with previously untreated metastatic nonsquamous non-small cell lung cancer (NSCLC). ASCO 2020, Abstr. #9582 13 Leighl NB et al.: CCTG BR.34: a randomized trial of durvalumab and tremelimumab +/- platinum-based chemotherapy in patients with metastatic (stage IV) squamous or nonsquamous non-small cell lung cancer (NSCLC). ASCO 2020, Abstr. #9502
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...