Neuigkeiten von der European Breast Cancer Conference
Bericht: Dr. Ine Schmale
Die European Breast Cancer Conference (EBCC-12) konnte dieses Jahr leider, wie so viele andere Konferenzen, nur virtuell stattfinden. Der Dichte spannender Daten zum Mammakarzinom tat dies jedoch keinen Abbruch. Anbei finden Sie eine Auswahl interessanter Abstracts.
Der Nutzen des Brustkrebsscreenings steht außer Frage, wenn auch der Stellenwert der damit einhergehenden Gefahr einer Übertherapie kontrovers diskutiert wird. Im Jahr 1990 wurde in den Niederlanden ein Brustkrebsregister eingerichtet. Frauen im Alter von 50 bis 75 Jahren wird zweimal jährlich eine Mammografie angeboten, die etwa von drei Vierteln der Frauen angenommen wird. Im Rahmen der MINDACT-Studie wurde nun untersucht, inwiefern sich die beim Screening ermittelten Karzinome von anders diagnostizierten Tumoren bezüglich des genetischen und klinischen Risikos unterscheiden und wie dies bei der Therapieentscheidung berücksichtigt werden sollte.1
Seit Einführung des niederländischen Brustkrebsregisters wurde ein Anstieg der Zahl kleinerer Läsionen, aber keine Reduktion der Zahl an größeren Läsionen beobachtet. Beim Screening entdeckte Karzinome gehen im Allgemeinen mit einer besseren Prognose einher als anders diagnostizierte Tumoren, ungeachtet der Tumorcharakteristik. In der bei der EBCC präsentierten Studie wurden die Daten von 1407 Frauen im Alter von 18 bis 70 Jahren ausgewertet, die bei Diagnose ein operables invasives Mammakarzinom in einer Größe von maximal 5cm, mit 0–3 involvierten Lymphknoten und ohne Fernmetastasen, aufwiesen. Bei 754 Frauen war das Mammakarzinom beim Screening festgestellt worden (Screening-Kohorte) und bei 348 Frauen wurde ein symptomatischer Brustkrebs in einem Intervall von 24–30 Monaten nach einem negativen Screeningtest diagnostiziert (Intervall-Kohorte).
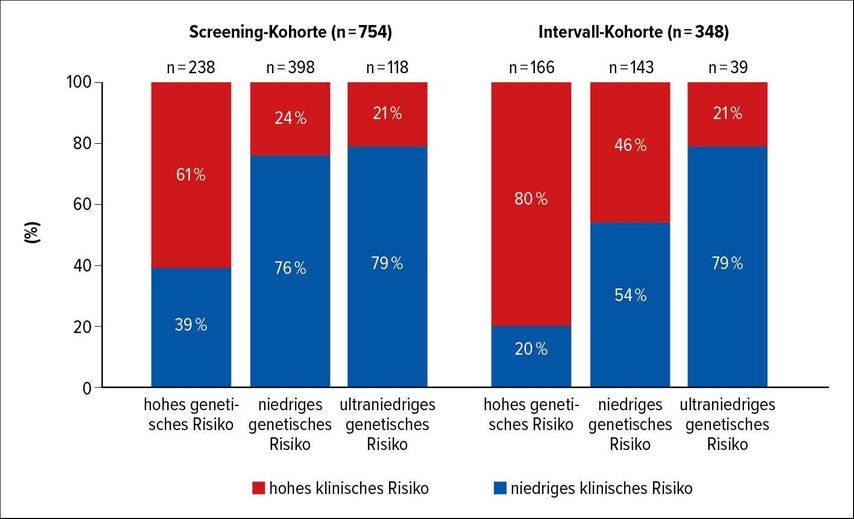
Patienten der Screening-Kohorte mit einem hohen genetischen Risiko (laut MammaPrint) zeigten in 61% der Fälle auch ein klinisch hohes Risiko (laut Adjuvant! Online), wie auch 24% der Patientinnen mit niedrigem und 21% derjenigen mit ultraniedrigem genetischem Risiko. Patientinnen der Intervall-Kohorte zeigten ein hohes klinisches Risiko in 80% der Fälle mit hohem genetischem Risiko, in 46% der Fälle mit niedrigem Risiko und in 21% der Fälle mit ultraniedrigem genetischem Risiko (Abb. 1). In beiden Kohorten erhielten die Patientinnen mit hohem genetischem Risiko erwartungsgemäß häufiger eine Chemotherapie als Patientinnen mit niedrigem und ultraniedrigem genetischem Risiko. Eine adjuvante systemische Therapie wurde Patientinnen der Intervall-Kohorte häufiger appliziert als Patientinnen der Screening-Kohorte. Das fernmetastasenfreie Überleben (DMFS) nach 8 Jahren betrug in der Screening-Kohorte 98,2% (ultraniedriges genetisches Risiko), 94,6% (niedriges genetisches Risiko) bzw. 93,8% (hohes genetisches Risiko). In der Intervall-Kohorte war die 8-Jahres-DMFS-Rate für Patientinnen mit ultraniedrigem (97,4%) und niedrigem Risiko (92,2%) vergleichbar mit der Screening-Kohorte, die Hochrisikogruppe zeigte allerdings mit einer 8-Jahres-DMFS-Rate von 85,2% eine schlechtere Prognose. Daraus schlussfolgerten die Autoren, dass die Art der Diagnosestellung in die Entscheidung für eine adjuvante Therapie miteinbezogen werden sollte.
Abb. 1: Klinische Risikoproportionen bei unterschiedlichem genetischem Risiko in der Screening-Kohorte und Intervall-Kohorte. Modifiziert nach Lopes Cardozo J et al.1
Erweiterung des Gen-Panels ohne Zusatznutzen
Ein frühes Alter bei Brustkrebsdiagnose ist ein Hinweis auf erbliche Mutationen in den Genen „Breast cancer“ (BRCA)1, BRCA2 und TP53. Es ist allerdings wenig bekannt über die Verteilung von pathogenen Varianten anderer prädisponierender Gene. Aus diesem Grund wurde in einer britischen Untersuchung die Beteiligung von anderen bekannten, mit Brustkrebs assoziierten Genen bei einem frühen Krankheitsbeginn analysiert.2
Herangezogen wurden die Daten von 381 Patientinnen, die in einem Alter von 30 Jahren oder jünger ein invasives Mammakarzinom oder ein duktales Karzinom in situ (DCIS) aufwiesen. In 134 Gewebeproben wurde initial BRCA1 (n=75), BRCA2 (n=35), TP53 (n=22) und Checkpoint-Kinase 2 (CHEK2) c.1100delC (n=2) nachgewiesen. Bei 184 initial negativ getesteten Proben wurde mit einem erweiterten Gen-Panel auf „partner and localizer of BRCA2“ (PALB2), CHEK2, „ataxia telangiectasia mutated“ (ATM), Cadherin 1 (CDH1), serine/threonine kinase 11 (STK11), „phosphatase and tensin homolog“ (PTEN), RAD50, RAD51D, „BRCA1 interacting protein C-terminal helicase 1“ (BRIP1), „BRCA1-associated RING domain protein 1“ (BARD1) und Nibrin (NBN) geprüft und 8 pathogene Varianten in PALB2 (n=4), ATM (n=2), PTEN (n=1) und CHEK2 (n=1) nachgewiesen. Im Detail wurden eine sehr hohe Rate an TP53-Mutationen bei Patientinnen <26 Jahren und hohe Raten an BRCA1/2-Mutationen in der Altersgruppe 26–30 Jahre beobachtet. DCIS und HER2(„human epidermal growth factor receptor 2“)-positive Tumorcharakteristik waren prädiktiv für eine pathologische TP53-Variante. Die höchste Rate an BRCA1-Mutationen wurde bei Patientinnen mit tripelnegativen Tumoren festgestellt. Bei Patientinnen mit einem Manchester Score (MS) ≥40 betrugen die Detektionsraten von BRCA1/2 und TP53-Mutationen 100%. Die Erweiterung des Gen-Panels brachte nur einen kleinen Zusatznutzen mit einer Detektionsrate von 3,9%.
„Age gap decision tool“ hilft bei Therapieentscheidung
Um die Therapie für ältere Patientinnen mit Hormonrezeptor(HR)-positivem Mammakarzinom zu optimieren, wurde der Verzicht auf einen primären chirurgischen Eingriff bei selektierten Patientinnen untersucht.3 Die primäre Brustkrebsoperation plus endokrine Therapie ist der alleinigen endokrinen Behandlung in den meisten Fällen überlegen, bei älteren, komorbiden Patientinnen aber möglicherweise kontraproduktiv. In der retrospektiven Age-Gap-Studie wurde daher die Sicherheit einer alleinigen endokrinen Therapie (ET), die so nicht als Therapiestandard empfohlen wird, geprüft und ein Tool für die Entscheidungshilfe in Bezug auf eine primäre ET entwickelt.
2354 Patientinnen aus 56 britischen Zentren erhielten zwischen 2013 und 2018 eine Operation plus adjuvante Antiöstrogentherapie und 500 Patientinnen primäreine reine ET. Das mediane Alter der Patientinnen im Chirurgie-Arm betrug 76 und das Alter derjenigen im ET-Arm 84 Jahre. Entsprechend wiesen die Patientinnen, die nur eine ET erhielten, auch häufiger Komorbiditäten auf und waren gebrechlicher. Patientinnen mit vergleichbarer Charakteristik aus den beiden untersuchten Gruppen (gematchte Kohorte) wurden gesondert ausgewertet.
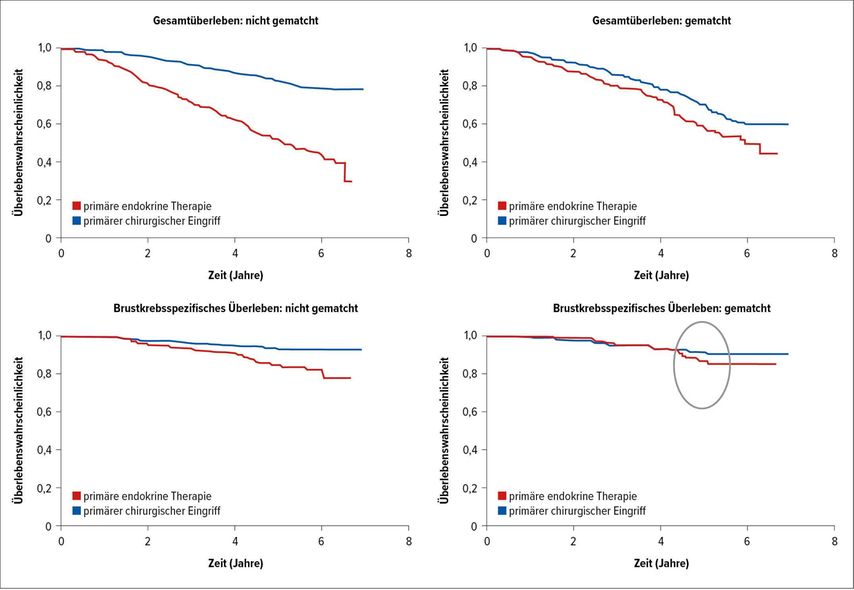
Mit einer medianen Nachbeobachtungszeit von 52 Monaten konnte bezüglich des Überlebens nur im Vergleich der gesamten Studienpopulation und unter Einbezug aller Todesursachen ein deutlicher Vorteil durch den chirurgischen Eingriff beobachtet werden. In der gematchten Kohorte unter Berücksichtigung der gesamten Mortalität und in der Gesamtpopulation bezüglich der krebsspezifischen Mortalität war der Unterschied weniger deutlich und verschwand innerhalb der gematchten Kohorte für krebsspezifische Ereignisse bis zum vierten Jahr nach Diagnose (Abb. 2). Es wurden keine Todesfälle in Assoziation mit dem chirurgischen Eingriff beobachtet. 19% der operierten Patientinnen hatten operationsassoziierte Komplikationen, im Wesentlichen Wundheilungsstörungen. Bei 2,1% der Patientinnen traten systemische Komplikationen wie kardiorespiratorische, zerebrovaskuläre oder thrombotische Ereignisse auf.
Abb. 2: Gesamtüberleben und brustkrebsspezifisches Überleben bei primärer Behandlung mit Operation oder endokriner Therapie. Modifiziert nach Wyld L et al.3
Mit dem „age gap decision tool“ (abrufbar unter https://agegap.shef.ac.uk) kann die Wahrscheinlichkeit für einen Nutzen einer ET mit oder ohne Operation berechnet werden. Die Prüfung des „age gap decision tool“ erfolgte an 46 britischen Zentren, von denen 21 randomisiert in das Decision-Tool eingewiesen wurden. Bei 449 Patientinnen waren die Voraussetzungen für eine mögliche Entscheidungsfindung mittels Decision-Tool gegeben. An Zentren mit dem Decision-Tool entschied man sich häufiger für eine alleinige endokrine Therapie im Vergleich mit Zentren ohne das Decision-Tool (21,0% vs. 15,4%). Ein Überlebensvorteil durch die geförderte Entscheidungsfindung wurde nach median 36 Monaten Nachbeobachtungszeit nur im Trend beobachtet. Informationsmaterial, das ebenfalls auf der genannten Website erhältlich ist, stärkte die Sicherheit in Bezug auf die Entscheidung bei etwa einem Fünftel der Patientinnen.
Die Autoren kamen zu dem Schluss, dass die meisten Frauen in einem Alter von 70 Jahren und älter relativ fit sind und von einem chirurgischen Eingriff profitieren. Weniger fitte Patientinnen,bei denen es keinen onkologischen Nutzen gibt, könnten durch eine Operation geschädigt werden – dies betrifft insbesondere Frauen in den Mittachtzigern mit moderater bis schlechter Gesundheit.
Fatigue ist anhaltende Folge einer Krebserkrankung
Bei 40–80% der Frauen, die ihren Brustkrebs überleben, ist Fatigue eine häufige und das tägliche Leben schwerwiegend beeinflussende Last. Fatigue scheint eine multidimensionale Erscheinung zu sein, die über diverse Mechanismen abläuft. Potenziell persistiert die Fatigue über einen langen Zeitraum, es ist jedoch wenig Genaues bekannt. Fatigue und Müdigkeit sind zudem eine häufige Beschwerde der gesamten Bevölkerung.
In der BLOC-Studie wurden daher die Prävalenz der multidimensionalen Fatigue und die Persistenz über die Zeit bei langfristig Krebsüberlebenden im Vergleich zu einer Kontrollgruppe der Bevölkerung ohne Krebs untersucht.4 Die niederländische Studie schloss 350 Brustkrebspatientinnen ein, deren Erkrankung vor ≥5 Jahren diagnostiziert wurde. Als Kontrollgruppe wurden zufällig ausgewählte Frauen der gleichen Altersgruppe ohne Krebserkrankung und in Betreuung durch denselben Hausarzt eingeschlossen. An der Studie nahmen 80 Hausärzte in den Niederlanden teil. Als Fragebogen wurde der multidimensionale „Fatigue inventory“-20-Item-Fragebogen verwendet, mit dem die allgemeine Fatigue, die körperliche Fatigue, die mentale Fatigue, die reduzierte Aktivität und die reduzierte Motivation erhoben werden. Pro Frage werden 0–4 Punkte vergeben und es kann eine maximale Punktzahl von 80 Punkten erreicht werden. Ab einem Score >60 Punkte wird von einer multidimensionalen Fatigue gesprochen. Die Patientinnen waren bei Studienbeginn median 63 Jahre alt und es waren in der Kontrollgruppe median 10 Jahre seit der Diagnose oder einem entsprechenden Indexdatum vergangen.
Es wurde bei 26,6% der Frauen in der Brustkrebsgruppe versus 15,4% in der Kontrollgruppe eine multidimensionale Fatigue beobachtet. In der univariaten Analyse zeigte sich eine 2-fach, in der multivariaten Analyse eine 1,7-fach erhöhte Wahrscheinlichkeit für eine Fatigue nach Krebserkrankung. Bei Patientinnen, bei denen die Diagnosehöchstens10 Jahre (5–10 Jahre) zurücklag,waren 29,2% von einer multidimensionalen Fatigue betroffen (versus 13,7%), mit einem um das 2,6- bzw. 2,0-fach erhöhten Wahrscheinlichkeit. Bei Patientinnen mit Diagnose vor 10 Jahren oder früher waren es noch 24,3% versus 16,9% mit einer um das 1,6- bzw. 1,5-fach erhöhten Wahrscheinlichkeit.
Eine Depression zeigten 32,3% der Krebspatientinnen mit Fatigue versus 2,7% der Patientinnen ohne Fatigue, was eine 17,0-fache Erhöhung der Wahrscheinlichkeit in der univariaten und eine 8,9-fach erhöhte Wahrscheinlichkeit laut multivariater Analyse bedeutet. Ängstlichkeit trat bei 41,9% der Patientinnen mit Fatigue versus 10,1% der Patientinnen ohne Fatigue auf, mit einer 6,4- bzw. 3,7-fach erhöhten Wahrscheinlichkeit. Es wurde dabei kein signifikanter Unterschied in Bezug auf das Alter (>65 Jahre), die Zeit seit Diagnosestellung (≥10 Jahre), den Body-Mass-Index (BMI >30), die Behandlung (Chemo- oder/und Strahlentherapie), eine endokrine Therapie, kardiovaskuläre Störungen (CVD ≥1) oder eine niedrige linksventrikuläre Ejektionsfraktion (LVEF) – <54% – festgestellt.
Die behandelnden Ärzte sollten sich daher bewusst sein, dass eine von vier Frauen, die den Brustkrebs überwunden haben, auch 10 Jahre nach Diagnosestellung an einer Fatigue leiden wird und dass dies möglicherweise mit einer Depression oder Ängstlichkeit assoziiert sein wird.
SNPs nicht prädiktiv für Hitzewallungen
In der IRIS-I-Studie wurde, neben der Reduktion des Risikos für eine Brustkrebserkrankung unter prophylaktischer Tamoxifen-Gabe bei Frauen mit erhöhtem Brustkrebsrisiko, eine signifikante Steigerung von Nebenwirkungen und Menopausen-ähnlichen Effekte während der aktiven Therapiedauer mit Tamoxifen beobachtet. Hitzewallungen traten in der Regel innerhalb des ersten Jahres auf, gingen dann zurück und waren am Ende der prophylaktischen Behandlung auf Placeboniveau. Allerdings waren die Hitzewallungen auch ein häufig angegebener Grund für die frühzeitige Beendigung der prophylaktischen Gabe.
Die Östrogendeprivation wird als Hauptursache für Hitzewallungen angenommen. Genetische Varianten von Einzelnukleotid-Polymorphismen (SNPs) könnten die Plasmakonzentration von Tamoxifen und Sexualhormonen möglicherweise beeinflussen. In einer Untersuchung der IRIS-I-Daten wurde die Prädiktion von Hitzewallungen unter Tamoxifenbehandlung auf den Effekt von SNPs untersucht.5 Es wurden 571 SNPs in 60 Genen in einer Kandidaten-Genanalyse geprüft und anhand der Ergebnisse wurdeein Risikoscore erarbeitet. Die vielversprechendsten SNPs waren Cytochrom P450 2C9 (CYP2C9), Östrogenrezeptor 1 (ESR1), 11β-Hydroxysteroid-Dehydrogenase 1 (HSD11B1) und CAP19A1. Das Ergebnis:Für keinen einzelnen oder kombinierten SNP konnteeine signifikante Assoziation mit Hitzewallungen nachgewiesen werden. Die Wissenschaftler schlossen aus den Ergebnissen, dass die genetischen Varianten einen minimalen Einfluss auf Hitzewallungen haben könnten. Es sei aber wahrscheinlich, dass andere Risikofaktoren einen größeren Einfluss auf Hitzewallungen ausüben als SNPs.
Quelle:
EBCC-12, 2.–3. Oktober 2020, virtuell
Literatur:
1 Lopes Cardozo J et al.: Screen-detected breast cancers have different tumor biology and better prognosis compared to interval breast cancers. EBCC 2020; Abstr. #11 2 Evans G et al.: High likelihood of actionable pathogenic variant detection in breast cancer genes in women with very early onset breast cancer, but low rate of additional panel genes beyond BRCA1/2 and TP53. EBCC 2020; Abstr. #LBA2 3 Wyld L et al.: Impacts of omission of breast cancer surgery in older women with ER+ early breast cancer. A risk stratified analysis of survival and quality of life outcomes. EBCC 2020; Abstr. #8A 4 Maass WMCS et al.: Fatigue among long-term breast cancer survivors: a controlled cross-sectional study. EBCC 2020; Abstr. #LBA3 5 Hale M et al.: Association of genetic variations for prediction of hot flushes in women taking tamoxifen for breast cancer prevention. EBCC 2020; Abstr. #22
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...