Was gibt’s Neues zur (neo)adjuvanten Therapie des frühen Mammakarzinoms?
Autorin:
Dr. med. (HR) Tamara Rordorf
Brustzentrum und Klinik für Onkologie und Hämatologie
Kantonsspital St. Gallen
E-Mail: tamara.rordorf@kssg.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Bei der Therapie des frühen Mammakarzinoms liegt das Augenmerk u.a. darauf, das Rezidivrisiko einer Patientin zu verringern. Studien wie die KEYNOTE-522-Studie zu Immuncheckpoint-Inhibitoren beim tripelnegativen Mammakarzinom liefern spannende Daten, werfen jedoch auch neue Fragen auf.
Eines der wichtigsten Ziele in der Behandlung des frühen Mammakarzinoms ist die Therapieoptimierung entsprechend dem individuellen Rezidivrisiko. In den letzten Jahren sind mehrere Studien erschienen, die neue Erkenntnisse zu diesem Thema gebracht und die neoadjuvante und adjuvante Therapie des frühen Mammakarzinoms beeinflusst oder verändert haben.1–4
In den bisher publizierten Studien zur Behandlung des frühen Mammakarzinoms ist mehrheitlich die Therapieintensivierung in Hochrisikosituationen untersucht worden, mit dem Ziel, Rezidive, v.a. Fernmetastasen, zu verhindern und die Heilungschancen zu verbessern. Dazu gehören Studien zu Immuncheckpoint-Inhibitoren bei Patientinnen mit tripelnegativem Mammakarzinom (TNBC) wie KEYNOTE-5522,3 und zu PARP(Poly[ADP-Ribose]-Polymerasen)-Inhibitoren bei Patientinnen mit BRCA(«breast cancer»)-Mutation.4 Bei Patientinnen mit Hormonrezeptor(HR)-positiven, HER2-negativen Mammakarzinomen wurde die zusätzliche Gabe von CDK(Cyclin-abhängige Kinasen)4/6- Inhibitoren in adjuvanten Studien untersucht.5 Nicht weniger wichtig ist die Frage nach einer Deeskalation der Therapie bei Patientinnen mit geringem Rezidivrisiko, mit dem Ziel, eine Überbehandlung zu vermeiden.
Am San Antonio Breast Cancer Symposium (SABCS) 2021 sind diese Daten, deren Einfluss auf die tägliche Praxis und viele offene Fragen ausführlich diskutiert worden.
Immuntherapie beim TNBC: dieKEYNOTE-522-Studie
Die Rolle von Checkpoint-Inhibitoren in der neoadjuvanten und zum Teil adjuvanten Behandlung des TNBC wurde in mehreren Studien untersucht.
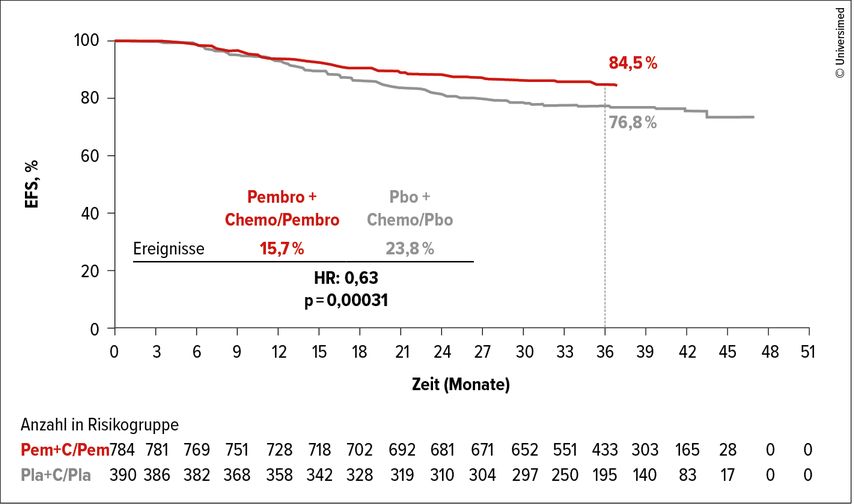
KEYNOTE-522 ist eine randomisierte Phase-III-Studie, in welche 1174 Patientinnen im Stadium II und III eingeschlossen wurden.3 Die Randomisierung erfolgte entweder in den Arm mit der neoadjuvanten Chemotherapie (NAC) in Kombination mit Pembrolizumab gefolgt von der Operation und adjuvant 9 Zyklen Pembrolizumab-Monotherapie oder in den Kontrollarm mit NAC und Placebo. Die NAC bestand aus wöchentlich 12 Gaben Paclitaxel kombiniert mit Carboplatin gefolgt von 4 Zyklen EC (Epirubicin und Cyclophosphamid)/AC (Doxorubicin und Cyclophosphamid). Beide primären Endpunkte – pathologische komplette Remission (pCR) zum Zeitpunkt der Operation und ereignisfreies Überleben («event-free survival», EFS) – sind erreicht worden.
Im Pembro-Arm zeigte sich bei 64,8% (95% CI: 59,9–69,5) und im Kontrollarm bei 51,2% (95% CI: 44,1–58,3) der Patientinnen eine pCR. Im Gegensatz zur metastasierten Situation war PD-L(«programmed death-ligand»)-Positivität kein prädiktiver Faktor für die Wirksamkeit einer Therapie mit Pembrolizumab, wenngleich die pCR- Rate in beiden Therapiearmen bei PD-L-Expression höher war. Bei PD-L1-positiven Tumoren erhöhte das Hinzunehmen von Pembrolizumab die Rate der pCR von 54,9% auf 68,9%. Eine signifikante Verbesserung zeigte sich auch bei PD-L1-negativen Tumoren: 30,3% vs. 45,3%.2
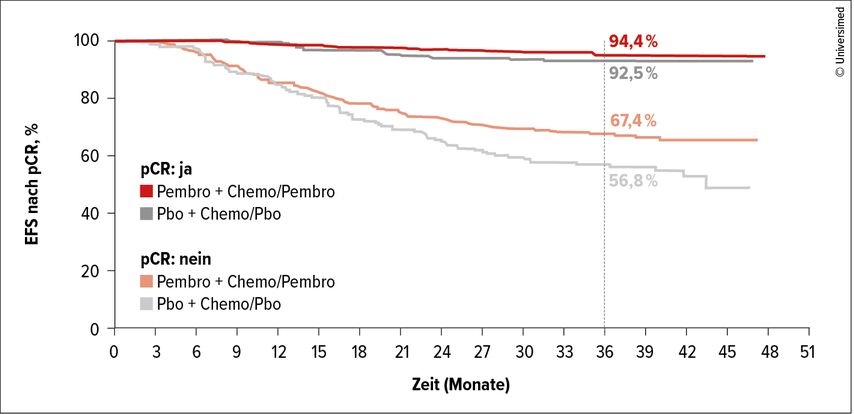
Bezüglich der EFS-Rate zeigte die vierte Interimsanalyse eine signifikante Verbesserung: Nach 39,1 Monaten waren 84,5% der Patientinnen im Pembro-Arm und 76,8% im Kontrollarm rezidivfrei (HR: 0,63; 95% CI: 0,48–0,82; p=0,001; Abb. 1). Die Patientinnen, die nach der neoadjuvanten Immunchemotherapie keine pCR erreicht hatten, hatten bezüglich des EFS einen deutlich höheren Benefit (EFS-Rate stieg von 56,8% auf 67,4%) als die Patientinnen mit einer pCR. Bei dieser Gruppe ergab sich nur eine minimal bessere EFS-Rate durch die Zugabe von Pembrolizumab (94,4% vs. 92,5%; Abb. 2).
Am letztjährigen SABCS wurden geplante Sensitivitäts- und Subgruppenanalysen vorgestellt. Es konnte gezeigt werden, dass der Benefit unabhängig vom Nodalbefall und vom Tumorstadium (II vs. III) und auch von der Definition des EFS war.
Bei N+ Tumoren wurde durch die Zugabe von Pembrolizumab die pCR-Rate um 20,6% erhöht (64,8% im Pembro- vs. 44,1% im Placeboarm, HR: 0,58). Bei N- Tumoren war der absolute Unterschied auch vorhanden, aber mit 6,3% kleiner (64,9% vs. 58,6%); bei vergleichbarem HR (0,65).
Diskussion und offene Fragen
Die Daten der KEYNOTE-522-Studie lassen verschiedene Fragen offen, wie z.B. die Frage nach der optimalen adjuvanten Therapie bei Patientinnen ohne pCR im Hinblick auf Daten der CREATE-X-Studie. In der Diskussion wurde von vielen Experten eine Kombination von Pembrolizumab mit Capecitabin in Betracht gezogen. Ausserdem wurde die adjuvante Therapie nach neoadjuvanter Chemoimmuntherapie bei Patientinnen mit BRCA-Mutation diskutiert. Hier könnte eine Kombination aus Pembrolizumab und Olaparib eine Therapieoption sein. Allerdings gibt es bisher keine Daten zu dieser Kombination in dieser Situation, sodass es sich hier um keine zugelassenen Therapien handelt. Bei Patientinnen, die eine pCR erreichten, wurde diskutiert, ob die adjuvante Gabe von Pembrolizumab tatsächlich die Heilungschance zusätzlich erhöht. Die meisten Experten haben eine adjuvante Therapie empfohlen, falls keine oder nur leichte Nebenwirkungen vorhanden sind.
Zusammengefasst gibt es also aktuell folgende offene Fragen:
-
Braucht jede Patientin mit TNBC, die die Einschlusskriterien für KEYNOTE-522 erfüllt, Pembrolizumab zusätzlich zur Chemotherapie? Bzw. kann man die Patientinnen, die mit der Chemotherapie alleine geheilt werden können, identifizieren?
-
Profitieren die Patientinnen mit einer pCR von der adjuvanten Therapie mit Pembrolizumab?
-
Hätte eine «Dose-dense»-Chemotherapie die Ergebnisse beeinflusst?
-
Sollen die Patientinnen, die keine pCR erreichen, adjuvant zusätzlich zu Pembrolizumab auch Capecitabin erhalten?
-
Sollen die Patientinnen mit BRCA-Mutation zusätzlich zu Pembrolizumab auch Olaparib erhalten?
Neue Studiendaten zum HR-positiven Mammakarzinom
MonarchE vs. PALLAS
Ein weiteres viel diskutiertes Thema beim SABCS 2021 war die Rolle von CDK4/6-Inhibitoren in der adjuvanten Situation. Insbesondere wurde die Diskrepanz der Ergebnisse derStudien MonarchE und PALLAS besprochen.
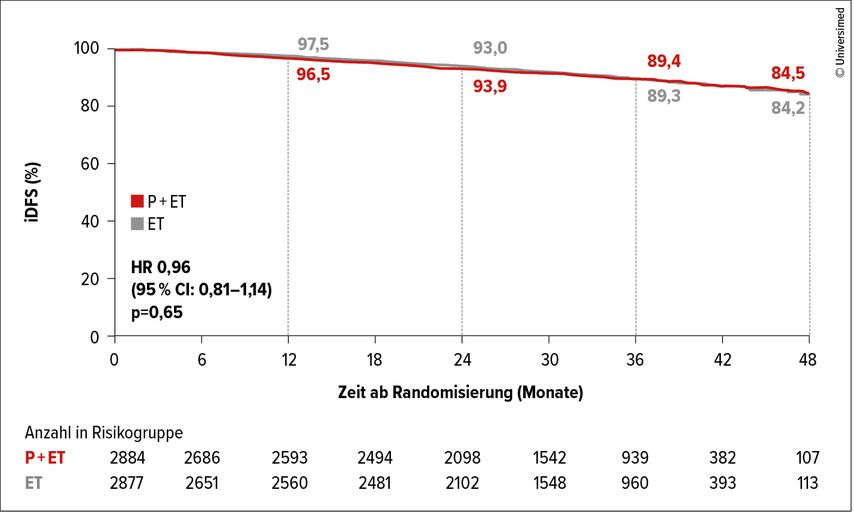
MonarchE zeigte eine Verlängerung des «invasive disease-free survival» (iDFS) bei Patientinnen mit nodal-positivem Mammakarzinom und hohem Rezidivrisiko, wenn Abemaciclib adjuvant über 2 Jahre zusätzlich zur endokrinen Therapie (ET) gegeben wurde.5 Das hohe Risiko wurde entweder durch klinisch-pathologische Eigenschaften (n>3 Lymphknoten [LK] oder bei N1–3 LK zusätzlich zu Tumor >5cm oder G3, Kohorte 1) oder durch eine hohe Proliferationsfraktion (Ki-67>20% zentral bestimmt, Kohorte 2) definiert. Patientinnen im Arm A erhielten ET und Abemaciclib, im Arm B ET und Placebo. Der primäre Endpunkt – eine statistisch signifikante Verlängerung des iDFS – wurde erreicht.
Insbesondere eindrücklich waren die Ergebnisse bei Patientinnen mit einem Ki-67 von >20%. Nach drei Jahren Beobachtungszeit hatten 79% der Patientinnen im Kontrollarm und 86,1% der Patientinnen im Abemaciclib-Arm kein iDFS-Ereignis, was einer HR von 0,63 (95% CI: 0,49–0,80) entspricht und signifikant war. Eine Verbesserung der iDFS-Rate zeigte sich aber auch bei Patientinnen mit einem Ki-67 von <20: 87,2% der Patientinnen in der Kontrollgruppe und 91,7% derjenigen (HR: 0,70; 95% CI: 0,49–0,80) in der Abemaciclib-Gruppe nach drei Jahren. In den USA wurde Abemaciclib für die Patientinnen in Kohorte 1 mit einem Ki-67>20% zugelassen.
Am SABCS 2021 wurde die finale Analyse der ähnlich konzipierten PALLAS-Studie präsentiert, die keinen Benefit durch die Hinzunahme von Palbociclib zur adjuvanten endokrinen Therapie zeigte (Abb. 3).6 Die gesamte Population hatte zwar im Vergleich zu den Patientinnen in MonarchE ein geringeres Rezidivrisiko. Die Ergebnisse blieben jedoch unverändert, auch wenn nur die Daten von Patientinnen mit höherem Risiko separat analysiert wurden. Der Grund für die Diskrepanz bei den Ergebnissen bleibt unklar. Die kontinuierliche Gabe von Abemaciclib versus die Gabe von Palbociclib, bei welchem nach 3 Wochen Therapie jeweils eine Woche Pause erfolgt, wurde als eine mögliche Erklärung vorgeschlagen. Mit Sicherheit kann diese Frage nicht beantwortet werden.
Die RxPonder-Studie
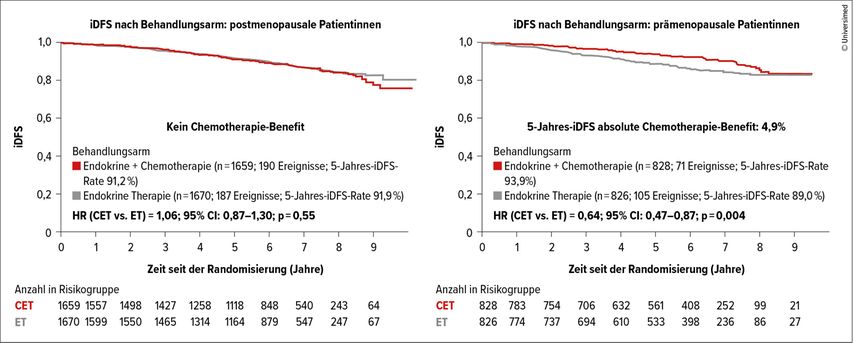
Die RxPonder-Studie stellt die Frage, ob die Patientinnen mit einem HR+/HER2– Mammakarzinom mit 1–3 befallenen Lymphknoten und einem Recurrence Score von ≤25 von einer adjuvanten Chemotherapie zusätzlich zu einer endokrinen Therapie profitieren.7 Bei prämenopausalen Patientinnen konnte ein Vorteil von +4,9% bezüglich des iDFS beobachtet werden (Abb. 4). Bei postmenopausalen Frauen ergab sich kein Vorteil durch die Chemotherapie.
Ein Benefit bei prämenopausalen Frauen konnte auch bei nur mikrometastatischem Befall der Lymphknoten gezeigt werden, wobei bei dieser Subgruppenanalyse die Patientenzahlen sehr niedrig waren und die Daten mit Vorsicht interpretiert werden müssen.
EBCTCG-Metaanalyse und Langzeitauswertung der TEXT/SOFT-Studie
Im Rahmen der Metaanaylse der Early Breast Cancer Trialists’ Collaborative Group (EBCTCG) wurden die Daten von mehr als 7000 Patientinnen ausgewertet. Es zeigt sich bezüglich des Gesamtüberlebens kein Unterschied bei der Unterdrückung der Ovarfunktion (OFS) entweder mit Tamoxifen oder einem AI.8 Bei der Subgruppe der Patientinnen mit bis zu drei befallenen Lymphknoten zeigte sich ein Vorteil im erkrankungsfreien 10-Jahres-Überleben (RFS) zugunsten des AI (+4,8%; p=0,005). Für die Mehrzahl der Patientinnen ist somit die Kombination von OFS mit Tamoxifen eine wirksame Option.
Die Analyse der TEXT/SOFT-Studie mit einem Follow-up von 12 Jahren zeigt, dass die Patientinnen, die eine Chemotherapie (Surrogat für ein höheres Rezidivrisiko) erhalten haben, von einer Kombination von OFS/Exemestan vs. OFS/Tamoxifen bezüglich des Gesamtüberlebens mit einem absoluten Benefit von 3,3% nach 12 Jahren profitieren. Das Gesamtüberleben war allerdings ohne signifikante Unterschiede zwischen AI und Tamoxifen.
Literatur:
1 Masuda N et al.: N Engl J Med 2017; 376(22): 2147-59 2Schmid P et al.: N Engl J Med 2020; 382(9): 810-21 3Schmid P et al.: N Engl J Med 2022; 386(6): 556-67 4Tutt ANJ et al.: N Engl J Med 2021; 384(25): 2394-405 5 Johnston SRD et al.: J Clin Oncol 2020; 38(34): 3987-98 6 Gnant M et al.: J Clin Oncol 2022; 40(3): 282-93 7Kalinsky K et al.: N Engl J Med 2021; 385(25): 2336-47 8Early Breast Cancer Trialists‘ Collaborative Group: Lancet Oncol 2022; 23(3): 382-92 9SchmidP: ESMO Virtual Plenary July 2021; Abstr. #VPF-202110Kalinsky K et al.: SABCS 2021; Abstr. #AGS2-07
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...