Neue Therapieoptionen bei vier Organen
Autorinnen:
Prof. Dr. med. Anja Lorch
Reni Milerski
Dr. med. Franca Lisy
Klinik für Medizinische Onkologie und Hämatologie, Universitätsspital Zürich, Zürich
Korrespondenz:
E-Mail: anja.lorch@usz.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Urologische Tumoren zählen zu den häufigsten soliden Tumorerkrankungen weltweit. Ihre Therapie ist abhängig vom Stadium, von der entsprechenden Risikoklassifikation, molekularbiologischen Markern und individuellen Patient:innencharakteristika. Zum Einsatz kommen neben den klassischen Therapieverfahren Operation, Strahlen-, Chemo- oder Hormontherapie und auch vermehrt Immun- und zielgerichtete Therapien als Teil multimodaler Behandlungskonzepte.
Durch den Einsatz dieser gezielten Therapien unter Einbezug präzisionsmedizinischer Konzepte hat sich das Überleben der Patient:innen, auch im fortgeschrittenen Stadium, in den letzten Jahren deutlich bei gleichzeitig guter Lebensqualität verlängert. Dieser Artikel bietet eine zusammenfassende Darstellung der aktuellen Standards sowie ein Update neuer Entwicklungen in verschiedenen Krankheitsstadien bei den Entitäten Blasen-, Nieren-, Prostata- und Keimzelltumoren des Mannes.
Muskelinvasives Blasenkarzinom
Es wird zwischen nichtmuskelinvasiven (NMIBC) und muskelinvasiven Blasentumoren (MIBC) unterschieden. Etwa 70% der Erstdiagnosen sind nichtmuskelinvasive Tumoren, deren Prognose, trotz hoher lokaler Rezidivraten, relativ gut ist. Allerdings entwickeln etwa 30% im Verlauf einen muskelinvasiven Tumor. Bei dieser Gruppe sind zum Zeitpunkt der Diagnosestellung etwa ein Fünftel der Tumoren bereits lokal fortgeschritten, bei 10% der Patient:innen besteht bereits eine metastasierte Erkrankung. Hier ist die Prognose weiterhin ungünstig. Die Einstufung nichtmuskelinvasiv/muskelinvasiv basiert auf einer Biopsie, die mittels einer transurethralen Resektion (TUR-B) gewonnen wird. Ab einem T2-Stadium spricht man von einem muskelinvasiven Tumorstadium (MIBC, ≥T2).
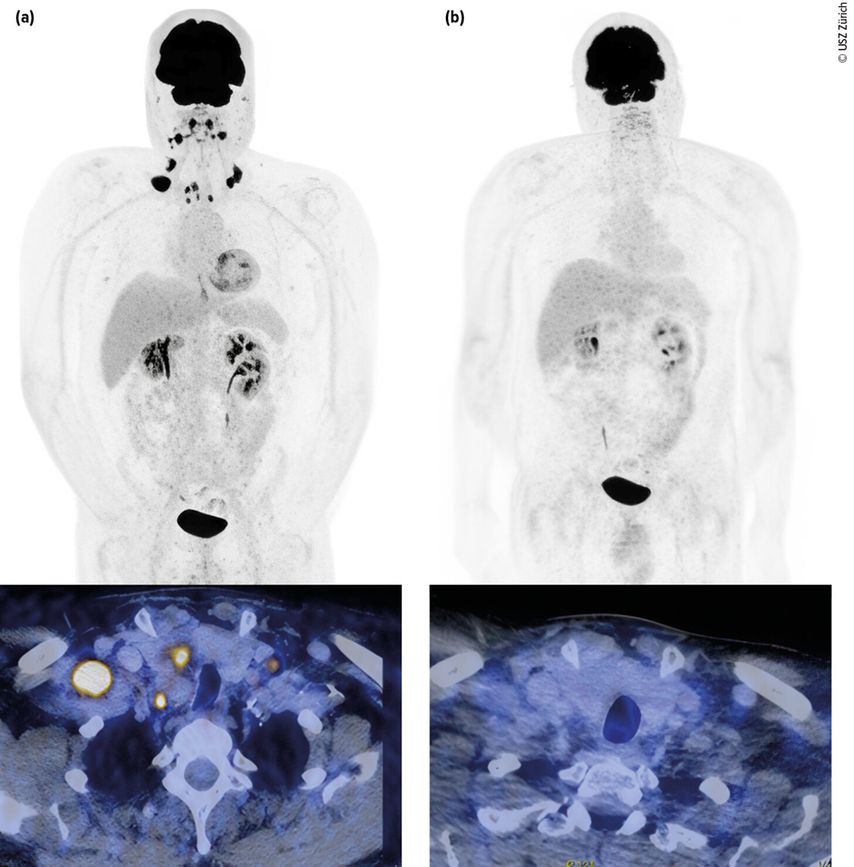
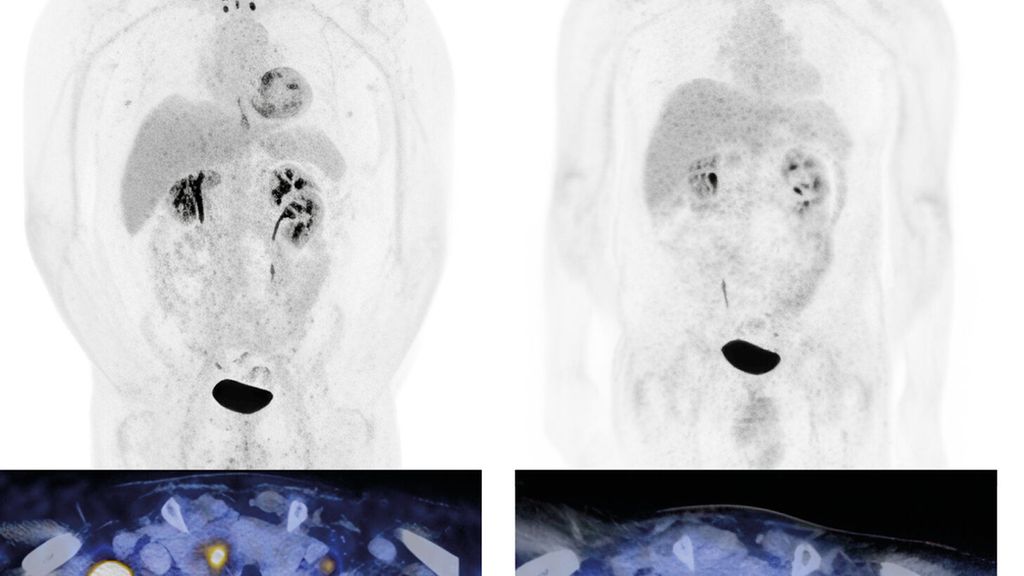
Abb. 1: Urothelkarzinom der Harnblase (initial cT3 cN3 cM0) mit metachron aufgetretener lymphogener Metastasierung. Staging mittels Computertomografie (PET-CT) mit Diagnose der lymphogenen Metastasierung (a, links). Erstes Restaging zwei Monate nach Therapiebeginn mit EV+P (b, rechts). Bildmorphologisch zeigt sich eine Komplettremission. Der Patient befindet sich weiterhin in anhaltender Remission. Bilder und Patient USZ Zürich
Lokal begrenztes muskelinvasives Blasenkarzinom (≥T2 N0/N1 M0)
Das lokal begrenzte MIBC wird multimodal behandelt. Der aktuell etablierte Standard umfasst eine neoadjuvante platinbasierte Chemotherapie (NAC) vor der obligaten chirurgischen Resektion. In der Regel werden vier Zyklen Cisplatin-basierter Chemotherapie (z.B. Cisplatin+Gemcitabin) appliziert. Zahlreiche Studien und Metaanalysen haben gezeigt, dass NAC vor radikaler Zystektomie (RZ) das krankheitsfreie Überleben (DFS) und das Gesamtüberleben (OS) signifikant verlängert.
Die NIAGARA-Studie, eine randomisierte Phase-III-Studie konnte kürzlich zeigen, dass durch perioperative Hinzunahme des Checkpoint-Inhibitors Durvalumab (Anti-PD-L1-Antikörper) zur Standard-NAC (Cisplatin/Gemcitabin) das progressionsfreie (PFS) und Gesamtüberleben (OS) signifikant verlängert werden und eine Rate pathologischer Komplettremission (pCR) von 37% erzielt wird. Die Studie stellt eine wichtige Innovation im Management des lokalisierten MIBC dar und definiert einen neuen Standard.1
Daten aus der Phase-II-Studie SAKK 06/19, die ein ähnliches Konzept testet, jedoch Atezolizumab anstatt Durvalumab als Checkpoint-Inhibitor einsetzt und im neoadjuvanten Setting zusätzlich lokal BCG instilliert, sind pendent. Innerhalb der SAKK-Studie wird zudem nach Erreichen einer pCR auf die adjuvante Checkpoint-Inhibitor-Gabe verzichtet.2
Eine sehr gute Behandlungsalternative, insbesondere bei Cisplatin-unfitten Patient:innen oder bei Patient:innen, die eine Resektion der Blase ablehnen, kann unter bestimmten lokalen Voraussetzungen die trimodale Therapie darstellen (TUR-B+Radiotherapie+Chemosensibilisierung). Als Radiosensitizer wird bei sehr guter Verträglichkeit häufig Gemcitabin eingesetzt.3
Für Patient:innen ohne NAC bzw. ohne perioperative Therapie mit postoperativ pT3–4 und/oder N+ sollte bei Patient:innen mit Blasentumor nach erfolgter RZ eine adjuvante Monotherapie mit einem Immunonkologikum besprochen werden. Es stehen mit den beiden Substanzen Nivolumab und Pembrolizumab zwei Medikamente zur Verfügung, die in Phase-III-Studien jeweils ein signifikant verlängertes PFS und einen Trend zu einem verlängerten OS im Vergleich zu Placebo bzw. alleinigem Follow-up zeigen konnten.4,5
Lokal fortgeschrittenesund metastasiertes MIBC
Erstlinie
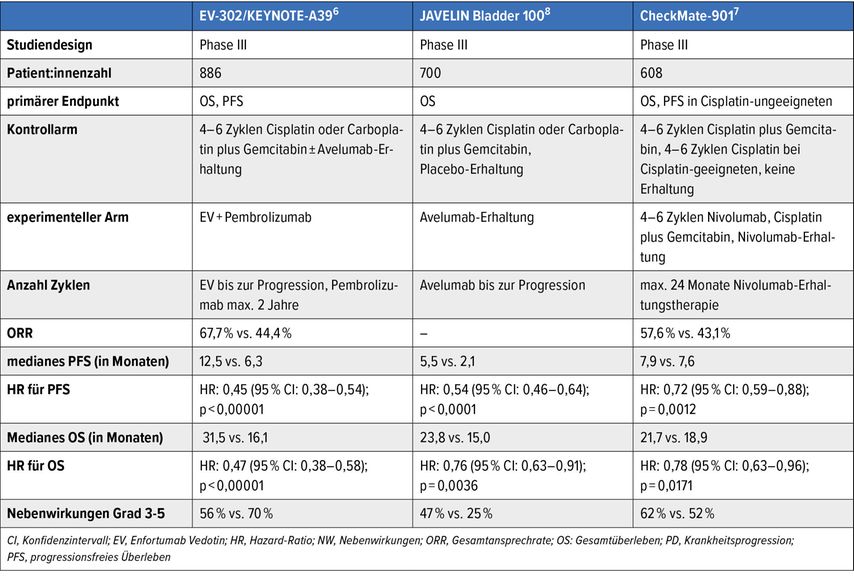
Der lokal fortgeschrittene und metastasierte Blasentumor stellt weiterhin eine therapeutische Herausforderung dar. Die Prognose ist trotz jüngster Fortschritte in der Systemtherapie weiterhin meist schlecht. Die Wahl der Erstlinienbehandlung orientiert sich seit Zulassung der Kombinationstherapie mit dem Antikörper-Wirkstoff-Konjugat (ADC) Enfortumab Vedotin (gerichtet gegen Nectin-4) in Kombination mit dem PD-1-Checkpoint-Inhibitor Pembrolizumab (EV+P) an der Tauglichkeit für diese Kombination vs. Nicht-Tauglichkeit.
Das mediane OS konnte mit dieser Kombination signifikant auf knapp 34 Monate im Vergleich zu 16 Monaten mit alleiniger platinhaltiger Chemotherapie ± IO-Erhaltung gesteigert werden. In der Studie waren auch Patient:innen mit schlechterem Allgemeinzustand (bis ECOG 2) und Patient:innen mit reduzierter Nierenfunktion (GFR ≥30ml/min) eingeschlossen. Ein Update mit einem Follow-up von nun 2,5 Jahren zeigt, dass die Patient:innen, die eine komplette Remission (CR) erzielen, auch längerfristig in einer CR bleiben.6
Bei Nicht-Tauglichkeit für EV+P stellt für Cisplatin-geeignete Patient:innen die Kombination aus Cisplatin+Gemcitabin+Nivolumab analog der Studie CheckMate-901 mit ebenfalls signifikantem OS-Vorteil im Vergleich zur alleinigen Chemotherapie eine Alternative dar. Für Patient:innen, die nicht fit für Cisplatin, jedoch fit für Chemotherapie sind, kann die Kombination aus Carboplatin+Gemcitabin mit anschliessender Erhaltungstherapie mit dem PD-1-Immuncheckpoint-Inhibitor Avelumab (Studie JAVELIN 100 Bladder) eingesetzt werden.7
Das grundsätzliche Ziel jeglicher Therapie besteht in der Verbesserung der Lebensqualität bei gleichzeitiger Verlängerung des Gesamtüberlebens. Das Therapieregime sollte daher gemeinsam mit den Patient:innen in Abhängigkeit von den Komorbiditäten, dem Nebenwirkungsprofil der einzelnen Therapieregime und dem Patient:innenwunsch sorgfältig ausgewählt werden.
Folgelinie
Je nach Art der Vorbehandlung stehen für die Folgelinien verschiedene Regime zur Verfügung. Bei Patient:innen mit einer FGFR(«fibroblast growth factor receptor»)3-Aberration, die sich bei 10–15% der Patient:innen nachweisen lässt, kann der selektive FGFR-Inhibitor Erdafitinib eingesetzt werden.9 Für Patient:innen nach Versagen einer platinhaltigen Chemotherapie und IO-Erhaltungstherapie ist EV als Monosubstanz mit einem in einer Phase-III-Studie nachgewiesenen Benefit im PFS und OS zugelassen.10 Neue Therapieansätze bieten Therapien mit ADC, die gegen HER2 gerichtet sind.8 Eine entsprechende Testung ist daher sinnvoll.11
Klarzelliges Nierenzellkarzinom
Das klarzellige Nierenzellkarzinom (ccRCC) ist die häufigste histologische Form des Nierenzellkarzinoms, die etwa 70–80% aller Nierenkarzinome ausmacht. Die Entstehung des ccRCC steht häufig in Zusammenhang mit genetischen Veränderungen, insbesondere der Inaktivierung des VHL-Gens (Von-Hippel-Lindau) auf Chromosom 3p, das eine zentrale Rolle in der Regulation der Zellantwort auf Sauerstoffmangel (Hypoxie) spielt.
Lokalisiertes ccRCC (UICC-Stadium I–III)
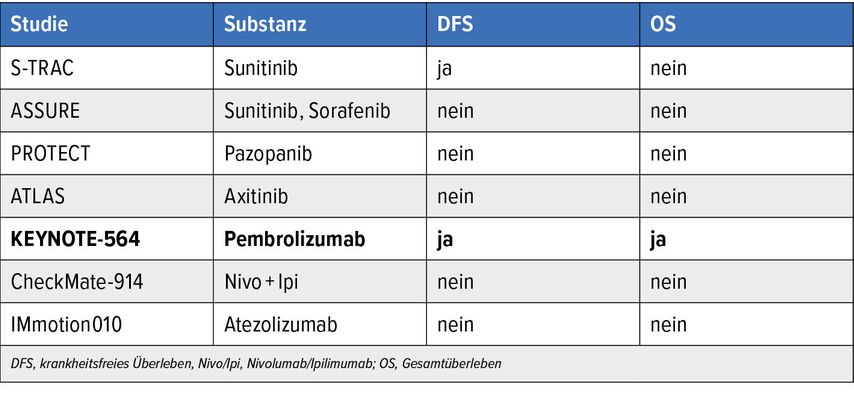
Die chirurgische Entfernung des Tumors gilt als Therapie der Wahl. Für Patient:innen mit hohem Rezidivrisiko nach der Operation ist eine adjuvante Therapie mit dem PD-1-Checkpoint-Inhibitor Pembrolizumab über max. 17 Zyklen (=1 Jahr) zugelassen: Die Zulassung basiert auf signifikanten Verlängerungen im krankheitsfreien Überleben mit einer Reduktion des Risikos für ein Rezidiv um 28% und im Gesamtüberleben mit einem Benefit von 5% nach vier Jahren, wie durch eine grosse randomisierte Phase-III-Studie belegt werden konnte. Allerdings traten bei knapp zwei von zehn Patient:innen höhergradige Nebenwirkungen unter der adjuvanten Therapie auf.12
Tab. 1: Zusammenfassung der Ergebnisse der Studien KEYNOTE-A39, JAVELIN Bladder 100 und CheckMate-901
Zwei weitere Studien mit Immuncheckpoint-Inhibitoren (ICI) zeigten hingegen keinen signifikanten Vorteil im DFS und OS. Die Entscheidung für die adjuvante Therapie sollte individuell unter Berücksichtigung des Risikos für das Auftreten eines Rezidivs, des Nebenwirkungsprofils und des Patient:innenwunschs getroffen werden. Patient:innen mit einem sarkomatoiden Anteil in der Histologie und Patient:innen mit einer initialen Oligometastasierung und «no evidence of disease» (NED) nach Resektion des Primarius sowie der Oligometastasen (bis max. 5) sollten bei fehlenden Kontraindikationen zur Durchführung einer adjuvanten Therapie aufgrund des grossen Benefits innerhalb der Subgruppen ermutigt werden. Unklar bleibt derzeit die Therapiesequenz bzw. die Wirksamkeit einer ICI-Therapie bei Auftreten eines Rezidivs nach adjuvanter Pembrolizumab-Therapie.
Metastasiertes ccRCC (UICC-Stadium IV)
Bei metastasiertem ccRCC ist die medikamentöse (Kombinations-)Therapie der Behandlungsstandard. Es existieren derzeit noch keine validierten Biomarker zur Steuerung der Erstlinientherapie beim metastasierten Nierenzellkarzinom. Das therapeutische Vorgehen basiert auf der Tumorlast, klinischen Symptomen, Komorbiditäten, Patient:innenpräferenzen und der Risikoklassifizierung des Tumors nach dem IMDC-Score (International Metastatic RCC Database Consortium) in die Gruppen «favorable», «intermediate» oder «poor risk».14
Die zytoreduktive Nephrektomie ist speziell bei Patient:innen mit mittlerem und hohem Risiko nur in ausgewählten Fällen angezeigt. Eine interdisziplinäre Evaluation ist obligat.
Erstlinientherapie
Derzeit kommen neben den klassischen VEGFR-gerichteten Tyrosinkinase-Inhibitoren (TKI) – Sunitinib, Pazopanib, Axitinib, Cabozantinib, Lenvatinib – vor allem die ICI Pembrolizumab und Nivolumab zum Einsatz.13
Der CTLA-4-Inhibitor Ipilimumab ist als Kombinationspartner mit Nivolumab in der Schweiz nur für die Behandlung von Patient:innen mit mittlerem und hohem Risiko zugelassen.15 Diese Kombination scheint die besseren Langzeitergebnisse im Vergleich zu den TKI/ICI-Kombinationen zu zeigen. Diese Kombinationstherapien mit Axitinib/Pembrolizumab, Cabozantinib/Nivolumab und Lenvatinib/Pembrolizumab sind ebenfalls etablierte Therapieregime, sie führen insbesondere bei klinisch symptomatischen Patient:innen und Patient:innen mit hoher Tumorlast in der Regel zu einem raschen Ansprechen und werden in diesen Situationen bevorzugt eingesetzt.16–18
Die TKI/ICI-Kombinationen wurden in Phase-III-Studien für alle IMDC-Risikogruppen getestet. Dabei zeigte sich für die Gesamtpopulation eine signifikante Verlängerung des PFS und OS unabhängig von der PD-L1-Expression. In der IMDC-Prognosegruppe «favorable» sind die Daten insbesondere für das OS jedoch weniger überzeugend, sodass in der Schweiz nur TKI-Monotherapien für diese Gruppe zugelassen sind.
Eine Phase-II Studie-mit einer Dreifachkombination bestehend aus Nivolumab/Ipilimumab und dem TKI Cabozantinib war zwar hinsichtlich des PFS positiv, jedoch im OS ohne signifikanten Vorteil bei deutlich höherer Nebenwirkungsrate und ist daher keine Empfehlung für eine Erstlinientherapie.19
Tab. 2: Studien zur Adjuvanz bei lokalisiertem ccRCC mit hohem Rezidivrisiko (modifiziert nach den Onkopedia Leitlinien)13
Zweit- und Folgelinientherapie
Die Auswahl der Therapiesequenz richtet sich massgeblich nach der zuvor erfolgten Therapie. In der Regel kommt ein TKI als Monosubstanz zum Einsatz, der in der vorherigen Therapie nicht eingesetzt wurde. Es kann auch die Kombination aus einem TKI mit einem mTOR-Inhibitor (Lenvatinib/Everolimus) eingesetzt werden. Patient:innen, die in der Erstlinie lediglich mit einer TKI-Monotherapie behandelt wurden, sollten spätestens in der Zweitlinie mit einer Immuntherapie (Nivolumab) behandelt werden.
In mittlerweile zwei veröffentlichten Studien ist die Reexposition eines ICI nach Therapieversagen einer ICI-Kombination in der Erstlinie ohne Benefit hinsichtlich PFS bzw. OS getestet und sollte daher nicht eingesetzt werden.13 Als neue Substanz in der Salvagesituation hat sich mittlerweile Belzutifan, ein HIF-2α-Inhibitor, als Monotherapie etabliert. Belzutifan, ursprünglich als Monotherapie zugelassen für Patient:innen mit Von-Hippel-Lindau-Syndrom, zeigte in der Phase-III-Studie LITESPARK-005 im Vergleich zu Everolimus nach Vortherapie mit einem TKI bzw. ICI im Progress ein verlängertes PFS bei guter Verträglichkeit und sollte den Patient:innen als Option angeboten werden.20
Metastasierter Keimzelltumor desMannes
Der Keimzelltumor des Mannes ist insgesamt eine seltene Entität, jedoch der häufigste Tumor im jungen Alter. Die adäquate, stadiengerechte Therapie der Erkrankung ist daher von hoher Relevanz. Nationale und internationale Leitlinien geben durch Daten gut belegte Therapieempfehlungen. Diese umfassen neben dem richtigen Einsatz von Chemotherapie, Chirurgie und Strahlentherapie auch die Auswahl der erforderlichen Medikamente sowie die Dauer ihrer Anwendung. Diese Empfehlungen müssen auf die jeweilige klinische Situation korrekt angewandt werden, um einen maximalen Therapieerfolg zu erzielen. Eine Übertherapie bei Patient:innen mit guter Heilungsaussicht ist dabei ebenso zu vermeiden wie Therapieverzögerungen und Dosisreduktionen bei Patient:innen mit weit fortgeschrittener Erkrankung. Aktuell ist besonders das metastasierte Seminom im Stadium II einem Paradigmenwechsel unterzogen.21
Seminom Stadium IIA und B
Ab einem Stadium II (Nachweis retroperitonealer Lymphknotenmetastasen) spricht man von einer metastasierten Erkrankung. Diese kann entweder initial auftreten oder in 15–20% aus einem lokalisierten Befund (Stadium I) entstehen.
Lange Zeit war je nach Grösse der Lymphknotenmetastasen entweder eine alleinige Radiotherapie der ipsilateralen paraaortalen Lymphknoten (bevorzugt im Stadium IIA) oder eine Chemotherapie mit drei Zyklen Cisplatin, Etoposid und Bleomycin (PEB) oder alternativ vier Zyklen Cisplatin/Etoposid (EP) der Standard (bevorzugt im Stadium IIB), mit einer 5-Jahres-Überlebensrate von 99%. Vor dem Hintergrund eines exzellenten Langzeitüberlebens steht die Reduktion von Akut- und Langzeittoxizität bei diesen in der Regel sehr jungen Patient:innen im Vordergrund.
Kürzlich wurden die Ergebnisse von insgesamt drei Phase-II-Studien zur primären Resektion der Lymphknoten (primäre RPLND) veröffentlicht. Mit 10–30% sind die Rezidivraten im Vergleich zu den o.g. Therapieverfahren höher, jedoch kann im Umkehrschluss bei etwa 70% der Patient:innen gänzlich auf eine Chemotherapie verzichtet werden – das Auftreten von Langzeittoxizitäten wird damit vermindert.21 Aktuell ist die primäre RPLND ausserhalb von Studien jedoch kein Standard. Die Auswahl geeigneter Patient:innen für einen möglicherweise operativen Therapieansatz sollte, ebenso wie die Wahl erfahrener Operateur:innen, daher ausschliesslich in Zentren mit Expertise erfolgen.
Eine derzeit besser etablierte Alternative zur alleinigen Radio- bzw. Chemotherapie stellt die kombinierte Radio-Chemotherapie mittels Gabe eines Zyklus Carboplatin in Kombination mit einer sogenannten «Involved node»-Bestrahlung analog der Studie SAKK 01/10 dar. In der Studie zeigte sich in der Gesamtpopulation eine hervorragende Rate des ereignisfreien Überlebens (EFS) von knapp 94% nach drei Jahren.22 Die Ergebnisse der Nachfolgestudie SAKK 01/18 mit Intensivierung der Chemotherapie und Gabe von einem Zyklus EP im Stadium IIB sowie Reduktion der Strahlendosis im Stadium IIA und B sind pendent.23
Zusammenfassend gesagt sollten Patient:innen im Stadium II obligat an einem Zentrum mit Expertise vorgestellt und das Therapiekonzept sollte gemeinsam festgelegt werden. Auch die Reevaluation eines tatsächlich vorliegenden Stadiums II ist vor Therapiebeginn bei unsicheren Befunden obligat durchzuführen.
Metastasiertes Prostatakarzinom
Das Prostatakarzinom ist die häufigste Tumorerkrankung des Mannes und steht an zweiter Stelle der krebsbedingten Todesfälle. Es wird zwischen lokalisiertem und metastasiertem Prostatakarzinom differenziert, wobei im metastasierten Stadium zwischen hormonsensitivem und kastrationsrefraktärem Karzinom unterschieden wird. Das Management metastasierter Verläufe hat sich in den letzten Jahren deutlich gewandelt, insbesondere durch neue systemische Therapien, die das Überleben signifikant verlängern konnten.
Grundlage jeglicher Systemtherapie stellt weiterhin die medikamentöse (oder seltener auch chirurgische) Androgendeprivation (ADT) dar. Sie wird für praktisch alle Patient:innen um einen «androgen-rezeptor pathway inhibitor» (ARPI) erweitert.24
Metastasiertes, hormonsensitives Prostatakarzinom
Hochrangige publizierte Studien wie STAMPEDE, LATITUDE, TITAN, ENZAMET, ARCHES und kürzlich ARASENS zeigten einen signifikanten Vorteil einer Therapieintensivierung durch die Kombination von ADT mit einem ARPI, die das radiografische progressionsfreie Überleben (rPFS), das PFS und das Gesamtüberleben (OS) im Vergleich zur Monotherapie mit ADT bei einem metastasierten, hormonsensitiven Prostatakarzinom (mHSPC) verlängern konnte. Eingesetzt werden hierfür Abirateron/Prednison, Enzalutamid, Apalutamid und Darolutamid.
Die Systemtherapie wird bei Patient:innen mit niedriger Tumorlast durch eine lokale Radiatio der Prostata ergänzt. Bei Patient:innen mit metachron metastasierter Erkrankung und niedriger Tumorlast kann auch eine gezielte Bestrahlung bei Oligometastasierung evaluiert werden. Patient:innen mit hoher Tumorlast profitieren zudem von der Hinzunahme einer Chemotherapie mit Docetaxel.24,25
Auf dem diesjährigen ASCO-Kongress wurden erstmalig Daten vorgestellt, die bei Patient:innen mit Defekten in den Genen der homologen Rekombination (HRD) zusätzlich zu ADT und ARPI einen PARP-Inhibitor erhielten. Die Studie (AMPLITUDE) war positiv im primären Endpunkt rPFS. Daten bezüglich OS sind pendent. Eine molekulargenetische Testung sollte bei allen therapiefähigen Patient:innen mit metastasierter Erkrankung möglichst frühzeitig erfolgen.
Metastasiertes, kastrationsrefraktäres Prostatakarzinom
Für Patient:innen mit metastasiertem, kastrationsrefraktärem Prostatakarzinom (mCRPC) sind verschiedene Optionen verfügbar. Nach Behandlung mit einem ARPI wird bevorzugt eine Chemotherapie mit Docetaxel verabreicht. Weitere Therapiemöglichkeiten sind Cabazitaxel nach Docetaxel-Vorbehandlung, eine Radioligandentherapie mit Lutetium-177-PSMA bzw. Radium-223 oder ein PARP-Inhibitor.
Wird von Patient:innen eine Chemotherapie abgelehnt oder sind sie nicht fit genug, ist als Therapie der Wahl die PSMA-Lutetium-Therapie einem ARPI-Wechsel aufgrund von Kreuzresistenzen vorzuziehen, obgleich in der Phase-III-Studie kein signifikanter OS-Benefit gezeigt werden konnte. Hinsichtlich des Einsatzes eines PARP-Inhibitors ist die Wirksamkeit bei Vorliegen einer BRCA1/2-Mutation zweifelsfrei und zeigt entweder als Monotherapie oder in Kombination mit einem ARPI, z.B. Abirateron oder Enzalutamid, nach einer ADT-Monotherapie eine sehr gute Wirksamkeit.
Mittlerweile sind Daten zu drei Studien publiziert. Ob der Einsatz von PARP-Inhibitoren in Kombination mit einem ARPI auch bei Patient:innen mit Defekten in anderen Genen der HRD gerechtfertigt ist, bleibt weiterhin unklar.25
Zusammenfassung
-
Im lokalisierten Stadium eines muskelinvasiven Blasenkarzinoms ist die perioperative Therapie analog der NIAGARA-Studie mit Hinzunahme von Darolutamid zur Cisplatin-basierten Chemotherapie neuer Standard.
-
Im metastasierten Stadium des muskelinvasiven Blasenkarzinoms hat sich die Therapie mit Enfortumab Vedotin und Pembrolizumab etabliert und zeigt auch im Langzeitverlauf eine signifikante Verlängerung des Gesamtüberlebens gegenüber einer Chemotherapie ± Immunerhaltungstherapie.
-
Daten zur adjuvanten Gabe von Pembrolizumab zeigen bei Patient:innen mit ccRCC und hohem Rezidivrisiko nach Resektion im lokalisierten Stadium einen signifikanten Vorteil in DFS und OS.
-
Die Gabe des HIF-2α-Inhibitors Belzutifan zeigt beim metastasierten ccRCC einen signifikanten PFS-Vorteil bei Patient:innen mit Vortherapie bei gleichzeitig guter Verträglichkeit.
-
Bei Patient:innen mit Seminom im Stadium II zeigte eine kombinierte Radio-Chemotherapie sehr gute Effizienzdaten. Auch eine primäre Resektion kann bei selektionierten Patient:innen in Zentren mit Expertise eine Alternative darstellen.
-
Der Einsatz von PARP-Inhibitoren in der Behandlung von Patient:innen mit metastasierter Erkrankung ist besonders wirksam bei Vorliegen einer BRCA1/2-Mutation. Eine molekulargenetische Testung sollte bei allen therapiefähigen Patient:innen daher möglichst frühzeitig erfolgen.
Literatur:
1 Powles TB et al.: Perioperative durvalumab with neoadjuvant chemotherapy in operable bladder cancer. NIAGARA Investigators. N Engl J Med 2024; 391(19): 1773-86 2 ClinicalTrials.gov: NCT04630730. Intravesical recombinant bcg followed by perioperative chemo-immunotherapy for patients with MIBC 3 Zlotta AR et al.: Radical cystectomy vs. trimodality therapy for muscle-invasive bladder cancer: a multi-institutional propensity score matched and weighted analysis. Lancet Oncol 2023; 24(6): 669-81 4Galsky MD et al.: Adjuvant nivolumab in high-risk muscle-invasive urothelial carcinoma: expanded efficacy from CheckMate 274. J Clin Oncol 2025; 43(1): 15-21 5 Apolo A et al.: Adjuvant pembrolizumab vs. observation in muscle-invasive urothelial carcinoma. N Engl J Med 2025; 392(1): 45-55 6 Powles TB et al.: Enfortumab vedotin plus pembrolizumab in untreated locally advanced or metastatic urothelial carcinoma: 2.5-year median follow-up of the phase III EV-302/KEYNOTE-A39 trial. Ann Oncol 2025; S0923-7534(25)00762-8 7 Van der Heijden MS et al.: Nivolumab plus gemcitabin-cisplatin in advanced urothelial carcinoma. N Engl J Med 2023; 389(19): 1778-89 8 Powles TB et al.: Avelumab first-line maintenance for advanced urothelial carcinoma: results from the JAVELIN Bladder 100 trial after >/=2 years of follow-up. J Clin Oncol 2023; 41(19): 3486-92 9 Loriot Y et al.: Phase 3 THOR study: results of erdafitinib (erda) vs. chemotherapy (chemo) in patients (pts) with advanced or metastatic urothelial cancer (mUC) with select fibroblast growth factor receptor alterations (FGFRalt). J Clin Oncol 2023; 41(Suppl.17): Abstr. #LBA4619 10 Powles TB et al.: Enfortumab vedotin in previously treated advanced urothelial carcinoma. N Engl J Med 2021; 384(12): 1125-35 11 Meric-Bernstam F et al.: Efficacy and safety of trastuzumab deruxtecan in patients with HER2-expressing solid tumors: primary results from the DESTINY-PanTumor02 phase II trial. J Clin Oncol 2024; 42(1): 47-58 12 Choueiri TK et al.: Overall survival with adjuvant pembrolizumab in renal-cell carcinoma. N Engl J Med 2024; 390(15): 1359-71 13 Onkopedia Leitlinien: Nierenzellkarzinom (Hypernephrom) 2024 14 Heng D et al.: External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study. Lancet Oncol 2013; 14: 141-8 15 Motzer RJ et al.: Nivolumab plus ipilimumab vs. sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018; 378(14): 1277-90 16 Rini B et al.: Pembrolizumab plus axitinib vs. sunitinib for advanced renal-cell carcinoma. KEYNOTE-426 investigators. N Engl J Med 2019; 380(12): 1116-27 17 Motzer R et al.: Nivolumab plus cabozantinib vs. sunitinib in first-line treatment for advanced renal cell carcinoma (CheckMate 9ER): long-term follow-up results from an open-label, randomised, phase 3 trial. Lancet Oncol 2022; 23(7): 888-98 18 Motzer R et al.: Lenvatinib plus pembrolizumab or everolimus for advanced renal cell carcinoma. CLEAR trial investigators. N Engl J Med 2021; 384(14): 1289-300 19 Choueiri T et al.: Cabozantinib plus nivolumab and ipilimumab in renal-cell carcinoma. COSMIC-313 investigators. N Engl J Med 2023; 388(19): 1767-78 20 Choueiri T et al.: Belzutifan vs. everolimus for advanced renal-cell carcinoma. LITESPARK-005 investigators. N Engl J Med 2024; 391(8): 710-21 21 Onkopedia Leitlinien: Keimzelltumoren des Mannes (Gonadale Keimzelltumoren) 22 Papachristofilou A et al.: Single-dose carboplatin followed by involved-node radiotherapy for stage IIA and stage IIB seminoma (SAKK 01/10): a single-arm, multicentre, phase 2 trial. Lancet Oncol 2022; 23: 1441-50 23 ClinicalTrials.gov: NCT03937843. Reduced intensity radio-chemotherapy for stage iia/b seminoma 24 Gillessen S et al.: Management of patients with advanced prostate cancer. Report from the 2024 Advanced Prostate Cancer Consensus Conference (APCCC). Eur Urol 2025; 87(2): 157-216 25 PEAU Guideline Prostate Cancer. Online unter http://uroweb.org/guideline/prostate-cancer/
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...