Neue Therapieoptionen bei seltenen Kopf-Hals-Tumoren
Autor:
Assoc. Prof. Priv.-Doz. Dr. Thorsten Füreder
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin I
Medizinische Universität Wien
Im Rahmen des diesjährigen Jahreskongresses der American Society of Clinical Oncology (ASCO) standen im Bereich der Kopf-Hals-Tumoren vor allem Studien zu seltenen Tumorentitäten wie dem Nasopharynxkarzinom (NPC) oder Speicheldrüsenkarzinomen im Mittelpunkt. Die präsentierten Studien definieren teilweise einen neuen Standard of Care und werden im folgenden Artikel vorgestellt.
Rezidiviertes/metastasiertes NPC
Jupiter-02-Studie: Immuntherapie mit Toripalimab beim NPC
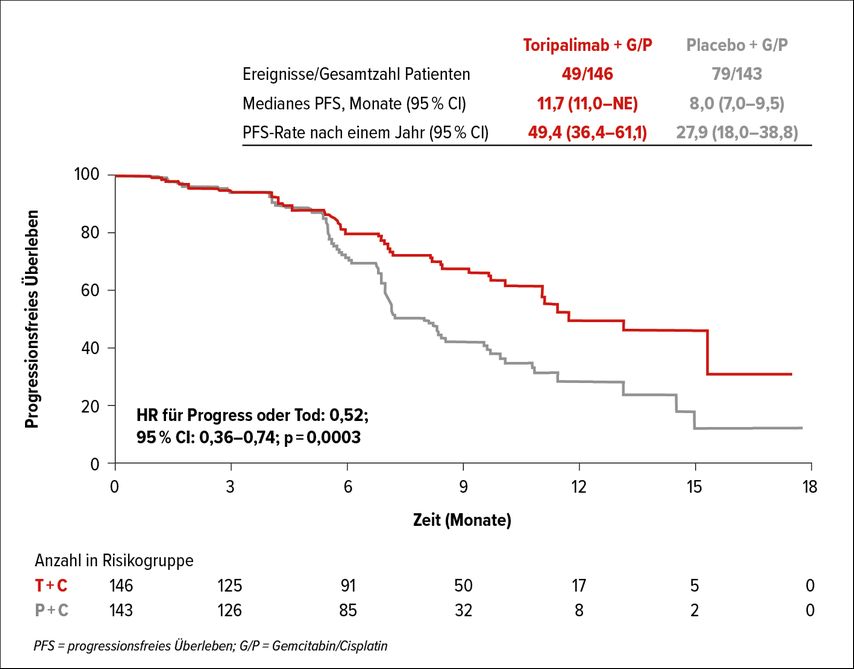
In diese Phase-III-Studie, die in der Plenary Session vorgestellt wurde, wurden 289 Patienten mit rezidiviertem/metastasiertem (R/M) NPC eingeschlossen.1 Nach Randomisierung in zwei Gruppen (143 bzw. 146 Patienten) erhielten die Patienten in der Erstlinie im Standardarm eine Chemotherapie bestehend aus Gemcitabin/Cisplatin (GP) plus Placebo für 6 Zyklen, gefolgt von einer Erhaltungsphase mit Placebo, während die Patienten im experimentellen Arm mit GP in Kombination mit dem PD-1-Checkpoint-Inhibitor Toripalimab therapiert wurden, wobei nach 6 Zyklen Toripalimab als Erhaltungstherapie verabreicht wurde. Der primäre Endpunkt war das progressionsfreie Überleben (PFS), während das Gesamtüberleben (OS), die Ansprechrate (ORR) und die Dauer des Ansprechens (DoR) als sekundäre Studienendpunkte definiert wurden. Hervorzuheben bei der untersuchten Patientenpopulation sei vor allem die Histologie, da 99% der Patienten an WHO-Klasse-II/III-NPC litten und WHO-Klasse-I-Patienten (verhornende Plattenepithelkarzinome) de facto nicht vertreten waren. Der primäre Endpunkt wurde erreicht. Das mediane PFS im GP-plus-Toripalimab-Arm war mit 11,7 Monaten deutlich länger als im GP-Arm mit 8 Monaten (HR: 0,52; 95% CI: 0,36–0,74; p=0,0003) (Abb. 1). Alle Subgruppen inklusive Patienten mit einer hohen Epstein-Barr-Virus(EBV)-DNA-Last (HR: 0,46; 95% CI: 0,3–0,72) oder PD-L1-negative Patienten (HR: 0,35; 95% CI: 0,15–0,81) profitierten von der zusätzlichen Immuntherapie. Das OS war jedoch noch nicht statistisch signifikant unterschiedlich (HR: 0,603; 95% CI: 0,364–0,997; p=0,0462), wobei eine längere Nachbeobachtungszeit abgewartet werden muss. Sowohl die ORR (77,4% vs. 66,4%) als auch die DoR (10 Monate vs. 5,7 Monate) imponierten im experimentellen Arm höher bzw. länger. In Hinblick auf das Nebenwirkungsprofil fanden sich keine neuen Signale, die nicht bereits von anderen Chemo/Immuntherapie-Studien berichtet wurden und uns im klinischen Alltag gut bekannt sind.
Abb. 1: Progressionsfreies Überleben unter Gemcitabin/Cisplatin vs. Gemcitabin/Cisplatin plus Toripalimab (nach Xu et al.)1
Captain-1st-Studie: Checkpoint-Blockade mit Camrelizumab beim NPC
Das Studiendesign, die Patientenpopulation und die Fragestellung der Captain-1st-Studie2 sind mit der Jupiter-02-Studie vergleichbar: Patienten mit R/M NPC erhielten in der Erstlinie entweder den PD-1-Inhibitor Camrelizumab plus GP für 4–6 Zyklen (134 Patienten), gefolgt von Camrelizumab-Erhaltungstherapie, oder GP in Kombination mit Placebo (129 Patienten). Primärer Endpunkt war das PFS. Es wurden hauptsächlich WHO-Klasse-II/III-Patienten eingeschlossen. Das mediane PFS im GP+Camrelizumab-Arm war mit 10,8 Monaten deutlich länger als im GP-Arm mit 6,9 Monaten (HR: 0,51; 95% CI: 0,37–0,69; p<0,0001).
Alle Subgruppen profitierten von der zusätzlichen Immuntherapie, wobei der PD-L1-Status nicht präsentiert wurde. Die DoR betrug in der Camrelizumab+GP-Gruppe 9,9 Monate und im Standardarm 5,7 Monate. Das OS war noch nicht statistisch signifikant unterschiedlich (Median nicht erreicht vs. 22,6 Monate; HR: 0,67; 95% CI: 0,41–1,11). In Hinblick auf das Nebenwirkungsprofil sei auf eine Besonderheit von Camrelizumab hingewiesen: Bei bis zu 60% der Patienten traten Grad-1/2-„reactive capillary hemangiomas“ (RCEP) auf. RCEP stellen eine (harmlose) immun-mediierte dermatologische Nebenwirkung dar, die durch Proliferation der Endothelzellen in den Kapillaren charakterisiert ist.
Relevanz für die klinische Praxis
Die beiden oben dargestellten Studien zeigen, dass Immuntherapie in Kombination mit Chemotherapie das Outcome von R/M-NPC-Patienten verbessern kann. Die direkte Anwendung dieser Ergebnisse in unserer klinischen Praxis ist jedoch aus mehreren Gründen nicht zu empfehlen:
-
Die untersuchten Checkpoint-Inhibitoren Toripalimab und Camrelizumab sind zwar in Asien zugelassen, jedoch in Europa/in den USA nicht verfügbar. Die Anwendung von verfügbaren Checkpoint-Inhibitoren wie Pembrolizumab oder Nivolumab in Kombination mit GP ist mangels Evidenz nicht zu rechtfertigen.
-
In beiden Studien zeigt sich ein PFS-Vorteil erst ab 6 Monaten. Zu diesem Zeitpunkt wurde die Chemotherapie beendet und die Immuntherapie als Erhaltungstherapie verabreicht, weshalb sich die Frage stellt, ob eine Erhaltungstherapie mit Gemcitabin – wie in der klinischen Routine häufig angewendet – nicht einen besseren Vergleichsarm dargestellt hätte. Jedenfalls konnte ein OS-Vorteil (noch) nicht gezeigt werden. Spannender wären daher aus europäischer Perspektive Studien mit OS als primärem Endpunkt und einer etablierten Substanz wie Nivolumab. Leider ist die entsprechende Studie derzeit „on hold“ (NCT04458909) und der Studienstatus unklar.
-
Da das NPC in Asien endemisch ist und in Europa/in den USA zu den seltenen Tumorentitäten zählt, müssen wir die in Asien generierten Daten nolens volens seit Jahren extrapolieren. Dieses Vorgehen ist zwar in den Leitlinien (siehe aktuelle ESMO-NPC-Leitlinien 2020) abgebildet, dennoch sei nochmals auf die Unterschiede in der Tumorbiologie und Histologie hingewiesen: In der westlichen Welt betreffen bis zu 30% der NPC WHO-Klasse-I-Patienten (EBV-negativ), die wie bereits erwähnt in den asiatischen Studien kaum repräsentiert sind.
Lokal fortgeschrittenes NPC
Metronomisches Capecitabin als adjuvante Therapie des lokal fortgeschrittenen NPC
Während der ASCO-2021-Konferenz wurden die Daten einer randomisierten Phase-III-Studie vorgestellt, die den Stellenwert von adjuvanter metronomischer Capecitabin-Therapie für 1 Jahr beim lokal fortgeschrittenen (LA) Hochrisiko-NPC nach Abschluss von kurativer Radiochemotherapie im Vergleich zur Observanz untersuchte.3 Der primäre Endpunkt war das „failure free survival“ (FFS) nach 3 Jahren, sekundäre Endpunkte umfassten OS, lokoregionäres FFS und das „distant“ FFS (D-FFS). Es wurden jeweils 204 bzw. 202 Patienten eingeschlossen. Hervorzuheben bei der Patientenpopulation ist, dass ca. 77% der Patienten eine Induktionschemotherapie erhalten hatten und ca. 80% der Patienten bilaterale zervikale oder >6cm große Lymphknotenmetastasen aufwiesen.
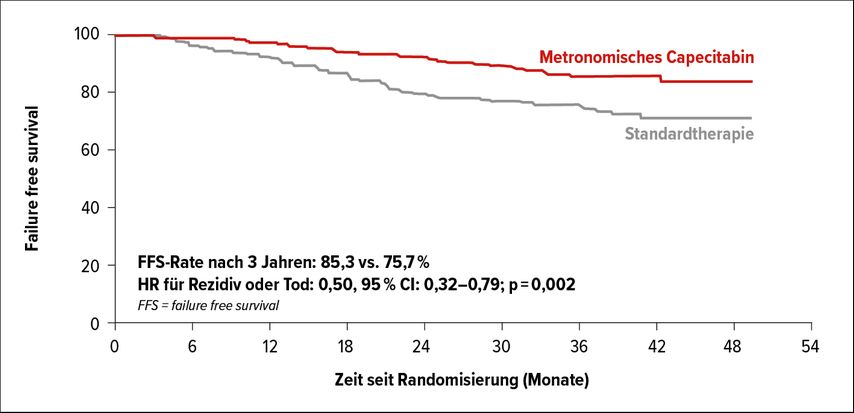
Die Studie erreichte alle Endpunkte. Metronomische Gabe von Capecitabin verbessert signifikant im Vergleich zur Observanz das FFS (85,3% vs. 75,7%; HR: 0,5; 95% CI: 0,32–0,79; p=0,002) (Abb. 2), das OS (93,3% vs. 88,6%; HR: 0,44; 95% CI: 0,22–0,88; p=0,018), das D-FFS (89,4% vs. 82,1%) und das lokoregionäre FFS (92,6% vs. 87,8%). Es profitieren alle untersuchten Subgruppen. Das Nebenwirkungsprofil ist günstig, wobei vor allem das Hand-Fuß-Syndrom im Vordergrund steht.
Abb. 2: „Failure free survival“ unter metronomischem Capecitabin vs. Observanz bei kurativ behandelten Patienten mit lokal fortgeschrittenem NPC (nach Ma et al.)3
Standarddosis Capecitabin als adjuvante Therapie des LA NPC
Im Gegensatz zur vorherigen Studie wurde in dieser randomisierten Phase-III-Studie eine Standarddosis Capecitabin für 8 Zyklen als adjuvante Therapie im Vergleich zu Observanz bei LA-NPC-Patienten gewählt.4 Als Einschlusskriterium diente nicht nur die TNM-Klassifikation zur Definition einer Hochrisikosituation, sondern auch hohe EBV-DNA-Last, das Tumorvolumen oder der „SUV“-Wert, der mittels PET-CT bestimmt wurde. Patienten, die eine Induktionschemotherapie erhielten, waren in dieser Studie nicht inkludiert. Als primärer Endpunkt wurde das FFS nach 3 Jahren, als sekundäre Endpunkte OS, lokoregionäres RFS und fernmetastasenfreies Überleben (DMFS) definiert.
Der primäre Endpunkt wurde erreicht: Das FFS der Capecitabin-Gruppe war der Observanz-Gruppe überlegen (87,7% vs. 73,3%; HR: 0,52; 95% CI: 0,29–0,97; p=0,037). Die sekundären Endpunkte waren nicht signifikant unterschiedlich zwischen den beiden Gruppen, wobei Capecitabin eine verträgliche Therapie darstellt.
Relevanz für die klinische Praxis
Die Standardtherapie von lokal fortgeschrittenen (LA) Hochrisiko-NPC-Patienten stellt eine kurative Radiochemotherapie (RCT) entweder (und bevorzugt) nach vorheriger Induktionschemotherapie (IC) oder gefolgt von adjuvanter Chemotherapie dar. Spannend und von klinischer Relevanz sind jedenfalls die Daten mit adjuvantem metronomischem Capecitabin. Durch eine gut verträgliche Therapieintensivierung kann bei Hochrisikopatienten, die eine IC gefolgt von RCT erhalten haben, das Rezidivrisiko gesenkt und das Gesamtüberleben gesteigert werden.
Die Toxizität von klassischer adjuvanter Chemotherapie (Cisplatin/5FU) ist beträchtlich, vor allem vor dem Hintergrund der vorherigen Radiochemotherapie, weshalb ca. ein Drittel der Patienten diese Strategie nicht toleriert. Aus diesem Grunde ist die Strategie, dass eine Standarddosis Capecitabin das Rezidivrisiko senken kann, in einer Population, die keine Induktionschemotherapie erhalten hat, ebenfalls interessant.
Neben der bereits oben diskutierten beschränkten Gültigkeit dieser Ergebnisse für eine westliche NPC-Patientenpopulation erscheint das fast idente FFS (85% und 87%) in den experimentellen Armen der beiden Studien ungewöhnlich: Es ist vorerst nicht erklärbar, warum Patienten, die IC + RCT gefolgt von metronomischem Capecitabin erhielten, dasselbe FFS haben wie Patienten, die „nur“ RCT + Capecitabin erhielten. Zusätzlich scheint die Standardtherapiegruppe vor allem in der Studie mit metronomischem Capecitabin im Vergleich zu früheren Studien, die die IC etabliert hatten, deutlich schlechter zu sein. Andererseits waren die Patientenpopulationen der genannten Studien unterschiedlich und direkte Vergleiche verschiedener Studien sind kaum zulässig.
Rezidivierte/metastasierte Speicheldrüsenkarzinome
Duale Checkpoint-Blockade mit Nivolumab plus Ipilimumab bei Speicheldrüsenkarzinomen
Während im Rahmen der ASCO-Konferenz 2019 die (etwas enttäuschenden) Ergebnisse dieser Phase-II-Studie im Bereich der adenoidzystischen Speicheldrüsenkarzinome (SGC) präsentiert wurden, wurden nun die Daten von 32 Patienten mit R/M nicht adenoidzystischen SGC gezeigt.5 Die Patienten, die zum Großteil (78%) vorbehandelt waren, erhielten Nivolumab in Kombination mit Ipilimumab bis zur Progression oder zum Auftreten von höhergradiger Toxizität. Primärer Endpunkt war die ORR. Dieser Endpunkt wurde erreicht, da bei 16% der Patienten ein Ansprechen detektiert werden konnte. Hervorzuheben ist, dass bei der Subgruppe der Speicheldrüsengangkarzinome (SDC) die ORR 25% betrug. Leider konnte kein eindeutig prädiktiver Biomarker mittels RNA-Sequenzierung identifiziert werden.
Relevanz für die klinische Praxis
Die Immuntherapie mittels Checkpoint-Inhibitoren ist in der heterogenen Gruppe der SGC weder zugelassen noch etabliert. Die Datenlage (KEYNOTE 28 und NISCAHN-Studien) zur Wirksamkeit von Pembrolizumab in PD-L1-positiven SGC bzw. Nivolumab ist dünn und zeigte bis dato enttäuschende Ergebnisse. Aus diesem Grunde ist das positive Signal der oben beschriebenen Studie mit Ipilimumab plus Nivolumab vor allem in der Subgruppe der SDC erfreulich. Es sei betont, dass SDC eine höhere Rate an Immunzellinfiltration und Tumormutationslast (TMB) aufweisen als andere SGC-Subtypen. Eine Empfehlung zur Anwendung von Ipilimumab/Nivolumab bei SDC in der klinischen Praxis erscheint zwar aufgrund der geringen Fallzahl und des fehlenden Biomarkers auf den ersten Blick kaum gerechtfertigt. Andererseits sei nochmals darauf hingewiesen, dass es sich bei SGC um eine sehr seltene Tumorentität handelt und randomisierte Studien mit hohen Fallzahlen in naher Zukunft nicht zu erwarten sind.
Zusammenfassung
Kurz zusammengefasst lassen sich aus den in diesem Jahr präsentierten Studien im Bereich der Kopf-Hals-Tumoren folgende Erkenntnisse für den klinischen Alltag ableiten:
-
Die Immuntherapie in Kombination mit Chemotherapie ist bei R/M NPC in der Erstlinie vielversprechend, wobei vor dem Einsatz in der klinischen Routine neben der Verfügbarkeit der Substanzen ein OS-Vorteil gezeigt werden muss.
-
Adjuvantes metronomisches Capecitabin könnte einem Hochrisikopatienten mit EBV-positivem LA NPC nach kurativer Therapie im klinischen Alltag angeboten werden.
-
Adjuvantes Standarddosis-Capecitabin senkt das Rezidivrisiko bei Hochrisikopatienten mit LA NPC, die keine IC erhalten haben, wobei ein OS-Vorteil nicht belegt ist und der Einsatz in der klinischen Routine daher abgewartet werden sollte.
-
Nivolumab plus Ipilimumab ist vor allem bei Speicheldrüsengangkarzinomen vielversprechend. Prädiktive Biomarker für das Ansprechen auf die Immuntherapie werden jedenfalls in der heterogenen Gruppe der SGC dringend benötigt.
Literatur:
1 Xu R et al.: JUPITER-02: randomized, double-blind, phase III study of toripalimab or placebo plus gemcitabine and cisplatin as first-line treatment for recurrent or metastatic nasopharyngeal carcinoma (NPC). ASCO 2021; Abstr. #LBA2 2 Zhang L et al.: Camrelizumab versus placebo combined with gemcitabine and cisplatin for recurrent or metastatic nasopharyngeal carcinoma: A randomized, double-blind, phase 3 trial. ASCO 2021, Abstr. #6000 3 Ma J et al.: Metronomic capecitabine as adjuvant therapy in locoregionally advanced nasopharyngeal carcinoma: a phase 3, multicenter, randomized controlled trial. ASCO 2021, Abstr. #6003 4 Miao J et al.: Adjuvant capecitabine in locoregionally advanced nasopharyngeal carcinoma: A multicenter randomized controlled phase III trial. ASCO 2021, Abstr. #6005 5 Burmann B et al.: A phase II trial cohortof nivolumab plus ipilimumab in patients (Pts) with recurrent/metastatic salivary gland cancers (R/M SGCs). ASCO 2021, Abstr. #6002
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...