Neue Studienergebnisse aus San Antonio
Bericht:
Dr. Ine Schmale
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die individuelle Behandlung des Mammakarzinoms ist im klinischen Alltag bereits weit fortgeschritten. Dennoch rezidivieren Tumoren und Patient:innen sterben an ihrer Erkrankung. Auch die Entwicklung von effektiven Therapien geht weiter und vermag die Prognose der Betroffenen zu verbessern. Im Folgenden werden neue Daten zur klinischen Brustkrebsforschung vom San Antonio Breast Cancer Symposium vorgestellt.
Metastasiertes HER2+ Mammakarzinom
Dreifache HER2-gerichtete Erhaltungstherapie verlängert PFS
Als Standard der Erstlinientherapie erhalten Betroffene mit HER2-positivem (HER2+) metastasierten Mammakarzinom eine Taxan-haltige Induktionschemotherapie in Kombination mit einer dualen Anti-HER2-Blockade (Trastuzumab plus Pertuzumab), gefolgt von einer Erhaltungstherapie mit den beiden HER2-gerichteten Antikörpern. Die Phase-III-Studie HER2CLIMB-05 untersuchte placebokontrolliert die zusätzliche Gabe von Tucatinib, einem hochselektiven HER2-Tyrosinkinaseinhibitor (TKI), zusätzlich zur Trastuzumab/Pertuzumab-Erhaltungstherapie. In die Studie wurden insgesamt 654 Patient:innen mit HER2+ metastasiertem Brustkrebs eingeschlossen, die nach 4–8 Zyklen der Induktionstherapie keinen Krankheitsprogress aufwiesen.1 Die eingeschlossenen Patient:innen waren median 54 Jahre alt mit 69–70% De-novo-Tumoren in beiden Therapiearmen. Der Hormonrezeptorstatus war bei 52–54% der Patient:innen positiv. Primärer Studienendpunkt war das progressionsfreie Überleben (PFS) laut Prüfarztbericht.
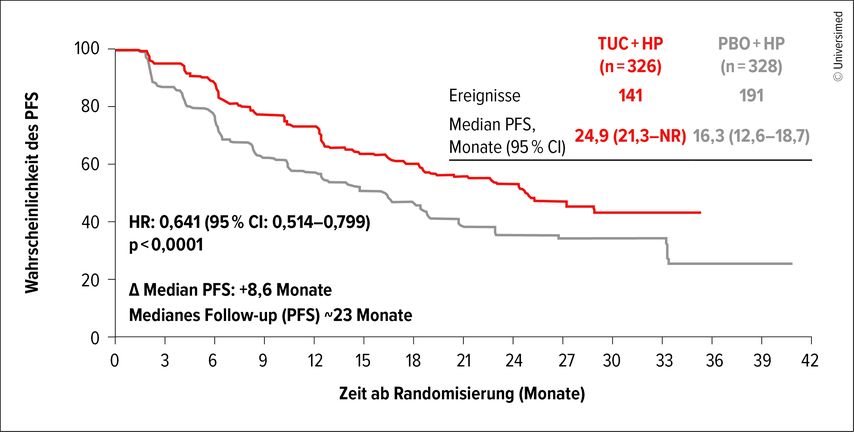
Mit einer medianen Nachbeobachtungszeit von etwa 23 Monaten lag das mediane PFS bei 24,9 Monaten im Tucatinib-Arm versus 16,3 Monate im Placebo-Arm (Abb.1). Das Risiko für einen Krankheitsprogress wurde um 36% reduziert (HR: 0,64; 95% CI 0,51–0,80; p<0,0001). Der PFS-Vorteil mit Tucatinib wurde in allen präspezifizierten Subgruppen gesehen. Das Gesamtüberleben (OS) zeigte einen numerischen Vorteil mit einer Hazard-Ratio (HR) von 0,54 und einem 95%igen Konfidenzintervall (95% CI) von 0,30–0,96 (p=0,0320). Der Median für das OS war in beiden Studienarmen mit 18 versus 33 Ereignissen noch nicht erreicht. In einer explorativen Analyse wurde gezeigt, dass Erkrankte mit Hirnmetastasen zum Studieneinschluss im Median ein nahezu doppelt so langes PFS erreichten, wenn sie anstelle von Placebo Tucatinib erhielten (medianes PFS: 8,5 vs. 4,3; HR: 0,72; 95% CI 0,406–1,273). Das Sicherheitsprofil war handhabbar, mit erhöhten Raten an Diarrhö, Übelkeit sowie häufiger erhöhten Leberwerten im Vergleich zwischen experimentellem Arm und Kontrollarm.
Abb. 1: Progressionsfreies Überleben (PFS) unter Tucatinib plus Trastuzumab und Pertuzumab versus Placebo plus Trastuzumab und Pertuzumab (modifiziert nach Hamilton E)1
Die Autor:innen schlussfolgerten, dass die Erstlinien-Erhaltungstherapie mit Trastuzumab plus Pertuzumab sowie Tucatinib eine verbesserte Therapieoption für Patient:innen mit HER2+ metastasiertem Mammakarzinom darstellt. Die erweiterte Therapie biete die Möglichkeit, den Krankheitsprogress hinauszuzögern und die chemotherapiefreie Zeit zu verlängern.
HR+, HER2– Mammakarzinom
Effektive adjuvante Therapie mit selektivem Östrogenrezeptor-Degrader
Mehr als zwei Drittel der frühen Mammakarzinome sind Östrogenrezeptor-positiv (ER+) und HER2-negativ (HER2–) und werden standardmäßig mit einer endokrinen Therapie und einem CDK4/6-Inhibitor behandelt. Eine neue Therapieoption ist mit Giredestrant in der klinischen Entwicklung. Es handelt sich um einen oralen selektiven Östrogenrezeptor-Degrader (SERD) der nächsten Generation, der mit dem Ziel entwickelt wurde, den ER-Signalweg anhaltend zu inhibieren, sowohl Liganden-abhängig als auch Liganden-unabhängig. In der randomisierten, offenen Phase-III-Studie lidERA erhielten 470 Erkrankte mit ER+/HER2– Mammakarzinom in den Stadien I–III Giredestrant oder eine endokrine Standardtherapie.2 Eingeschlossen wurden 4170 prä- oder postmenopausale Betroffene, die innerhalb der letzten 12 Monate operiert worden waren. Primärer Studienendpunkt war das Überleben frei von invasiver Erkrankung (IDFS).
Das mediane Alter der Studienteilnehmer:innen lag bei 54 Jahren und 99,5% waren Frauen. Bei 69% der Patient:innen lag ein hohes Rezidivrisiko vor, ca. 80% wurden bereits mit einer Chemotherapie behandelt. Mit einer medianen Nachbeobachtungszeit von 32 Monaten wurde ein statistisch signifikanter und klinisch relevanter IDFS-Vorteil im Giredestrant- gegenüber dem Kontrollarm beobachtet (HR: 0,70; 95%-CI 0,57–0,87; p=0,0014). Nach 3 Jahren lebten 92,4% versus 89,6% der Patient:innen ohne invasive Erkrankung. Der Vorteil wurde über alle präspezifizierten Subgruppen gesehen. Auch das Risiko für das Auftreten von Metastasen war im Giredestrant-Arm gegenüber der Kontrolle um 31% reduziert (HR: 0,69; 95%-CI 0,54–0,89). Die Ergebnisse zum OS waren mit 57 gegenüber 71 Ereignissen noch unreif, ein Trend mit Vorteil für Giredestrant bildete sich bereits ab (HR: 0,79; 95%-CI 0,56–1,12; p=0,1863). Das Sicherheitsprofil war bezüglich der Inzidenz von Nebenwirkungen vergleichbar. Es brachen 5,3% versus 8,2% der Patient:innen die Therapie aufgrund von Nebenwirkungen ab.
Seit der Zulassung der Aromataseinhibitoren sei lidERA die erste Studie, die den Nutzen einer neuen endokrinen Therapie beim frühen Mammakarzinom zeigen konnte, bemerkten die Autor:innen. Insgesamt deuten die Ergebnisse auf das Potenzial von Giredestrant für eine neue Standardtherapie bei Patient:innen mit HR+/HER2– frühem Brustkrebs hin.
Klinisch bedeutsame OS-Verbesserung mit Imlunestrant bei fortgeschrittener Erkrankung
Auch Imlunestrant ist ein oraler SERD der nächsten Generation. Dieser Hirn-penetrierende, reine Östrogenrezeptor-Antagonist zeigte in der Phase-III-Studie EMBER-3 einen Vorteil gegenüber endokriner Standardtherapie bei Patient:innen mit fortgeschrittenem ER+/HER2– Brustkrebs. Beim SABCS wurden aktualisierte Ergebnisse der dreiarmigen Studie präsentiert.3
Die EMBER-3-Studie verglich 1:1:1- randomisiert Imlunestrant versus Fulvestrant oder Exemestan versus Imlunestrant plus Abemaciclib bei insgesamt 874 Patient:innen. Die drei primären Studienendpunkte waren das Prüfarzt-basierte PFS von Imlunestrant versus eine endokrine Standardtherapie bei Patient:innen mit ESR1-Mutation sowie bei allen Patient:innen und zudem Imlunestrant plus Abemaciclib versus Imlunestrant bei allen Patient:innen.
Mit einer medianen Nachbeobachtungszeit von bis zu 27,6 Monaten wurde das Erreichen der primären Endpunkte bestätigt. Im Median betrug das PFS bei Patient:innen mit ESR1-Mutation 5,5 Monate (Imlunestat) versus 3,8 Monate (endokrine Standardtherapie) (HR: 0,62; 95% CI: 0,47–0,82; p=0,0007). Bei diesen Patient:innen wurde das OS (sekundärer Endpunkt) mit Imlunestrant auf 34,5 Monate (vs. 23,1 Monate) verlängert (HR: 0,60; 95% CI: 0,43–0,86) (Abb.2). Nach 24 Monaten lag die OS-Rate bei 64% versus 49%. Als explorativer Endpunkt wurde im Vergleich von Imlunestrant mit endokriner Therapie (ESR1-mutierte Population) die Zeit bis zu einer Chemotherapie untersucht. Nach 24 Monaten waren 45% versus 25% der Patient:innen ohne Chemotherapie (HR: 0,66; 95%-CI 0,48–0,92).
Abb. 2: Gesamtüberleben (OS) unter Imlunestrant versus endokrine Therapie bei Patient:innen mit ESR1-Mutation (modifiziert nach Jhaveri KL)3
Der Vergleich von Imlunestrant mit versus ohne Abemaciclib resultierte auch mit längerer Nachbeobachtungszeit in einem signifikant verlängerten PFS unter der Kombinationstherapie (HR: 0,59; 95%-CI 0,47–0,74; p<0,0001). Der Median lag bei 19,9 Monaten versus 5,5 Monate und die 24-Monats-PFS-Rate bei 26% versus 13%. Waren Patient:innen mit einem CDK4/6-Inhibitor vorbehandelt, betrug das mediane PFS unter Imlunestrant plus Abemaciclib 9,1 und unter Imlunestrant-Monotherapie 3,7 Monate (HR: 0,53; 95%-CI 0,40–0,69). In den beiden Studienarmen lebten nach 24 Monaten 23% versus 9% ohne Krankheitsprogress.
Der PFS-Vorteil durch die zusätzliche Abemaciclib-Therapie wurde sowohl bei Patient:innen mit als auch ohne ESR1-Mutation sowie mit oder ohne PI3K-Signalwegs-Alteration oder beiden beobachtet. Ein OS-Unterschied zwischen den beiden Imlunestrant-haltigen Therapiearmen erreichte mit einer medianen Nachbeobachtungszeit von 27,1 Monaten keine statistische Signifikanz (HR: 0,82; 95%-CI 0,59–1,16). Die Kaplan-Maier-Kurven begannen sich aber nach 24 Monaten zu separieren. Der Median war unter der Kombinationstherapie noch nicht erreicht und betrug 34,4 Monate mit alleinigem Imlunestrant.
Das Fazit der Autor:innen: Imlunestrant bietet als Monotherapie oder in Kombination mit Abemaciclib eine orale, chemotherapiefreie Therapieoption nach Krankheitsprogress unter endokriner Therapie für Patient:innen mit fortgeschrittenem ER+/HER2– Mammakarzinom.
Sacituzumab Govitecan in der ersten Therapielinie
Beim SABCS wurden auch die primären Ergebnisse der randomisierten Phase-III-Studie ASCENT-07 vorgestellt.4 Patient:innen mit HR+ HER2– Mammakarzinom erhielten das Trop2-gerichtete Antikörper-Wirkstoff-Konjugat (ADC) Sacituzumab Govitecan oder eine Therapie nach Wahl des Behandlers. Die Tumoren waren metastasiert oder lokal fortgeschritten und nicht resektabel. Eingeschlossen wurden 690 Patient:innen (99% Frauen), die mindestens eine endokrine Therapie erhalten hatten und Kandidat:innen für eine Erstlinienchemotherapie waren. Die Mehrzahl der Betroffenen hatte bereits einen CDK4/6-Inhibitor in vorangegangenen Therapielinien erhalten und 57–60% waren im (neo)adjuvanten Setting mit einer Chemotherapie behandelt worden. Die Patient:innen erhielten 2:1-randomisiert Sacituzumab Govitecan oder im Kontrollarm Capecitabin, Paclitaxel oder nab-Paclitaxel. Primärer Studienendpunkt war das PFS laut einem geblindeten, unabhängigen, zentralen Reviewkomitee (BICR).
Im Ergebnis betrug das mediane PFS (laut BICR) in beiden Studienarmen 8,3 Monate (HR: 0,85; 95% CI: 0,69–1,05; p=0,130). Nach 6 Monaten lag die PFS-Rate bei 71% versus 64% und nach 12 Monaten bei 40% versus 37%. Laut Prüfarztbericht gab es einen numerischen PFS-Vorteil mit Sacituzumab Govitecan gegenüber der Kontrollmedikation. Der Median lag demnach bei 8,4 Monaten versus 6,4 Monate mit einer HR von 0,78 und einem 95% CI von 0,64–0,93 (p=0,008). Mit einer 27%igen Reife der Ergebnisse war das mediane OS in beiden Armen noch nicht erreicht. Obwohl 61% der Patient:innen des Kontrollarms als nachfolgende Therapie einen ADC erhielten, war ein Trend mit OS-Vorteil für den Sacituzumab-Govitecan-Arm erkennbar (HR: 0,72; 95% CI: 0,54–0,97; p=0,029). Es sprachen 37% versus 33% der Patient:innen auf die Studienmedikation an, mit einer Dauer des Ansprechens (DOR) von 12,1 Monaten unter Sacituzumab Govitecan versus 9,3 Monate unter der Kontrollmedikation. Die Nebenwirkungen entsprachen den bekannten Sicherheitsprofilen. Es brachen 3% versus 7% der Patient:innen die Therapie aufgrund von therapieassoziierten Nebenwirkungen ab.
Die ASCENT-07-Studie erreichte den primären Endpunkt nicht. Sacituzumab Govitecan bleibe aber auf Basis der Ergebnisse der TROPiCS-02-Studie ein Therapiestandard für das metastasierte HR+/HER2– Mammakarzinom nach vorangegangener endokriner Therapie und Chemotherapie, so das Fazit der Autor:innen.
Quelle:
San Antonio Breast Cancer Symposium (SABCS) 2025, 9.–12. Dezember 2025, San Antonio, Texas (USA)
Literatur:
1 Hamilton E et al.: HER2CLIMB-05: A randomized, double-blind, phase 3 study of tucatinib versus placebo in combination with trastuzumab and pertuzumab as maintenance therapy for HER2+ metastatic breast cancer. SABCS 2025, Abstr. #GS1-01 2 Bardia AL et al.: Giredestrant vs standard-of-care endocrine therapy as adjuvant treatment for patients with estrogen receptor-positive, HER2-negative early breast cancer: results from the global phase III lidERA breast cancer trial. SABCS 2025, Abstr. #GS1-10 3 Jhaveri KL et al.: Imlunestrant with or without abemaciclib in advanced breast cancer: updated efficacy results from the phase 3 EMBER-3 trial. SABCS 2025, Abstr. #GS3-08 4 Jhaveri KL et al.: Sacituzumab govitecan vs chemotherapy as first therapy after endocrine therapy in HR+/HER2- (IHC 0, 1+, 2+/ISH-) metastatic breast cancer: Primary results from ASCENT-07. SABCS 2025, Abstr. #GS1-09
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...
%20unter%20Imlunestrant.jpg)


