Neue Standards bei Lymphomtherapie
Autorin:
Prof. Dr. med. Felicitas Hitz
Onkologie/Hämatologie
Kantonsspital St.Gallen
E-Mail: felicitas.hitz@kssg.ch
Nebst den jährlich wiederkehrenden internationalen Kongressen in Europa und Nordamerika reisten 2023 insbesondere an Lymphomen interessierte Kliniker:innen und Forschende zum ICML in Lugano. Die wichtigsten Ergebnisse der Präsentationen und Publikationen zu den Therapiekonzepten mit CAR-T-Zellen, bispezifischen Antikörpern bei follikulären und aggressiven Lymphomen, die Bedeutung der Ergebnisse von Studien mit Checkpoint-Inhibitoren bei Hodgkin-Lymphomen und einem längst erwarteten Studienergebnis zu peripher mediastinalen B-Zell-Lymphomen werden im nachfolgenden Artikel erläutert.
Keypoints
-
CAR-T-Zell-Behandlung wird ein Standard im Frührezidiv bei aggressiven Lymphomen und löst damit die Salvagetherapie mit autologer Stammzelltransplantation ab.
-
Bispezifische Antikörper ergänzen insbesondere bei follikulären Lymphomen die chemotherapiefreien Behandlungskonzepte im Rezidiv.
-
Brentuximab Vedotin kombiniert mit modifiziertem BEACOPP (BrECADD) ist ein Therapiestandard bei fortgeschrittenem HL, insbesondere bei Patient:innen <60 Jahren.
-
Checkpoint-Inhibitoren bei Hodgkin-Lymphomen sollten in der Kombination mit einer Salvagechemotherapie vor autologer Stammzelltransplantation diskutiert werden.
-
Mediastinale Bestrahlung ist beim PMBCL und bei kompletter metabolischer Remission DS 1–3 nach Immunchemotherapie nicht indiziert.
Follikuläres Lymphom
Die Erstlinienbehandlung der fortgeschrittenen follikulären Lymphome mit chemotherapiefreien Regimen hat sich seit der RELEVANCE-Studie etabliert. Die Studie konnte auch in der 6-Jahres-Analyse zeigen, dass Rituximab+Lenalidomid (R2) gefolgt von Rituximab-Erhaltungstherapie im Vergleich zu einer R-Chemotherapie nicht unterlegen ist. Die Rate des progressionsfreien Überlebens (PFS) über sechs Jahre liegt bei 60% resp. 59% (HR: 1,03; 95% CI: 0,84–1,27).1
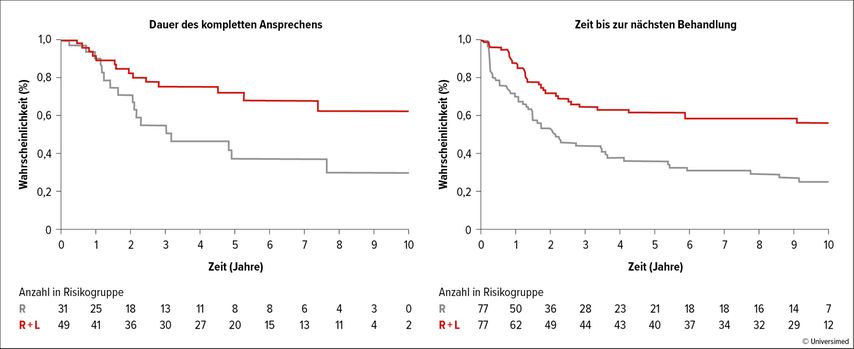
Die Phase-II-Studie SAKK35/10 vergleicht Rituximab alleine mit der Kombination Rituximab+Lenalidomid, allerdings in einem verkürzten Regime im Vergleich zu R2 in der RELEVANCE-Studie. AmASH-Kongress 2023 konnten die Langzeitdaten der Studie vorgestellt werden. Während die Gesamtüberlebensrate der beiden Behandlungsarme nach zehn Jahren bei 77% vs. 78% liegt, ist das mediane PFS für die Patient:innen im Kombinationsarm im Vergleich zu Rituximab alleine 9,3 vs. 2,3 Jahre (HR: 0,58; 95% CI: 0,37–0,89; p=0,0013; Abb. 1).2
Abb. 1: Langzeitergebnisse der Studie SAKK 35/10 mit Rituximab (R) und Rituximab+Lenalidomid (R+L, modifiziert nach Zucca E et al.2)
Die neuen Substanzen wie die bispezifischen Antikörper (Mosunetuzumab, Epcoritamab), die CD3 auf der T-Zelle und CD20 auf der B-Zelle miteinander verbinden und so zur Apoptose der malignen B-Zelle führen, wurden mit den Ergebnissen der im Rezidiv behandelten Patient:innen präsentiert.
Für die Behandlung mit Mosunetuzumab, einem intravenös verabreichten bispezifischen Antikörper, wurden bereits die Verlaufsdaten über drei Jahre der Monotherapie mit Mosunetuzumab beim rezidivierten follikulären Lymphom (FL) in einer multizentrischen Phase-II-Studie gezeigt.3 Die Behandlung mit Mosunetuzumab war auf maximal 17 Zyklen terminiert, wobei Patient:innen mit einer kompletten Remission nach acht Zyklen die Behandlung vorzeitig beenden konnten. Nach einer medianen Verlaufsbeobachtung von 37 Monaten zeigte sich ein anhaltendes Ansprechen mit einem medianen PFS von 24 Monaten (95% CI: 12,0–NR) und im Median 37,3 Monaten (95% CI: 18,0–NR) bis zur nächsten Behandlung.4
Epcoritamab, ein subkutan applizierbarer bispezifischer Antikörper, wurde in der Studie EPCORENHL-1 für rezidivierte FL mit Hochrisikocharakteristika (Rezidiv in den ersten zwei Jahren nach Immunchemotherapie und Refraktärität auf Anti-CD20 und Alkylantien) untersucht.
42% der Patient:innen hatten bei Studieneinschluss eine Krankheitsprogression nach 24 Monaten (POD24) und im Median drei Vorbehandlungen. Als Monotherapie zeigt Epcoritamab mit einer ORR von 83%, einer CRR von 65% und einer Zeit von 1,5 Monaten bis zur kompletten Remission ein ausgezeichnetes Ergebnis. Nach zwölf resp. 18 Monaten sind noch 85% resp. 74% der Patient:innen in kompletter Remission.5 Die derzeit laufende Phase-III-Studie randomisiert rezidivierte FL in Epcoritamab alleine vs. Epcoritamab+Rituximab+Lenalidomid.6
Der Einsatz der CAR-T-Zell-Behandlung im Rezidiv bei indolenten Lymphomen ist in mehreren Studien bereits publiziert. Dazu gehören ZUMA-5, eine Phase-II-Studie mit Einschluss von follikulären Lymphomen und Marginalzonen-Lymphomen,7,8 und ELARA, eine Phase-II-Studie zu follikulären Lymphomen.9,10
Die TRANSCEND-Studie (Anti-CD19-CAR-T-Zell-Therapie mit Lisocabtagen maraleucel [Lis-cel]) konnte Daten von 23 Patient:innen für die Studie auswerten. Patient:innen, die nach einer Erstlinientherapie mit Immunchemotherapie progredient waren und die Kriterien der Hochrisikodefinition (Rezidiv weniger als sechs Monate nach Diagnose und/oder eine hohe Tumorlast) erfüllten, wurden eingeschlossen.
Sowohl die Gesamtansprechrate als auch die Rate des kompletten Ansprechens lagen bei 95,7% (95% CI: 78,1–99,9; p<0,0001). Nach einem medianen Verlauf von 16,8 Monaten wurde das mediane PFS noch nicht erreicht, die 1-Jahres-PFS-Rate lag bei 91,3%.11
Diffuse grosszellige Lymphome
Für die Behandlung der rezidivierten diffusen grosszelligen Lymphome zeichnete sich am ASCO-Jahrestreffen 2023 ein klarer Paradigmenwechsel ab.
Beim Einsatz von Axi-cel vs. den aktuellen Therapiestandard einer Salvage-Chemotherapie plus autologer Stammzelltransplantation sind die CAR-T-Zell-Behandlungen im frühen Rezidiv(<12 Monate)/refraktär überlegen. Nach einem medianen Follow-up von 47,2 Monaten ist der Überlebensvorteil mit einer HR von 0,726 (95% CI: 0,54–0,977; p=0,0168) so klar, dass von einer Heilung gesprochen werden darf. Der frühe Einsatz von Axi-cel in der zweiten Therapielinie bei refraktären Situationen und frühen Rezidiven ist damit bestätigt für Patient:innen, die als geeignet für CAR-T-Zell-Therapie beurteilt werden.12
Für Glofitamab, einem bispezifischen Antikörper mit einer fixen Verabreichungsdauer über zwölf Zyklen im Rezidiv nach mindestens zwei Vorbehandlungen, zeigen die Verlaufsdaten eine anhaltende komplette Remission unabhängig von der Vorbehandlung (33% wurden zuvor mit CAR-T-Zellen behandelt). Nach zwölf Monaten war für Patient:innen mit kompletter Remission am Therapieende die PFS-Rate 80% resp. die Gesamtüberlebensrate 90%.13
Der Einsatz von Epcoritamab in der Rezidivsituation nach mindestens zwei vorangegangenen Therapielinien ist zwischenzeitlich von der EMA, aber noch nicht von Swissmedic zugelassen. Epcoritamab wurde schrittweise in immer längeren Zeitintervallen bis zur Progression verabreicht, anfänglich in wöchentlichen Gaben bis letztlich in monatlichen Gaben. Knapp 40% der Patient:innen hatten eine Vorbehandlung mit CAR-T-Zellen. Die Gesamtansprechrate (63,1%) und die Rate der kompletten Remission (38,9%) führten zu einer medianen Dauer des Ansprechens von zwölf Monaten für Patient:innen mit kompletter Remission.14
Hodgkin-Lymphome
Die Primärbehandlung mit intensiver Chemotherapie beim fortgeschrittenen Hodgkin-Lymphom (HL) zeigt ein ausserordentlich langes Gesamtüberleben, allerdings mit dem Preis von Langzeittoxizitäten. Die Reduktion der Toxizität unter Erhalt des Gesamtüberlebens war das Ziel von zwei Phase-III-Studien, die 2023 präsentiert und publiziert wurden. Brentuximab Vedotin (BrV), ein Antikörper-Wirkstoff-Konjugat, setzt an den CD30-exprimierenden Hodgkin-Reed-Sternberg-Zellen an und führt über die Internalisierung des Antikörpers zur Apoptose. Das modifizierte BEACOPP-Regime (BrECADD) – also Chemotherapie ohne Bleomycin und Vincristin mit vier Tagen Dexamethason anstelle von Prednison über 14 Tage und Procarbazin anstelle von Dacarbazin – wurde mit dem Standard BEACOPP in einer Phase-III-Studie für fortgeschrittene HL verglichen. Der duale primäre Endpunkt wurde erreicht (verminderte Toxizität, Nichtunterlegenheit des PFS). Die Interimsanalyse nach 40 Monaten zeigte eine 3-Jahres-PFS-Rate von 94,9% für BrECADD (95% CI: 93,5%–96,7%) und 92,3% für BEACOPP (95% CI: 90,3%–94,3%; HR: 0,63 [95% CI: 0,42–0,94]).
Damit ist die Nichtunterlegenheit des CD30-basierten Regimes gegenüber BEACOPP belegt, ebenso ein klarer Vorteil für die therapieassoziierte Morbidität. Hervorzuheben ist dabei besonders der Erhalt des Hormonspiegels sowohl bei Frauen als auch bei Männern.15
Die Untersuchung der Geburtenrate von Patient:innen im BrECADD-Arm zeigt im Vergleich zur populationsbasierten Geburtenrate keinen Unterschied.16
Sechs Zyklen ABVD – der Behandlungsstandard für fortgeschrittene HL, der vor allem in den USA und Kanada praktiziert wird – waren die Ausgangslage für die nachfolgenden Phase-III-Studien mit Brentuximab Vedotin+AVD und Nivolumab+AVD.
Die Checkpoint-Inhibitoren führen über eine PD-1-Blockade zu einer T-Zell-Reaktivierung gegen das Hodgkin-Lymphom. Basierend auf dieser Grundlage kombiniert die Studie SWOG1826 Nivolumab+AVD vs. Brentuximab+AVD. Die ersten Ergebnisse nach zwölf Monaten Follow-up zum primären Endpunkt progressionsfreies Überleben wurden am ASCO- und ASH-Jahrestreffen 2023 präsentiert, mit einer 1-Jahres-PFS-Rate für Nivolumab+AVD in Höhe von 94% vs. Brentuximab-AVD in Höhe von 84% (HR: 0,48; 99% CI: 0,27–0,87; p=0,0005).
Das verlängerte PFS für die Kombination mit einem Checkpoint-Inhibitor zusammen mit der sehr guten Verträglichkeit (wenige autoimmunassoziierte Nebenwirkungen) ist sehr vielversprechend. Die Verlaufsdaten werden zeigen, ob Checkpoint-Inhibitor-basierte Therapien zu einem weiteren Standard in der Behandlung von fortgeschrittenen HL erhoben werden.18
Am ASH-Jahrestreffen 2023 wurden die Daten der Subgruppe der über 60-jährigen Patient:innen (n=97) vorgestellt. Ein Drittel der Patient:innen im Brentuximab+AVD-Arm brach die Behandlung aus Toxizitätsgründen oder wegen Tod (n=5) vorzeitig ab. Die 1-Jahres-PFS-Rate von Nivolumab+AVD war mit 93% dem Standardarm Brentuximab+AVD mit 64% deutlich überlegen (HR: 0,34; 95% CI: 0,12–1,02; p=0,022).
Noch fehlen die Langzeitdaten, die das PFS bestätigen, sowie die Ergebnisse zum Gesamtüberleben. Die Kombination Nivolumab+AVD darf aber auch ohne Vorteil für das Gesamtüberleben, alleine basierend auf dem PFS-Vorteil, als eine therapeutische Option bei Patient:innen über 60 Jahre gelten, die geeignet für eine Therapie mit Anthrazyklinen sind.19
Primär mediastinales B-Zell-Lymphom
Die primär mediastinalen B-Zell-Lymphome (PMBCL) haben eine eigenständige Biologie, mit charakteristischer «bulky» Lymphompräsentation mediastinal, treten häufiger bei Frauen im jungen Erwachsenenalter auf und wurden bisher mehrheitlich mit einer Immunchemotherapie gefolgt von einer konsolidierenden Radiotherapie behandelt. Mit dem Ziel, die Langzeittoxizitäten der mediastinalen Bestrahlung zu reduzieren, wurde eine PET/CT-gesteuerte Phase-III-Studie mit Randomisierung der PET/CT-negativen Patient:innen (Deauville-Score[DS] 1–3) in einem Bestrahlungs(30Gy)- vs. einen Beobachtungsarm durchgeführt.
Von den 530 eingeschlossenen Patient:innen mit unbehandeltem PMBCL im Stadium I/II (98%) erreichten 268 (50,6%) Patient:innen nach einer Immunchemotherapie (anthrazyklinhaltig) ein komplettes metabolisches Ansprechen. Als optimale Immunchemotherapie mit der höchsten Rate an kompletten Remissionen zeigte sich R-CHOP-14. Die 3-Jahres-Überlebensrate, unabhängig vom Behandlungsarm, liegt bei 99%, die Rate des progressionsfreien Überlebens bei 96% nach drei Jahren.
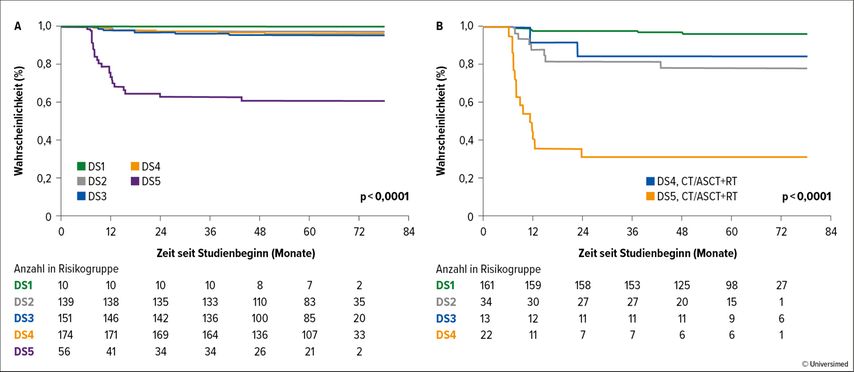
Die 262 Patient:innen, die ein metabolisches Ansprechen mit DS 4 und 5 erreichten, durften gemäss Protokoll nach lokalen Standards (Radiotherapie, Chemotherapie mit autologer Stammzelltransplantation, Verlaufsbeobachtung) behandelt werden. Hier zeigt sich, dass Patient:innen mit DS 4, die mehrheitlich mediastinal bestrahlt wurden, ein vergleichbares Ergebnis haben Patient:innen mit DS 1–3 (Abb. 2). Ein ungleich schlechterer Krankheitsverlauf ist bei Patient:innen mit DS 5 zu beobachten.
Abb. 2: Geschätztes progressionsfreies Überleben (PFS) bei Patient:innen mit primär mediastinalem B-Zell-Lymphom (PMBCL) in der Studie IELSG37 entsprechend Deauville-Score am Ende der Frontline-Immunchemotherapie (A) und entsprechend der nachfolgenden Behandlung in der Patient:innenuntergruppe, die kein komplettes metabolisches Ansprechen erreicht hat (B).(modifiziert nach Zucca E et al.20)
Basierend auf diesen Ergebnissen darf zukünftig bei Patient:innen mit PMBCL, die nach einer anthrazyklinhaltigen Immunchemotherapie ein DS 1–3 erreichen, von einer mediastinalen Bestrahlung abgesehen werden.20
Literatur:
1 Morschhauser F et al.: Six-year results from RELEVANCE: lenalidomide plus rituximab (R2) versus rituximab-chemotherapy followed by rituximab maintenance in untreated advanced follicular lymphoma. J Clin Oncol 2022; 40(28): 3239-45 2 Zucca E et al.: Long-term effect of a 6-month regimen of rituximab and lenalidomide in follicular lymphoma in patients in need fo first therapy: update analysis of the SAKK 35/10 randomized trial. ASH 2023; Abstr. #295 3 Budde LE et al.: Safety and efficacy of mosunetuzumab, a bispecific antibody, in patients with relapsed or refractory follicular lymphoma: a single – arm, multicentre, phase 2 study. Lancet Oncol 2022; 23(8): 1055-65 4 Schuster SJ et al.: Mosunetuzumab monotherapy continues to demonstrate durable responses in patients with relapsed and/or refractory follicular lymphoma after > 2 prior therapies: 3-year follow-up from a pivotal phase II study. ASH 2023; Abstr. #603 5 Linton KM et al.: Epcoritamab sc monotherapy leads to deep and durable responses in patients with relapsed or refractory follicular lymphoma: first data disclosure from the Epcore NHL-1 follicular lymphoma dose-expansion cohort. ASH 2023; Abstr. #1655 6 Falchi L et al.: EPCORE FL-1: phase 3 trial of sc epcoritamab with rituximab and lenalidomide (R2) vs. R2 alone in patients with relapsed or refractory follicular lymphoma. ASH 2023; Abstr. #3053 7 Jacobson CA et al.: Axicabtagene ciloleucel in relapsed or refractory indolent non-Hodgkin Lymphoma (ZUMA-5): a single arm, multucentre, phase 2 trial. Lancet 2022; 23(1): 91-103 8 Neelapu SS et al.: Three-year follow-up analysis of axicabtagene ciloleucel in relapsed/refractory indolent non-Hodgkin lymphoma (ZUMA-5). Blood 2024; 143(6): 496-506 9 Fowler NH et al.: Tisagenlecleucel in adult relapsed or refractory follicular lymphoma: the phase 2 ELARA trial. Nat Med 2022; 28(2): 325-32 10 Schuster SJ et al.: Clinical outcomes of patients with relapsed/refractory follicular lymphoma treated with tisagenlecleucel: phase 2 ELARA 3-year follow-up. ASH 2023; Abstr. #601 11 Morschhauser F et al.: TRANSCEND FL: phase 2 study primary analysis of lisocabtagene maraleucel as second-line therapy in patients with high-risk relapsed or refractory follicular lymphoma. ASH 2023; Abstr. #602 12 Westin JR et al.: Survival with axicabtagene ciloleucel in large B-cell lymphoma. New Engl J Med 2023; 389(2): 148-57 13 Hutchings M et al.: Glofitamab monotherapy in relapsed or refractory large B-cell lymphoma. Extended follow-up from a pivotal phase II study and subgroup analysis in patients with prior chimeric antigen receptor T-cell therapy and by baseline total metabolic tumor volume. ASH 2023; Abstr. #433 14 Thieblemont C et al.: Epcoritamab, a novel, subcutaneous CD3xCD20 bispecific T-cell–engaging antibody, in relapsed or refractory large B-cell lymphoma: Dose expansion in a phase I/II trial. J Clin Oncol 2023; 41(12): 2238-47 15 Borchmann P et al.: Comprehensive analysis of treatment related morbidity and progression -free survival in the GHSG phase III HD21 trial. ASH 2023; Abstr. #3057 16 Ferdinandus J et al.: Pregnancies and childbirth following advanced-stage Hodgkin Lymphoma treatment with BrECADD or BEACOPP in the randomized phase III GHSG HD21 trial. ASH 2023; Abstr. #4437 17 Ansell SM et al.: Overall survival with Brentuximab Vedotin in stage III or IV Hodgkin’s Lymphoma. New Engl J Med 2022; 387(4): 310-20 18 Herrera AF et al.: SWOG S1826, arandomized study of nivolumab (N)-AVD vs. Brentuximab (BV)- AVD in advanced stage (AS) classical Hodgkin Lymphoma (HL). ASCO 2023; Abstr. #LBA4 19 Rutherford S et al.: Nivolumab-AVD is better tolerated and improves progression-free survival compared to Bv-AVD in older patients (aged ≥60 years) with advanced stage Hodgkin Lymphoma enrolled on SWOG S1826. ASH 2023; Abstr. #181 20 Zucca E et al.: Survival patterns of non-randomized patients in the IELSG37 Study: Deauville Score 4 is not necessarily associated with poor outcome in primary mediastinal lymphoma. ASH 2023; Abstr. #1718
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...