Neue Richtlinien und ein potenter BCR-ABL1-Inhibitor
Autorin:
Prof. Dr. med. Gabriela Baerlocher
Klinik für Hämatologie & Onkologie, Hirslanden Zürich
Medica Labor und Pathologie, Zürich
E-Mail: gabriela.baerlocher@kho.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die ELN-Empfehlungen zum Management der CML werden 2025 auf den neuesten Stand gebracht. In der Erstlinientherapie hat zuletzt Asciminib, ein selektiver allosterischer Inhibitor, der auf die Myristoyl-Tasche von BCR-ABL1 abzielt, Einzug gehalten. Dessen genauer Einsatzbereich muss jedoch erst noch definiert werden.
In den nächsten Jahrzehnten wird mit einem stetigen Anstieg der Prävalenz von Patient:innen mit chronischer myeloischer Leukämie (CML) gerechnet.1 Unterstützung im Bemühen um die bestmögliche Versorgung der Patient:innen liefern unter anderem die ELN-Empfehlungen, die 2025 basierend auf der letzten Version aus dem Jahr 2020 aktualisiert werden.2 Die geplanten Neuerungen waren Gegenstand einer Präsentation im Rahmen des 21. ELN-Symposiums in Mannheim, Deutschland, im Februar 2025.
Krankheitsklassifikationund Prognose-Scores
Bei der Einteilung der CML-Stadien muss darauf hingewiesen werden, dass Unterschiede zwischen der ELN- und der WHO-Klassifikation bestehen, was die Diagnostik im Alltag nicht vereinfacht. Die Unterschiede liegen bei der Definition der Blastenzahl für die akzelerierte Phase, respektive die Blastenkrise. Die Frage stellt sich, ob die Stadieneinteilung bei der CML zukünftig nicht eher biphasisch als triphasisch erfolgen sollte.2,3
Weiterhin relevant sind Hochrisikofaktoren, die entweder bereits zum Diagnosezeitpunkt vorliegen oder unter der Therapie auftreten. Relevante Faktoren zum Zeitpunkt der Diagnose umfassen etwa einen hohen ELTS-Score, 10–19% Blasten im peripheren Blut und/oder Knochenmark sowie zusätzliche chromosomale Aberrationen in Philadelphia(Ph)-positiven Zellen (z.B. Monosomie 7, komplexer Karyotyp). Zudem gelten auch Cluster kleiner Megakaryozyten oder eine signifikante Reticulin- und/oder Kollagenfibrose als Hochrisiko bei Diagnose. Zu den während der Therapie auftretenden Hochrisikofaktoren zählt etwa das Ausbleiben einer kompletten hämatologischen Remission unter dem ersten Tyrosinkinasehemmer (TKI). Im Weiteren gehören auch Resistenzen auf zwei aufeinanderfolgende TKI, die nicht durch eine Mutation erklärt werden können, oder die Entstehung von komplexen Mutationen unter TKI-Therapie wie auch neue chromosomale Aberrationen dazu.
Als bevorzugter Risiko-Score wird der ELTS-Score empfohlen, da er sich auf den Endpunkt des Überlebens (CML-bedingter Tod) bezieht.4 Nach wie vor wird der Sokal-Score zusätzlich gebraucht, da er in vielen Studien verwendet wurde und somit eine Vergleichsmöglichkeit bietet.
Überwachung des Therapieansprechens
Ein wichtiger Aspekt des Managements besteht in der Kontrolle des Therapieansprechens. Hier zielen die neuen Empfehlungen auf möglichst einfache Anwendbarkeit, die von auf CML spezialisierten und nicht spezialisierten Ärzt:innen, die CML-Patient:innen behandeln, weltweit umgesetzt werden können. Eine Progression soll verhindert oder verzögert werden, um das Überleben zu verlängern. Dabei ist die Identifikation von Patient:innen mit ungünstiger Prognose relevant. Zudem sollten jene Patient:innen erkannt werden, bei denen ein Absetzen der Behandlung (therapiefreie Remission) vertretbar erscheint. Das Ansprechen auf die TKI-Therapie zeigt verschiedene Verläufe. Dabei gibt es Patient:innen, die eine primäre (ca. 10%) oder sekundäre Resistenz (ca. 10%)aufweisen, ein Plateau-Ansprechen oberhalb der MR4-Schwelle haben (BCR-ABL1 <0,01%; ca. 50%), und solche, die ein tiefes Ansprechen zeigen und nach Absetzen des TKI therapiefrei bleiben (15%), während andere ein Rezidiv mit TKI-Rechallenge durchmachen (15%).6
Die ELN-Recommendations aus 2020 grenzen anhand von molekularem Ansprechen, ELTS-Risikoscore und dem Neuauftreten zusätzlicher chromosomaler Anomalien den optimalen Verlauf von einer zu beobachtenden Entwicklung («Warning») und dem Versagen der Therapie ab.2 Das Update der Empfehlungen wird wahrscheinlich diese Kategorisierungen etwas umbenennen («favorable» statt «optimal» und «unfavorable» statt «failure»), während die Meilensteine unverändert bleiben werden. Wie die Datenlage heute nahelegt, sollte kein TKI-Switch aufgrund eines Einzelergebnisses im Bereich eines der Meilensteine erfolgen. In der «Versager»-Kategorie kann es sich bei einigen Patient:innen um späte Responder handeln. Zudem haben Patient:innen mit fortgeschrittenem Lebensalter oft Komorbiditäten und die Umstellung auf potentere Medikamente kann ein Risiko für Nebenwirkungen darstellen, sodass ein Wechsel auf einen potenteren TKI unter Umständen nicht ratsam erscheint.
Erstlinientherapie: ASC4FIRST
Für die Erstlinientherapie der CML in der chronischen Phase standen in der Schweiz bisher die vier TKI Imatinib, Nilotinib, Dasatinib and Bosutinib zur Verfügung.6 In der Zweitlinie kann ein Switch auf eine der anderen Substanzen erfolgen. Ponatinib findet in der Zweitlinie bei Resistenz oder Intoleranz auf einen Zweitgenerationen-TKI oder bei Vorliegen einer T315I-Mutation, Compound-Mutationen oder Progression in die akzelerierte Phase/Blastenphase Einsatz. Ebenso ist dies der Fall für Asciminib, allerdings nicht bei Progression in die akzelerierte Phase/Blastenphase und mit höherer Medikamentendosis (200mg/d) bei Vorliegen einer T315I-Mutation.
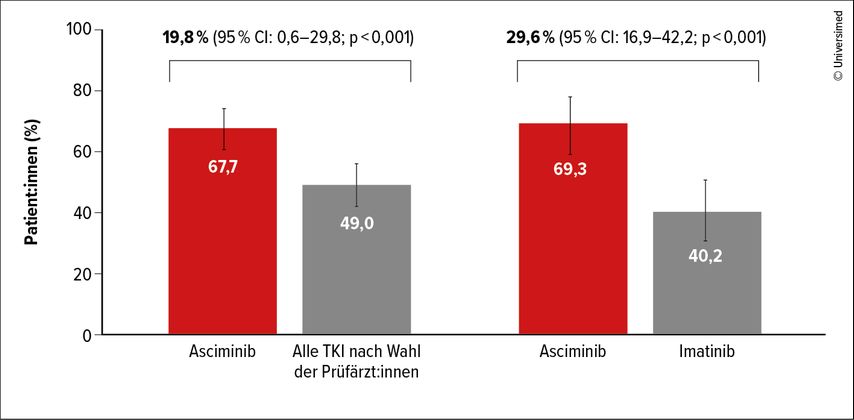
Ende Januar 2025 erfolgte in der Schweiz die Zulassung von Asciminib bei Erwachsenen mit neu diagnostizierter oder cABL-TKI-vorbehandelter Ph-positiver CML in der chronischen Phase.7 Dafür war die Phase-III-Studie ASC4FIRST ausschlaggebend, in der randomisiert entweder Asciminib 80mg/d oder Standard-TKI verabreicht wurden. Die Auswahl des Komparators erfolgte individualisiert in einer Prärandomisierungsphase. Als primärer Endpunkt galt die «major» molekulare Response (MMR) nach 48 Wochen verglichen mit allen anderen TKI bzw. separat auch mit Imatinib.
In Bezug auf beide Vergleiche schnitt Asciminib signifikant besser ab (jeweils p<0,001; Abb. 1).8 Die Überlegenheit des Asciminib trat in allen Subgruppen zutage. Ein besonderer Benefit schien sich bei den Patient:innen im Alter von ≥75 Jahren zu zeigen. Nach einem Jahr resultierten im Prüfarm verglichen mit der Gruppe der Patient:innen, die alle anderen TKI erhalten hatten, fast verdoppelte Raten an tiefen molekularen Remissionen (MR4: 38,8% vs. 20,6%; MR4,5: 16,9% vs. 8,8%); der Vergleich mit Imatinib erbrachte sogar noch grössere Unterschiede (MR4: 42,6% vs. 17,8%; MR4,5: 17,8% vs. 4,9%). Vorteile zeigte Asciminib auch hinsichtlich der Häufigkeit von höhergradigen Nebenwirkungen (Grad ≥3). Asciminib war mit den niedrigsten Raten an unerwünschten Ereignissen assoziiert, die zu Therapieabbrüchen oder Dosisanpassungen führten. Im nichthämatologischen Bereich traten Diarrhö, Hautausschläge, Übelkeit und Gesichtsödeme mit geringerer Inzidenz auf als unter Imatinib und teilweise auch unter den Zweitgenerations-TKI.
Abb. 1: «Major» molekulare Response nach 48 Wochen unter Asciminib vs. Komparator-TKI nach Wahl der Prüfärzt:innen bzw. Imatinib (modifiziert nach Hughes TP et al.)8
Achillesfersen von Asciminib
Vorläufig wird der Stellenwert von Asciminib dadurch relativiert, dass die Manifestation von BCR-ABL1-Mutationen im Zusammenhang mit der Therapie erst noch eingehender erforscht werden sollte. Eine Reihe unterschiedlicher Mutationen konnte etwa in der Phase-I-Studie festgestellt werden.9 Klinische Beobachtungen widersprechen der Annahme, dass sich die Spektren der Resistenzmutationen unter ATP-kompetitiven Inhibitoren und Asciminib nicht überlappen.
Insgesamt weist die Substanz gewisse Achillesfersen auf, die erst noch eingehender beobachtet und beschrieben werden müssen, um den idealen Einsatzbereich zu definieren.
Literatur:
1 Lauseker M et al.: Improved survival boosts the prevalence of chronic myeloid leukemia: predictions from a population-based study. J Cancer Res Clin 2016; 142: 1441-7 2 Hochhaus A et al.: European LeukemiaNet 2020 recommendations for treating chronic myeloid leukemia. Leukemia 2020; 34(4): 966-84 3 Arber DA et al.: The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127: 2391-405 4 Pfirrmann M et al.: Prognosis of long-term survival considering disease-specific death in patients with chronic myeloid leukemia. Leukemia 2016; 30(1): 48-56 5 Sokal JE et al.: Prognostic discrimination in »good-risk” chronic granulocytic leukemia. Blood 1984; 63(4): 789-99 6 Baerlocher GM, Oppliger Leibundgut E: Pocket cards for the monitoring of patients with chronic myeloid leukemia. Third Edition 2022 based on recommendations from the European LeukemiaNet 2020 7 Fachinformation Scemblix® 8 Hughes TP et al.: ASC4FIRST, a pivotal phase 3 study of asciminib vs investigator-selected tyrosine kinase inhibitors in newly diagnosed patients with chronic myeloid leukemia: primary results. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA6500 9 Hughes TP et al.: Asciminib in chronic myeloid leukemia after ABL kinase inhibitor failure. N Engl J Med 2019; 381(24): 2315-26
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...