Neue Daten zum Morbus Waldenström
Autor:
PD Dr. med. Dominik Heim
Leitender Arzt, Chefarzt-Stv.
Hämatologie
Universitätsspital Basel
E-Mail: dominik.heim@usb.ch
Es hat sich einiges getan die letzten beiden Jahre: Mit der Studie StiL NHL 7–2008 MAINTAIN wurde Klarheit in Bezug auf eine Erhaltungstherapie mit Rituximab geschaffen. Die Resultate einer randomisierten Studie, welche zwei Brutonkinase-Inhibitoren (BTKi) verglich, wurden präsentiert und publiziert. Ausserdem wurden am ASH-Meeting 2020 die Endauswertung der iLLUMINATE-Studie, erste Daten zum nicht kovalent bindenden BTKi LOXO-305 und eine Analyse zur Dosis-Wirkungs-Beziehung von Bendamustin und Rituximab bei Patienten mit Morbus Waldenström vorgestellt.
Definition, Klinik und Genetik
Morbus Waldenström (MW) bezeichnet ein lymphoplasmazytisches Lymphom mit obligater Knochenmarkinfiltration und Nachweis einer monoklonalen IgM-Gammopathie im Serum (Klassifikation der World Health Organisation, WHO). Der Morbus Waldenström ist eine seltene Erkrankung und macht 1–3% aller reifzelligen B-Zell-Neoplasien aus. Das mediane Alter bei Diagnose liegt bei 72–75 Jahren. Die Symptome resultieren aus der Knochenmarkinfiltration (Zytopenien), aus der Infiltration anderer Organe (Splenomegalie, Hepatomegalie) oder aus der Produktion von monoklonalem IgM (Hyperviskosität, Kryoglobulinämie, Amyloidose, Polyneuropathie). Der Morbus Waldenström ist in der Regel eine indolent verlaufende Erkrankung mit einer mittleren 5-Jahres-Überlebensrate gegen 80%.
Genetisch ist der MW durch eine Mutation im MYD88(«myeloid differentiation primary response 88»)-Gen charakterisiert: MYD88L265P. Diese Mutation wird in bei 95% der Patienten mit MW gefunden. MYD88L265P ist nicht diagnostisch für einen MW, sie kann selten auch in anderen reifzelligen B-Zell-Neoplasien gefunden werden, aber nicht beim multiplen Myelom. Die Mutation in MYD88 führt zu einer konstitutiven Aktivierung der Brutontyrosin-Kinase und damit des B-Zellrezeptor-Signalwegs. Eine weitere Mutation, und zwar im CXCR4(CXC-Motiv-Chemokinrezeptor 4)-Gen, findet sich bei 30–40% der MW-Patienten. Die daraus resultierenden drei Genotypen beeinflussen das Ansprechen der Patienten auf eine Therapie mit Brutonkinase-Inhibitoren (BTKi).1
Behandlungsmöglichkeiten
Etablierte Behandlungen von symptomatischen MW-Patienten sind Chemoimmuntherapien mit Bendamustin und Rituximab (BR) oder Dexamethason-Cyclphosphamid-Rituximab (DCR), eine proteasombasierte Therapie z.B. mit Bortezomib/Rituximab/Dexamethason (BDR) oder eine Therapie mit dem BTKi Ibrutinib.2
BR und Rituximab-Erhaltung: MAINTAIN-Studie
Basierend auf Daten von retrospektiven Studien hat sich seit etwa 10 Jahren zunehmend eine Erhaltungstherapie mit Rituximab nach Induktion mit BR etabliert. Am ASH-Meeting 2019 präsentierte Matthias Rummel die Ergebnisse der Studie StiL NHL 7–2008 MAINTAIN.3 Hier wurden MW-Patienten, welche nach einer Induktion mit BR (6 Zyklen) ein Ansprechen zeigten, zwischen einer Erhaltungstherapie mit Rituximab versus keine Erhaltung randomisiert. In beide Arme wurden jeweils 109 Patienten eingeschlossen. Nach einer medianen Beobachtungszeit von 80 Monaten zeigte sich zwischen den Armen kein Unterschied in Bezug auf das progressionsfreie oder das Gesamtüberleben (PFS, OS). Die Ergebnisse dieser prospektiven, randomisierten Studie zeigen ein weiteres Mal, dass Therapieempfehlungen basierend auf retrospektiv erhobenen Daten immer mit grosser Vorsicht zu geniessen sind.
Studie zu Dosis – Wirkung bei BR
Während sich bei Patienten mit chronischer lymphatischer Leukämie (CLL) 6 Zyklen BR als Standard etabliert hat, wird bei Patienten mit MW die BR-Therapie in vielen Zentren auf 4 Zyklen beschränkt. Diese Reduktion der Intensität wurde bisher formal nicht getestet. In der am ASH-Meeting 2020 präsentierten Studie wurden die Daten von Patienten analysiert, welche an 17 Zentren im Zeitraum von 2010 bis 2020 mit BR als Erstlinientherapie oder nach Relaps behandelt worden waren.4 Die Studie bestätigte die Korrelation zwischen tiefem Ansprechen auf die Therapie und Dauer des PFS bzw. OS. Die Daten zeigten aber auch klar, dass im Erstliniensetting die Standarddosierung mit Bendamustin, 90mg/m2 an 2 aufeinanderfolgenden Tagen über 6 Zyklen, in Bezug auf das Erreichen einer tiefen Remission und PFS einer Therapie mit niedrigerer Dosierung bzw. einer geringeren Anzahl an Zyklen überlegen ist.
Ibrutinib: Endanalyse der iNNOVATE-Studie
150 Patienten mit behandlungsbedürftigem MW (Erstlinie oder «relapsed») wurden zwischen Ibrutinib-Rituximib und Rituximab plus Placebo randomisiert. Unter Ibrutinib-Rituximab zeigte sich ein signifikant längeres PFS.5 Die Endauswertung der iNNOVATE-Studie mit einem medianen Follow-up von 50 Monaten wurde am ASH-Meeting 2020 präsentiert und bestätigt die Überlegenheit von Ibrutinib-Rituximab über Rituximab-Placebo in Bezug auf das PFS und die Ansprechraten. Auch mit dem längeren Follow-up zeigt sich kein Unterschied zwischen Patienten mit verschiedenen Genotypen (MYD88L265P/CXCR4WT, MYD88L265P/CXCR4whimund MYD88WT/CXCR4WT) in Bezug auf Ansprechraten und PFS.6
In einer Substudie wurden 31 Patienten der iNNOVATE-Studie nach Rituximab-Versagen mit Ibrutinib mono behandelt. Hier bestätigte sich der Einfluss der Genotypen auf eine Ibrutinib-Monotherapie. Patienten mit MYD88L265P/CXCR4whim zeigten ein kürzeres PFS und weniger Patienten mit diesem Genotyp erreichten eine tiefe Remission als Patienten mit MYD88L265P/CXCR4WT.7
Neue BTK-Inhibitoren: ASPEN-Studie
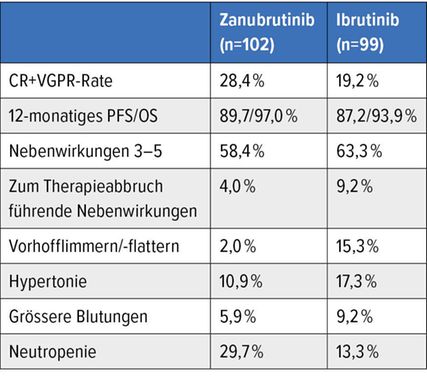
Der BTKi Ibrutinib ist eine etablierte Behandlung für MW-Patienten, welche nicht für eine Chemoimmuntherapie in Betracht kommen, und für Patienten mit einem Rückfall der Krankheit in der zweiten oder in späteren Linien.8 Zanubrutinib ist ein BTKi der zweiten Generation mit geringerer «Off-target»-Inhibition als Ibrutinib. In einer Phase-I/II-Studie erreichten 45% der MW-Patienten unter einer Therapie mit Zanubrutinib eine sehr gute partielle Remission (VGPR) oder Komplettremission (CR), was (im indirekten Vergleich) deutlich höher ist als die Ansprechraten mit Ibrutinib. Die Therapie wurde gut toleriert. Vorhofflimmern, Hämorrhagien oder Diarrhö Grad 3 traten nur bei wenigen Patienten auf. Basierend auf diesen ermutigenden Daten wurde die randomisierte ASPEN-Studie zum direkten Vergleich von Zanubrutinib versus Ibrutinib bei Patienten mit MYD88-mutierten MW lanciert. Die Ansprechraten mit Zanubrutinib waren höher als mit Ibrutinib, erreichten allerdings nicht die Werte der Phase-I/II-Studie und waren im direkten Vergleich nicht signifikant (CR + VGPR 28% versus 19%). Die Häufigkeit und der Schweregrad der bekannten BTKi-assoziierten Nebenwirkungen waren im Zanubrutinib-Arm deutlich geringer als bei Patienten, welche Ibrutinib erhielten. Patienten im Ibrutinib-Arm brachen die Therapie häufiger wegen Nebenwirkungen ab als mit Zanubrutinib behandelte Patienten (Tab. 1). Unter Zanubrutinib kam es zu mehr Neutropenien, während schwere Infektionen in den beiden Armen nicht unterschiedlich häufig auftraten.9
Neue BTK-Inhibitoren: LOXO-305; BRUIN-Studie
LOXO-305 ist im Gegensatz zu Ibrutinib, Acalabrutinib und Zanubrutinib ein nichtkovalenter Hemmer der Brutontyrosin-Kinase, es ist aktiv gegen Wildtyp-BTK und die häufigste BTK-Mutation C481. In der Phase-I/II-BRUIN-Studie wurde LOXO-305 bei Patienten mit fortgeschrittenen B-Zell-Lymphomen, darunter 17 Patienten mit MW, welche bereits zwei oder mehr Therapien erhalten hatten, getestet.10 12 der 17 MW-Patienten waren bereits mit einem BTKi vorbehandelt. Die Gesamtansprechrate bei den MW-Patienten war 60%, darunter war allerdings nur ein Patient mit VGPR, vier Patienten hatten eine PR.
Die Verträglichkeit von LOXO-305 war im gesamten, 186 Patienten umfassenden Kollektiv sehr gut. Tiefe Remissionen sind aber bei Patienten mit fortgeschrittenem MW auch unter LOXO-305 eher selten zu erreichen.
Schlussfolgerungen
Die Stärken einer zeitlich begrenzten Chemoimmuntherapie mit BR wurden mit der MAINTAIN-Studie wieder aufgezeigt: hohe Ansprechraten und ein PFS von 9 Jahren. Eine Erhaltungstherapie mit Rituximab bringt keinen zusätzlichen Gewinn. Ein «voll dosiertes» BR scheint in Bezug auf PFS und ORR einer Therapie mit «reduzierter Intensität» überlegen zu sein.
Ibrutinib ist ebenfalls eine sehr wirksame Therapie in der ersten, aber auch in folgenden Therapielinien. Die Bestimmung des Genotyps (MYD88 und CXCR4-Mutationen) bei Patienten, welche für eine BTKi- Therapie vorgesehen sind, wird empfohlen. Bei MYD88WT-Patienten und Patienten mit MYD88L265P/CXCR4whim ist eine Kombination von Ibrutinib mit Rituximab wahrscheinlich sinnvoll.
Der BTKi der zweiten Generation Zanubrutinib zeigt bei guter Wirksamkeit ein besseres Nebenwirkungsprofil als Ibrutinib und könnte in Zukunft die therapeutischen Möglichkeiten erweitern. Der nichtkovalente BTKi LOXO-305 zeigt ein gutes Nebenwirkungsprofil und Aktivität auch bei mit Ibrutinib vorbehandelten Patienten. Die weitere Entwicklung verfolgen wir gespannt.
Literatur:
1 Treon SP et al.: Ibrutinib in previously treated Waldenström’s macroglobulinemia. N Engl J Med 2015; 372(15): 1430-40 2 Onkopedia: Morbus Waldenström. Dezember 2018. Online unter https://www.onkopedia.com/de/onkopedia/guidelines/morbus-waldenstroem-lymphoplasmozytisches-lymphom/@@guideline/html/index.html . Abgerufen Dezember 2020 3 Rummel MJ et al.: Two years rituximab maintenance vs. observation after first line treatment with bendamustine plus rituximab (b-r) in patients with waldenström‘s macroglobulinemia (mw): results of a prospective, randomized, multicenter phase 3 study (the StiL NHL7-2008 MAINTAIN trial). Blood 2019; 134(Supplement 1): 343 4 Arulogun S et al.: Bendamustine plus rituximab for the treatment of Waldenström macroglobulinaemia: Patient outcomes and impact of bendamustine dosing. Blood 2020; 136(Supplement 1): 2958 5 Dimopoulos MA et al.: Phase 3 trial of ibrutinib and rituximab in Waldenström’s macroglobulinemia. N Engl J Med 2018; 378(25): 2399-410 6 Buske C et al.: Five-year follow-up of ibrutinib plus rituximab vs placebo plus rituximab for waldenstrom’s macroglobulinemia: final analysis from the randomized phase 3 iNNOVATE Study. Blood 2020; 136 (Supplement 1): 336 7 Trotman J et al.: Long-term follow-up of ibrutinib treatment for rituximab-refractory waldenström’s macroglobulinemia: final analysis of the open-label substudy of the phase 3 iNNOVATE trial. Blood 2020; 136 (Supplement 1): 2937 8 Treon SP et al.: Long-term follow-up of ibrutinib monotherapy in symptomatic, previously treated patients with waldenström macroglobulinemia. J Clin Oncol 2020; JCO2000555 9 Tam CS et al.: Arandomized phase 3 trial of zanubrutinib vs ibrutinib in symptomatic Waldenstrom macroglobulinemia: the ASPEN study. Blood 2020; 136(18): 2038-50 10 Wang et al.: LOXO-305, a next generation, highly selective, non-covalent btk inhibitor in previously treated mantle cell lymphoma, waldenström‘s macroglobulinemia, and other non-hodgkin lymphomas: results from the Phase 1/2 BRUIN study. Blood 2020; 136 (Supplement 1): 117
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...