Nebenwirkungen gezielt managen: Praxis nach S3- und internationalen Leitlinien
Autor:innen:
OA Dr. med. Hassan Naim
Prof. Dr. med. David Blum
PD Dr. med. Caroline Hertler
Universitätsspital Zürich
Klinik für Radio-Onkologie
Kompetenzzentrum für Palliative Care
Interdisziplinäres Zentrum für Hochpräzisionstherapie, Zürich
Korrespondenz:
E-Mail: hassan.naim@usz.ch
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Systemische Krebstherapien verlängern Leben und kontrollieren Tumorerkrankungen. Entscheidend ist, dass Patient:innen die Behandlung gut vertragen. Das gelingt mit klaren, vorausschauenden Supportivstrategien: Risiken früh erfassen, prophylaktisch handeln, Nebenwirkungen stufenbasiert therapieren und eng nachkontrollieren – im Sinne der S3-Leitlinie und ergänzender internationaler Empfehlungen.1
Keypoints
-
Antiemese, Infektprophylaxe und Aufklärung vor Therapiebeginn standardisieren.
-
Immuntherapie-Toxizitäten (irAE, «immune-related adverse events») organbezogen und gradabhängig managen; klare Notfallwege definieren.
-
Unter TKI (Tyrosinkinase-Inhibitor) v.a. Hypertonie, HFSR (Hand-Fuss-Hautreaktion) und Diarrhö/QTc (korrigiertes QT-Intervall) aktiv adressieren.
-
Adhärenz, Notfallwege, Dosisanpassungen und Reexposition dokumentieren.
Warum jetzt handeln?
Nebenwirkungen sind ein häufiger Grund für Dosisreduktion, Unterbruch oder vermeidbare Hospitalisation. Die S3-Leitlinie «Supportive Therapie» (032-054OL, Version 2.0; 2.4.2025) bietet einen Informationsrahmen von Emesis über Myelosuppression und Mukositis bis zu zielgerichteten Therapien. Konsequente Umsetzung der Empfehlungen stabilisiert Lebensqualität und Therapieadhärenz; hilfreich sind SOP (Standardarbeitsanweisungen), frühe Follow-ups (z.B. Telefonkontakt <72 Stunden) und definierte Eskalationspfade.1
Chemotherapie: Klassiker im Vorbeugen und Behandeln
Antiemese: nach emetogenerRisikoklasse steuern
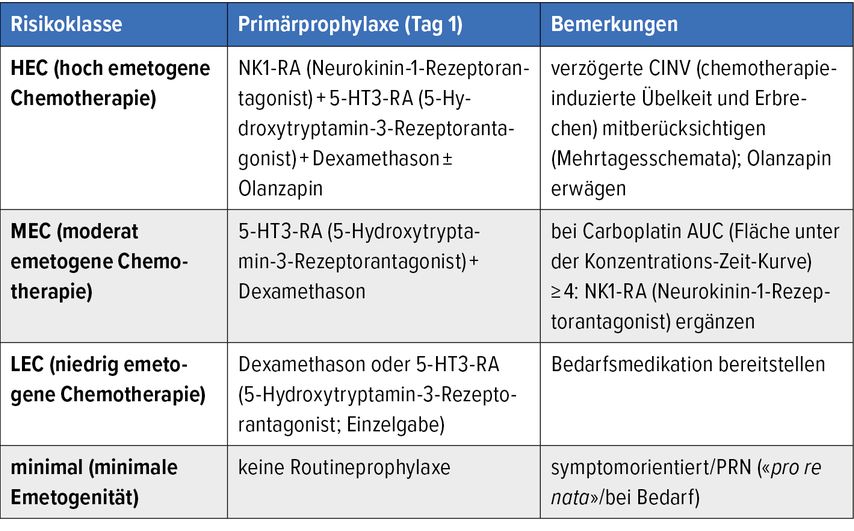
Die Primärprophylaxe bei Emesis und Nausea richtet sich nach patient:innenspezifischen Faktoren und der emetogenen Risikoklasse des Regimes. Es werden vier Klassen unterteilt:
-
hoch emetogene Chemotherapie (HEC)
-
moderat emetogene Chemotherapie (MEC)
-
niedrig emetogene Chemotherapie (LEC)
-
minimale Emetogenität
Bei HEC ist die antemetische Standardtherapie:
-
Neurokinin-1-Rezeptorantagonist(NK1-RA)
-
+5-Hydroxytryptamin-3-Rezeptorantagonist (5-HT3-RA)
-
+Dexamethason
-
± Olanzapin
Bei einer Carboplatinfläche unter der Konzentrations-Zeit-Kurve (AUC) von ≥4 sollte ein Neurokinin-1-Rezeptorantagonist (NK1-RA) ergänzt werden.
Das Update der Multinational Association of Supportive Care in Cancer (MASCC)/European Society for Medical Oncology (ESMO) 2023/24 präzisiert die Klassifikation – u.a. für orale Onkologika – und ergänzt die S3-Empfehlungen. Praktisch gesehen bedeutet das:1,2
-
Antiemese fix im Operationsplan
-
Antiemese bei Durchbruch-chemotherapieinduzierte Übelkeit und Erbrechen (CINV) eskalieren/wechseln
-
Adhärenz prüfen
Febrile Neutropenie –Notfall bleibt Notfall
Primärprophylaxe mit G-CSF
Bei einem Risiko für febrile Neutropenie (FN) von ≥20% (oder 10–20% plus Risikofaktoren) ist eine Primärprophylaxe mit G-CSF (Granulozyten-Kolonie-stimulierender Faktor) möglich. Bei Fieber ist eine sofortige Sepsisabklärung nötig, Blutkulturen sollten erstellt und unverzüglich antipseudomonale Antibiotika i.v. verabreicht werden. Nach Stabilisierung kann deeskaliert werden. Orale Strategien sind ausgewählten Niedrigrisikopatient:innen vorbehalten.1
Tab. 1: Standard-Antiemese nach emetogener Risikoklasse (Auszug; modifiziert nach S3-Leitlinie und Jordan K et al.)1,2
Risikofaktoren für febrile Neutropenie
-
Alter ≥65 Jahre, schlechter Allgemeinzustand (AZ)/ECOG-Status ≥2
-
vorbestehende Neutropenie/Knochenmarksinfiltration oder frühere FN
-
Organfunktionsstörung (Niere/Leber), Mangelernährung/niedriges Albumin
-
hohe Myelotoxizität oder dosisintensive/dosisdichte Chemotherapie-Regime
-
aktive Infektion, offene Wunden/rezente Operation, mehrere Komorbiditäten
-
fortgeschrittene Erkrankung, vorangegangene Chemo-/Radiotherapie
-
Immunsuppression (z.B. HIV, systemisch verabreichte Steroide)
Bei einem FN-Risiko von 10–20% sollte man eine Prophylaxe erwägen, wenn ≥1 Faktor vorliegt.
Mukositis, Diarrhö, Fatigue & CIPN – strukturiert vorgehen Mukositis:
-
konsequente Mundpflege
-
Analgesie
-
Ernährungssupport
-
in ausgewählten Situationen Palifermin erwägen
Chemotherapie-assoziierte Diarrhö (v.a. 5-FU [5-Fluorouracil)/Capecitabin/Irinotecan]):
-
Loperamid hochdosiert
-
refraktär Octreotid
-
Flüssigkeit/Elektrolyte aktiv managen
Fatigue:
-
Aufklärung
-
gezielte Bewegungstherapie
-
Schlafhygiene
-
Symptomkontrolle (Anämie/Schmerz/Depression)
CIPN (chemotherapieinduzierte periphere Neuropathie):
-
Prävention via Dosis-/Zeitmanagement
-
symptomorientierte Therapie, v.a. Duloxetin bei schmerzhafter Neuropathie1
Immuntherapie: irAE erkennen, einstufen und kommunizieren
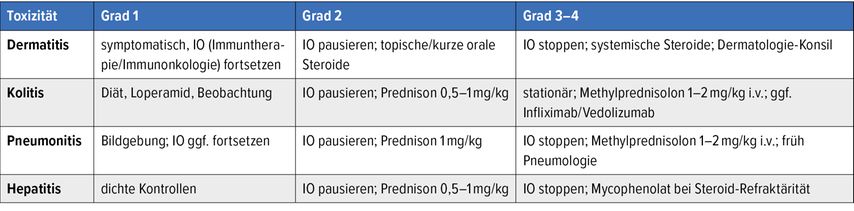
Immuncheckpoint-Inhibitoren führen zu organübergreifenden Nebenwirkungen (Haut, Darm, Lunge, Leber, endokrin, kardial/neurologisch).
ESMO 2022 und ASCO (American Society of Clinical Oncology) 2021 definieren auf CTCAE («common terminology criteria for adverse events») basierte Schweregrade (Grad 1–4), Diagnostik und Therapie, inkl. Steroid-Ein-/Ausschleichen und Zweitlinien-Immunsuppression (z.B. mit Infliximab, Mycophenolat).
Empfehlenswert ist eine niedrigschwellige Diagnostik (Labor inkl. TSH/Kortisol-Achse, Stuhltests/Bildgebung, ggf. Endoskopie) und ein Notfallpass mit 24/7-Kontaktweg.3,4
Tab. 2: Kurzalgorithmus irAE(«immune-related adverse event»)-Management (Auswahl; modifiziert nach Haanen JBAG et al. und Schneider BJ et al.)3,4
Praktische Hinweise
Immuntherapie/Immunonkologie
-
Bei Endokrinopathien (Hypo-/Hyperthyreose, Hypophysitis, Nebenniereninsuffizienz) wird substituiert; IO(Immuntherapie/Immunonkologie)-Fortsetzung ist nach Stabilisierung möglich.3,4
-
Reexposition nach irAE («immune-related adverse event») von Grad 2–3 ist möglich, aber individuell zu entscheiden (Organ, Verlauf, Rezidivrisiko).3,4
-
Dokumentation/Schulung (Steroidschema, Warnzeichen) reduziert Rehospitalisationen.3,4
Tyrosinkinase-Inhibitoren:die Trias im Alltag sicher führen
Unter VEGF-(T)KI («vascular endothelial growth factor»-Tyrosinkinase-Inhibitoren) steht die Hypertonie als Nebenwirkung im Vordergrund.
Die European Society of Cardiology (ESC) 2022 empfiehlt «Angiotensin-converting-enzyme»(ACE)-Hemmer, Angiotensinrezeptorblocker (ARB) oder Dihydropyridin-Kalziumantagonisten (z.B. Amlodipin) als bevorzugte Antihypertensiva; Verapamil/Diltiazem sollten wegen Interaktionen gemieden werden. Ziel ist die Kontinuität der onkologischen Therapie ohne kardiovaskuläre Komplikation.
Hauttoxizitäten (v.a. Hand-Fuss-Haut-Reaktion, HSFR) werden mit ureahaltiger Pflege, Druckentlastung und bei Grad 2–3 mit Dosispausen/-reduktion plus topischen Steroiden behandelt. Persistierende Diarrhö erfordert ein Elektrolytmanagement und einen Interaktionscheck; bei Diarrhö von Grad ≥3 ist eine Dosisanpassung/ein Unterbruch gemäss Fachinformation und Leitlinie angebracht.
QTc-Monitoring (korrigiertes QT-Intervall) ist bei ausgewählten TKI obligat (z.B. BCR-ABL-Inhibitoren).5
Literatur:
1 Leitlinienprogramm Onkologie (DKG/DKH/AWMF), S3-Leitlinie: Supportive Therapie bei onkologischen Patient:innen. Version 2.0; 02.04.2025. AWMF-Registernummer 032-054OL 2 Jordan K et al.: Emetic risk classification and evaluation of the emetogenicity of antineoplastic agents — updated MASCC/ESMO consensus recommendation. Support Care Cancer 2023/2024; 32(1): 53 3 Haanen JBAG et al.: Management of toxicities from immunotherapy: ESMO Clinical Practice Guideline. Ann Oncol 2022; 33(12): 1217-38 4 Schneider BJ et al.: Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: ASCO Guideline Update. J Clin Oncol 2021; 39(36): 4073-126 5 Lyon AR et al.: 2022 ESC Guidelines on cardio-oncology (EHA/ESTRO/IC-OS). Eur Heart J 2022; 43(41): 4229-361
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...