Multiples Myelom im Wandel: neue Daten
Autoren:
Prof. Dr. Heinz Ludwig1
OA Dr. Martin Schreder2
1Wilhelminen Krebsforschungsinstitut c/o I. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie mit Ambulanz und Palliativstation
Klinik Ottakring, Wien
2I. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie mit Ambulanz und Palliativstation
Klinik Ottakring, Wien
Korrespondenz:
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
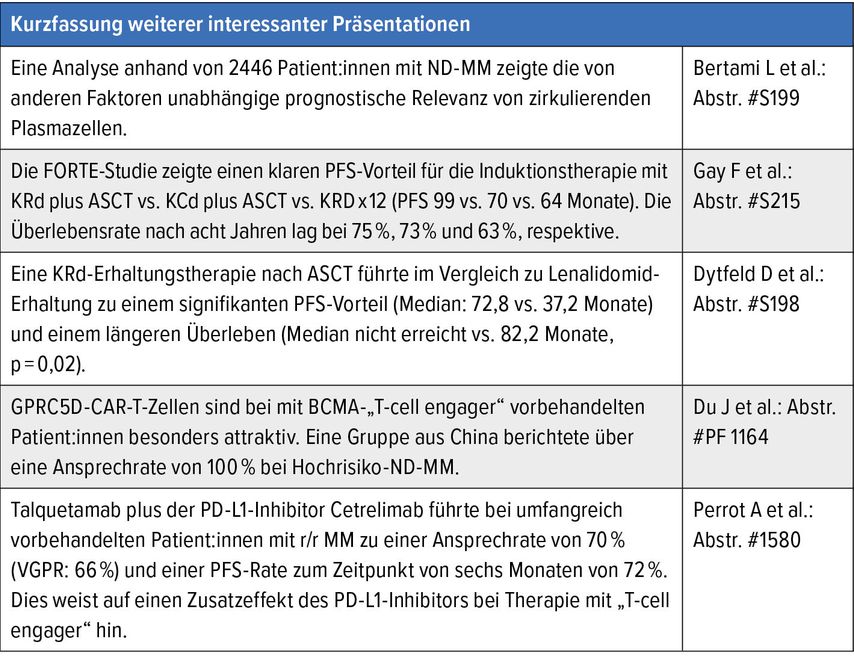
Der diesjährige EHA-Kongress wurde in Mailand abgehalten, einer Großstadt, die über eineVielzahl von eindrucksvollen historischen Sehenswürdigkeiten verfügt, aber auch als Wirtschafts-, Kultur- und Modemetropole geschätzt wird. So vielschichtig wie das Geschäftsleben in der Stadt waren auch die Präsentationen am Kongress, sodass hier nur eine subjektiv gefärbte Auswahl wichtiger Präsentationen geboten werden kann.
Erstlinientherapie
MIDAS: MRD-gesteuerte Konsolidierung
Die MIDAS-Studie verfolgt eine MRD-gesteuerte Konsolidierungstherapie nach Isa-KRd-Induktion (Isatuximab, Carfilzomib, Lenalidomid, Dexamethason) bei für eine Transplantation geeigneten Patient:innen mit neu diagnostiziertem multiplem Myelom (ND-MM). Die berichteten Ergebnisse stellen die Rolle einer autologen Stammzelltransplantation (ASCT) infrage.
Insgesamt wurden 791 Patient:innen (≤65 Jahre) eingeschlossen. Die Induktionstherapie bestand aus sechs Zyklen Isa-KRd, danach wurde der MRD-Status (minimale Resterkrankung) mittels NGS (Next-Generation-Sequencing; Sensitivität von 10–5) bestimmt. Darauf folgend wurden MRD-negative Patient:innen entweder in eine Gruppe mit ASCT plus zwei Zyklen Isa-KRd oder in eine Gruppe ohne ASCT, dafür mit sechs weiteren Zyklen Isa-KRd, randomisiert. Der Vergleich beider Gruppen wies keinen Unterschied im progressionsfreien Überleben (PFS) und somit keinen Vorteil für die ASCT auf.
Nach Induktionstherapie wuden 233 MRD-positive Patient:innen in eine Gruppe mit Tandem-ASCT sowie eine Kohorte mit einfacher ASCT plus zwei Zyklen Isa-KRd randomisiert. Die Ergebnisse zeigten keinen Unterschied in der MRD-Rate der beiden Gruppen (32% in Doppel-ASCT bzw. 40% in der ASCT-Kohorte). Somit erübrigen sich eine ASCT bei Patient:innen, die nach Induktion MRD-negativ sind, sowie eine Doppeltransplantation bei MRD-positiven Patient:innen.
ADVANCE: KRd+Daratumumab
Prof. Dr. Ola Landgren präsentierte die Daten einer der seltenen akademischen Studien, die in den USA durchgeführt wurden, der ADVANCE-Studie. 306 Patient:innen (medianes Alter 62 Jahre) wurden in eine Gruppe mit acht Zyklen KRd+Daratumumab bzw. in eine Vergleichskohorte mit KRd randomisiert. Patient:innen, die nach Induktion MRD-positiv waren, wurde eine ASCT angeboten, während MRD-negative Patient:innen eine Lenalidomid-Erhaltungstherapie erhielten. Primärer Endpunkt war das Erreichen eines MRD-Negativitäts-Status, wobei die MRD-Bestimmung einmal jährlich mittels clonoSEQ vorgenommen wurde.
Dara-KRd führte zu einer signifikant höheren MRD-Negativitäts-Rate (59% vs. 36%; p<0,0007). Die Endpunkte, ereignisfreies Überleben (EFS), PFS und Gesamtüberleben (OS), waren zum Zeitpunkt der Präsentation noch nicht erreicht; allerdings waren 86% im Dara-KRd-Arm bzw. 79% im KRd-Arm zum Zeitpunkt der Analyse progressionsfrei. Neue Sicherheitssignale wurden nicht beobachtet. Aufgrund der überlegenen Wirksamkeit von Dara-KRd schlagen die Autor:innen diese Kombination als neuen Therapiestandard vor.
ISKIA: Isa-KRd und ASCT
Ähnliche Ergebnisse wie in der ADVANCE-Studie wurden von Dr. Francesca Gay im Rahmen des Updates zur ISKIA-Studie präsentiert. Insgesamt wurden 302 Patient:innen unter 70 Jahren mit neu diagnostiziertem multiplem Myelom (ND-MM) in zwei Arme randomisiert: Eine Gruppe erhielt Isa-KRd, die Kontrollgruppe wurde lediglich mit KRd behandelt.
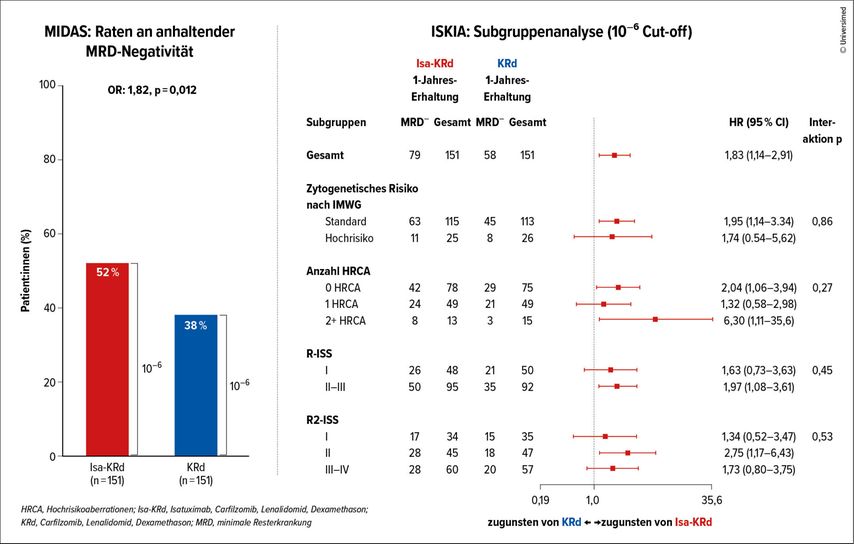
Das Studienprotokoll sah vier Zyklen einer Induktionstherapie, gefolgt von einer autologen Stammzelltransplantation (ASCT) und weiteren vier Konsolidierungszyklen vor. Anschließend erfolgte eine „leichte Konsolidierung“ mit reduzierter Dosierung. Durch die Ergänzung von Isatuximab wurde eine signifikant höhere MRD-Negativitäts-Rate erzielt (clonoSEQ, Sensitivität 10–5): 67% im Isa-KRd-Arm gegenüber 48% im KRd-Arm (p<0,001). Nach Abschluss der Konsolidierungsphase lagen die MRD-Raten bei 52% vs. 38% (p=0,012; Abb.1).
Abb. 1: Mit Isa-KRd wurden höhere Raten an anhaltender MRD-Negativität im Vergleich zu KRd erzielt (modifiziert nach Perrot A et al.). Der Forest-Plot zeigt den Vorteil durch die Kombination mit Isatuximab bei allen Risikogruppen inklusive Patient:innen mit zwei oder mehr zytogenetischen Aberrationen (modifiziert nach Gay F et al. 2025)
Insbesondere bei Patient:innen mit ≥2 zytogenetischen Hochrisikomerkmalen zeigte sich ein deutlicher Vorteil für die Isa-KRd-Kombination (MRD-negativ: 62% vs. 20%). Ähnliche Ergebnisse wurden bei Patient:innen mit einem R2-ISS-Stadium III/IV beobachtet (47% vs. 35%). Auch diese Studie zeigte ein günstiges Sicherheitsprofil, ohne Hinweise auf neue oder unerwartete Risiken.
Neue Option zur frühzeitigen Behandlung einer MRD-Konversion
PREDATOR: Daratumumab bei MRD-Konversion
In die Studie PREDATOR wurden Patient:innen mit multiplem Myelom aufgenommen, die nach ein bis zwei Vortherapien MRD-negativ waren. Die MRD wurde alle vier Monate mittels clonoSEQ (Schwellenwert ≤10–5) bestimmt. Bei Patient:innen, die eine Konversion von MRD-Negativität zu MRD-Positivität zeigten – jedoch ohne Erfüllung der CRAB-Kriterien oder signifikanten Paraproteinanstieg – erfolgte eine Randomisierung in eine Beobachtungsgruppe oder in einen Interventionsarm mit Daratumumab nach dem üblichen Therapieschema.
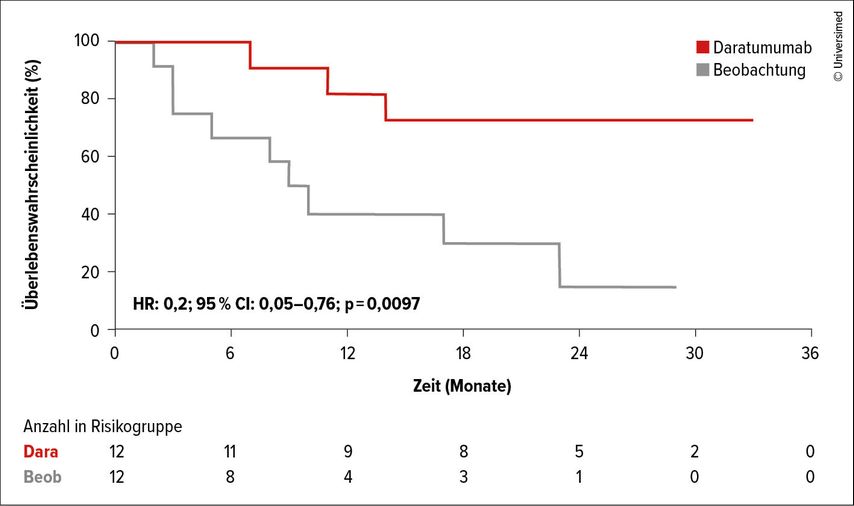
Zwischen 2019 und 2023 wurden insgesamt 54 Patient:innen in die Studie eingeschlossen, bei 29 von ihnen trat eine MRD-Konversion auf. Die mediane Zeit bis zur Konversion betrug 11,3 Monate. 24 Patient:innen mit MRD-Progression wurden randomisiert. Nach einer medianen Nachbeobachtungszeit von 17,9 Monaten lag das EFS bei 9,5 Monaten in der Kontrollgruppe und war im Daratumumab-Arm noch nicht erreicht (HR: 0,20; 95% CI: 0,05–0,76; p=0,0097).
Bemerkenswert ist, dass sieben von zwölf Patient:innen (67%) im Daratumumab-Arm bereits zwei Zyklen nach Therapiebeginn wieder eine MRD-Negativität erreichten. Die häufigsten Nebenwirkungen waren Infektionen (58% vs. 16%) und Schmerzen (33% vs. 8%; Abb.2).
Abb. 2: Durch eine Daratumumab-Therapie konnte bei 67% der Patient:innen mit Wiederauftreten einer MRD-Positivität neuerlich ein MRD-negativer Status erreicht werden (modifiziert nach Jamroziak K et al., EHA 2025)
Diese Pilotstudie legt nahe, dass eine frühzeitige Intervention mit Daratumumab bei subklinischer MRD-Konversion eine erneute MRD-Negativität induzieren und das Fortschreiten der Erkrankung möglicherweise verzögern kann.
MagnetisMM-6: bispezifischebzw. trispezifische Antikörper
In der MagnetisMM-6-Studie wird die Wirksamkeit einer Kombinationstherapie mit Elranatamab, Daratumumab und Lenalidomid mit dem Standardregime Daratumumab, Lenalidomid und Dexamethason bei Patient:innen mit ND-MM verglichen, die nicht für eine Stammzelltransplantation geeignet sind. Insgesamt sollen rund 1100 Patient:innen weltweit eingeschlossen werden.
Teil 1 der Studie, vorgestellt von Prof. Dr. Meletios Dimopoulos, diente der Dosisfindung für die anschließende Phase III. Nach einer Step-up-Dosierung wurde die empfohlene Dosierung auf Elranatamab 76mg s.c. alle vier Wochen in Kombination mit Daratumumab und Lenalidomid (Standarddosis) festgelegt.
Bei einem medianen Follow-up von 7,9 Monaten zeigte sich eine beeindruckende Gesamtansprechrate von 97,3%, wobei 94,6% der Patient:innen eine sehr gute partielle Remission (VGPR) erreichten. Zu den häufigsten Nebenwirkungen zählten das Zytokinfreisetzungssyndrom (CRS) in 62% der Fälle (ausschließlich Grad 1/2) und Infektionen in 70,3% der Fälle, wobei schwere Verläufe (Grad 3/4) bei 18,9% dokumentiert wurden.
Der Sponsor erwartet durch den Einsatz von Elranatamab nicht nur tiefere Remissionen, sondern auch ein vereinfachtes Dosierungsschema, das eine frühzeitige Etablierung des Regimes als potenzielle Erstlinientherapie ermöglichen könnte. Die finalen Studienergebnisse werden für das Jahr 2028 erwartet.
RedirecTT-1: Teclistamab+Talquetamab
Dr. Shaji Kumar präsentierte die Follow-up-Daten der RedirecTT-1-Studie, in der Teclistamab (ein bispezifischer Anti-BCMA-Antikörper [BsAk]) gemeinsam mit Talquetamab (ein GPRC5D-BsAk) bei 90 Patient:innen mit rezidiviertem/refraktärem multiplem Myelom (r/r MM) zum Einsatz kam.
Alle Patient:innen wurden zuvor mit mindestens drei Medikamentenklassen behandelt, viele auch Penta-refraktär. Eine Subgruppe von 90 Patient:innen wies extramedulläre Krankheitsmanifestationen (EMD) auf; in dieser Kohorte hatten 18 eine Vortherapie mit BCMA-CAR-T-Zellen und acht eine Behandlung mit BsAk gegen FcRH5, 11 Patient:innen wurden mit Belamaf vorbehandelt. Das kombinierte Therapieregime bestand aus Talquetamab in einer Dosis von 0,8mg/kg und Teclistamab mit 3,0mg/kg, jeweils verabreicht im zweiwöchentlichen Rhythmus.
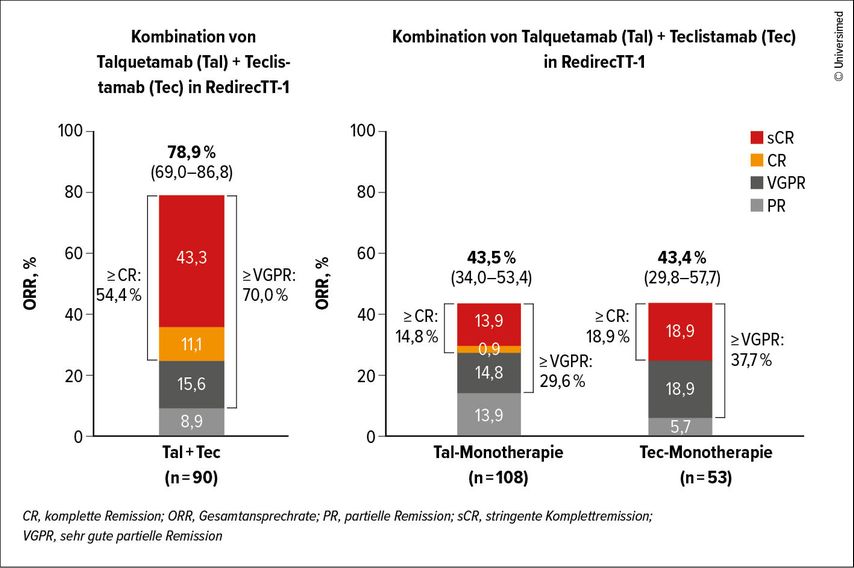
Nach einer medianen Nachbeobachtungszeit von 12,6 Monaten zeigten sich bei Patient:innen mit extramedullärem Myelom eine Gesamtansprechrate von 78,9% und eine Rate kompletter Remissionen von 54,4%. Bei 70% wurde mindestens eine sehr gute partielle Remission erreicht. Die Rate des progressionsfreien Überlebens nach einem Jahr betrug 61%, das mediane PFS lag bei 15,4 Monaten. Die Ein-Jahres-Überlebensrate betrug 74,5%. Zwei Drittel der Responder blieben unter Therapie, und mehr als drei Viertel konnten erfolgreich auf ein monatliches Dosierungsschema umgestellt werden (Abb. 3).
Abb. 3: In der RedirecTT-1 Studie wurde eine hohe Ansprechrate (78,9%) erzielt, weit höher, als mit den Einzelsubstanzen in einer vergleichbaren Patient:innenpopulation erreicht werden konnte (modifiziert nach Kumar S et al., EHA 2025)
Die häufigste Nebenwirkung war das Auftreten von Infektionen, die bei 86,4% der Patient:innen beobachtet wurden. Ein Zytokinfreisetzungssyndrom trat in 77,8% der Fälle auf, meist während der Step-up-Dosierung und mit überwiegend mildem Verlauf (Grad 1–2). Eine neurotoxische Nebenwirkung (ICANS) wurde bei 12,2% dokumentiert, ebenfalls meist mild. 11% der Patient:innen erlitten eine Grad-5-Nebenwirkung, davon war die Hälfte infektiöser Natur.
Die vorgestellten Ergebnisse übertreffen jene bisheriger Monotherapien deutlich und lassen vermuten, dass diese duale bispezifische Therapie bei extramedullärer Erkrankung eine wirksame und praktikable Option darstellen könnte – mit einem beherrschbaren Sicherheitsprofil auch in einer Hochrisikopopulation.
LINKER-MM1: Linvoseltamab zugelassen
Linvoseltamab ist ein BsAk, mit BCMA und CD3 als Target. Im April dieses Jahres wurde er von der EMA sowie im Juli von der FDA für die Behandlung von Patient:innen mit r/r MM zugelassen.
Die Zulassung basiert auf den Ergebnissen der LINKER-MM1-Studie, in die Patient:innen mit „triple-class“ oder „penta-class“ refraktärer Erkrankung eingeschlossen wurden. Linvoseltamab wurde zunächst wöchentlich verabreicht, später – abhängig vom Ansprechen – im zwei- bzw. vierwöchentlichen Intervall intravenös appliziert.
Nach einer medianen Nachbeobachtungszeit von 14,3 Monaten zeigte sich eine Gesamtansprechrate (ORR) von 70,9%, wobei 49,6% der Patient:innen eine komplette Remission oder besser erreichten. Die geschätzte mediane Dauer des Ansprechens (DOR) lag bei 29,4 Monaten; das mediane progressionsfreie Überleben (PFS) zum Zeitpunkt von zwölf Monaten lag bei 70%, das mediane Gesamtüberleben (OS) bei 31,4 Monaten.
In Subgruppenanalysen zeigten sich besonders hohe Ansprechraten bei bestimmten Patient:innen: Bei weniger als 50% Knochenmarkplasmazellen lag die ORR bei 78,5%, bei „triple-class“ refraktären Fällen bei 73,7% und bei Patient:innen mit niedrigem sBCMA-Spiegel (<400ng/mL) sogar bei 83,1%.
Das Sicherheitsprofil war insgesamt günstig; die häufigsten Nebenwirkungen waren CRS mit 46,2%, Neutropenie mit 42,7%, Anämie mit 38,5% sowie Erschöpfung bei 33,3% der Patient:innen. Die meisten unerwünschten Ereignisse waren leicht bis moderat ausgeprägt.
LINKER-MM2: Linvoseltamabplus Bortezomib/Carfilzomib
In der LINKER-MM2-Studie (Phase Ib, offene Multikohorten-Studie) wurde Linvoseltamab in Kombination mit Bortezomib beziehungsweise Carfilzomib bei Patient:innen mit r/r MM untersucht. Eingeschlossen wurden Patient:innen mit mindestens drei Vortherapien oder mindestens zwei bei vorhergegangener T-Zell-Engager-Therapie (TCE) oder „double-class“ refraktärer Erkrankung.
Die Kombination von Linvoseltamab (100mg oder 200mg, nach Step-up-Dosierung) mit Bortezomib (1,3mg/m2, zweimal pro Woche über acht Zyklen) zeigte eine Gesamtansprechrate von 79% (11 von 14 evaluierbaren Patient:innen) sowie eine PFS-Rate nach sechs Monaten von 79%.
Noch bessere Ergebnisse wurden mit der Kombination von Linvoseltamab und Carfilzomib (56mg/m2, zweimal pro Woche) erzielt. Die Ansprechrate lag in Abhängigkeit von der Linvoseltamab-Dosis bei 91% bis 100%; die PFS-Rate nach sechs Monaten betrug 91% in der Dosierungsgruppe DL1, wobei in der höheren Dosierung (DL1b) zum Zeitpunkt der Analyse noch kein PFS-Ereignis dokumentiert wurde.
Die beobachteten Nebenwirkungen entsprachen dem bekannten Sicherheitsprofil der Kombinationstherapien und umfassten insbesondere Infektionen (91% in der Kohorte mit Carfilzomib, wobei 43,5% dieser Fälle Grad ≥3 waren; 75% in der Gruppe mit Bortezomib, davon 38% mit Grad ≥3). Weitere Nebenwirkungen in der Kohorte mit Carfilzomib waren Neutropenie (78%), Thrombozytopenie (61%), CRS in 61% der Fälle (alle Grad 1–2), eine milde neurotoxische Komplikation (ICANS, ein Fall mit Grad 1) sowie Infektionen bei 89% der Patient:innen – davon 44% mit Ereignissen ≥Grad 3.
Der trispezifische Antikörper JNJ-5322
Dr. Rakesh Popat stellte die ersten klinischen Ergebnisse der Phase-I-Studie mit dem trispezifischen Antikörper JNJ-5322 bei Patient:innen mit r/r MM in der Plenary-Abstract-Session vor. Dieser neue trispezifische T-Zell-„redirecting“ Antikörper bindet gleichzeitig an BCMA und GPRC5D auf Myelomzellen sowie an CD3 auf T-Zellen, mit dem Ziel einer breiten Antigenabdeckung, um Tumorheterogenität und Resistenzmechanismen zu überwinden – mit potenziell höherer Spezifität und geringerer Off-Target-Toxizität. 125 Patient:innen mit r/r MM (alle „triple-class exposed“) wurden in die Phase-I-Dosiseskalationsstudie aufgenommen. Als empfohlene Phase-II-Dosis wurden 100mg s.c. q 4 Wochen etabliert (Q4W; nach einer Step-up-Dosis beginnend mit 5mg).
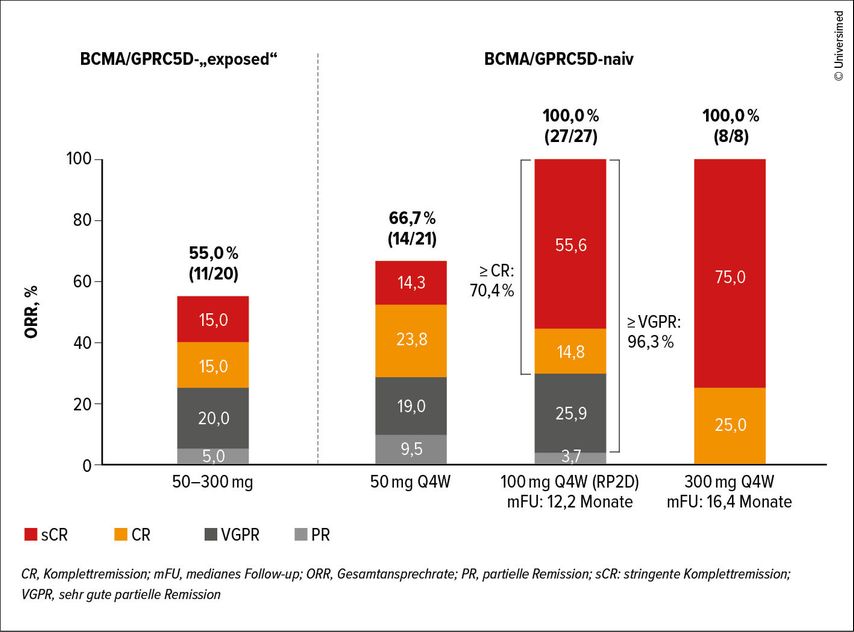
Mit dieser Dosis wurde eine Ansprechrate von 86% erzielt, 66% erreichten eine VGPR. Bei BCMA/GPRC5D-naiven Patient:innen lag die Ansprechrate bei 100% ORR, wobei 89% ein ≥VGPR erreichten. Die mediane Zeit bis zum Ansprechen war mit 1,2 Monaten kurz (Abb.4).
Abb. 4: Mit dem trispezifischen Antikörper JNJ-5322 konnte eine Ansprechrate von 100% bei BCMA/GPRC5D-naiven Patient:innen mit r/r MM erreicht werden (modifiziert nach Popat R et al., EHA 2025)
An Nebenwirkungen waren CRS (alle Grad 1–2) bei 59% der Patient:innen, Infektion bei 75% (28% Grad 3) und Neutropenie bei 48% (41% Grad 3/4) der Patient:innen zu verzeichnen. 56% der Patient:innen berichteten über Geschmacksveränderungen (Grad 1/2) und Nagelveränderungen (Grad 1/2), 2% über Immuneffektorzell-assoziiertes Neurotoxizitätssyndrom (ICANS; alle Grad 1). Es gab vier therapiebedingte Todesfälle, darunter einer durch adenovirale Enzephalitis.
Somit zeigen die Daten mit JNJ-5322 eine ähnliche Wirkung wie CAR-T-Zellen, sind aber „off the shelf“ sofort verfügbar und dürften eine neue Generation der Immuntherapie bei r/r MM einläuten. Zu erwähnen ist, dass beim ASCO-Jahrestreffen von Prof. Dr. Hang Quach ein weiterer trispezifischer Antikörper (ISB 2001 von Ichnos Glenmark), der mit BCMA, CD30 und CD 38 reagiert, vorgestellt wurde. Die damit erzielte Ansprechrate von 81% war ähnlich eindrucksvoll.
Interessante Datenzu CAR-T-Zell-Therapien
CARTITUDE-4: Ciltacabtagen Autoleucel
In der CARTITUDE-4-Studie wurde die Wirksamkeit von Ciltacabtagen Autoleucel (Cilta-cel) im Vergleich zur Standardtherapie (PVd oder DPd) bei Lenalidomid-refraktären Patient:innen mit rezidiviertem/refraktärem multiplem Myelom nach ein bis drei vorhergehenden Therapielinien untersucht.
Beim ASCO-Jahrestreffen 2025 wurden Langzeitdaten mit einer medianen Nachbeobachtungszeit von 33,6 Monaten von Dr. Surbhi Sidana in einer mündlichen Präsentation vorgestellt. Beim EHA-Jahrestreffen 2025 erfolgte die Vorstellung im Rahmen eines Poster-Beitrags. Die MRD-Negativitäts-Rate lag unter Cilta-cel bei 62% in der Intent-to-treat-Population (ITT) und bei 89% in der auswertbaren Subgruppe. Die entsprechenden Werte in der Kontrollgruppe lagen bei 18% (ITT) und 38% (auswertbare Subgruppe).
Die Raten für eine anhaltende MRD-Negativität ≥12 Monate betrugen mit Cilta-cel 40% in der Intent-to-treat-Population bzw. 75% in der auswertbaren Subgruppe; in der Kontrollgruppe lagen die Werte bei 6% bzw. 50%.
Das PFS wurde im Cilta-cel-Arm noch nicht erreicht, während es in der Kontrollgruppe bei 37,8 Monaten lag. Auch das mediane OS wurde in beiden Gruppen noch nicht erreicht. Besonders bemerkenswert: In der Cilta-cel-Gruppe waren nach fünf Jahren noch 33% der Patient:innen ohne Erhaltungstherapie am Leben – ein Hinweis auf das Potenzial für ein tiefe und dauerhafte Remission.
iMMagine-1: Anitocabtagen Autoleucel
Die Phase-II-Studie iMMagine-1 wurde von Dr. Gurbakhash Kaur präsentiert. In dieser Untersuchung wurde Anitocabtagen Autoleucel (Anito-cel), ein BCMA-gerichtetes CAR-T-Zell-Produkt mit neuartigem D-Domain-Binder, bei 98 Patient:innen mit umfangreich vorbehandelten r/r MM (median vier Vortherapien) geprüft. Die Besonderheiten von Anito-cel liegen beim Rezeptor, der kleiner und stabiler als bei den anderen Produkten ist, eine hohe Transduktionseffizienz aufweist und schneller wieder von BCMA dissoziiert, was möglicherweise für die geringe Inflammation verantwortlich ist.
Bei den 86 auswertbaren Datensätzen der Patient:innen wurden eine Gesamtansprechrate (ORR) von 97% und eine CR/sCR bei 68% der Patient:innen erzielt. 93 dieser Patient:innen erreichten einen MRD-negativen Status. Die PFS-Rate lag zum Zeitpunkt von sechs Monaten bei 91,9%, die OS-Rate bei 96,6%.
CRS (Grad 1) wurde bei 85% und ICANS (alle reversibel) bei 8% beobachtet, verzögerte neurologische Nebenwirkungen wie Parkinsonismus oder Guillain-Barré-Syndrom wurden nicht beschrieben.
FasTCAR-T-Zell-Therapie GC012F
Von Dr. Juan Du wurde eine Phase-I-Studie mit der „dual-targeting“ FasTCAR-T-Zell-Therapie GC012F vorgestellt, die auf BCMA und CD19 abzielt. Bei dieser Technologie handelt es sich um ein geschlossenes System, das die Vektortransduktion in 24 Stunden ermöglicht und so die Zeitspanne zwischen Zellapherese und Rücktransfusion der modifizierten T-Zellen in kurzer Zeit ermöglicht.
Insgesamt wurden 29 Patient:innen (medianes Alter: 57 Jahre), von denen laut M-SMART-Kriterien 90% eine Hochrisikokonstellation aufwiesen, in die Studie einbezogen. Nach einer Induktionstherapie mt zwei Zyklen RVD wurden CAR-T-Zellen in ansteigender Dosis (1x105, 2x105 und 3x105 Zellen/kg) insgesamt dreimal verabreicht. Die maximale CAR-T-Zell-Expansion wurde bereits am Tag 10 (Median) erreicht. Ein Ansprechen auf die Therapie sowie ein MRD-negativer Status wurden bei allen Patient:innen beobachtet, eine stringente Komplettremission (sCR) bei 69% der Patient:innen. Neben dem raschen Ansprechen und der MRD-Negativitäts-Rate von 100% ist die hervorragende Therapietoleranz bemerkenswert. CRS (Grad 1–2) wurde bei 23% der Patient:innen beobachtet, während keine Fälle von ICANS verzeichnet wurden. Somit könnte GC012F auch bei Hochrisikopatient:innen eine vielversprechende Alternative zur konventionellen Induktionstherapie sein.
Die FasTCAR-T-Zell-Therapie GC012F könnte die Erstlinientherapie bei Patient:innen mit ND-MM revolutionieren. Sie stellt auch bei Hochrisikopatient:innen eine vielversprechende Alternative zur konventionellen Induktionstherapie dar.
Literatur:
bei den Verfassern
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...