Multiples Myelom – neue EHA/ESMO-Leitlinie
Autor:
OA Dr. Martin Schreder
1. Medizinische Abteilung
Zentrum für Onkologie und Hämatologie
Klinik Ottakring, Wien
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Die neue Leitlinie der europäischen Fachgesellschaften ist kürzlich in Druck erschienen1 und spiegelt die rasante Weiterentwicklung der Therapiekonzepte wider. Hier folgt eine Übersicht über die wichtigsten Inhalte.
Keypoints
-
Die Hochdosis-Therapie mit autologer Stammzelltransplantation bleibt Standard auch mit modernen Induktionsprotokollen.
-
Monoklonale CD38-Antikörper bekommen einen immer höheren Stellenwert in der ersten und spätestens in der zweiten Therapielinie.
-
Die Prognose für tripelrefraktäre Patienten ist verheerend, hier werden insbesondere neue Immuntherapien (Antikörper-Toxin-Konjugate, CAR-T-Zellen, bispezifische Antikörper) entwickelt.
Erstlinientherapie
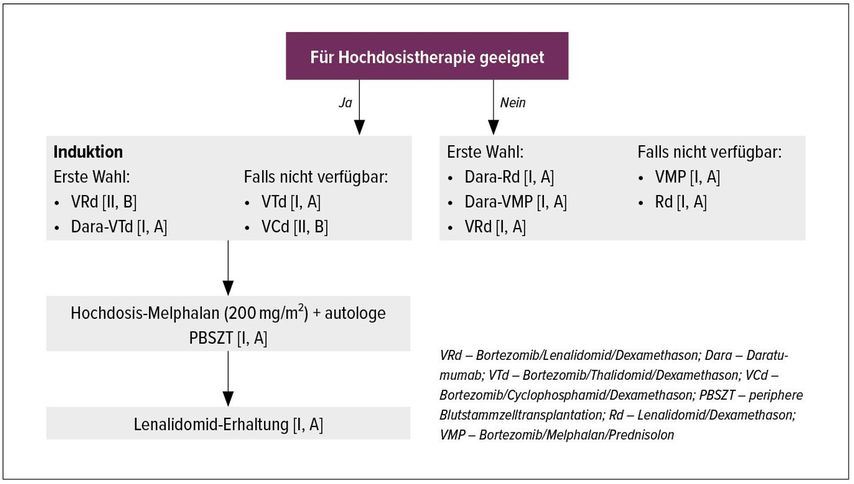
In der Primärtherapie bietet die Hochdosis-Chemotherapie mit Melphalan 200mg/m2 und autologer Stammzelltransplantation auch in der langfristigen Nachbeobachtung der großen Studien EMN02/HOVON952 und IFM20093 einen signifikanten Vorteil im progressionsfreien Überleben (PFS) gegenüber konventioneller Therapie und bleibt somit Standard für alle geeigneten Patienten. Die Induktion soll Bortezomib/Dexamethason und einen Immunmodulator (IMiD) enthalten, wobei in Österreich vorrangig Lenalidomid (VRd) eingesetzt wird. Mit Daratumumab ist erstmals auch ein monoklonaler Antikörper in der Erstlinie zugelassen, derzeit nur mit dem Thalidomid-basierten Schema (VTd) auf Basis der CASSIOPEIA-Studie.4 Für Daratumumab-VRd liegen Ergebnisse einer Phase-II-Studie mit einer 2-Jahres-PFS-Rate von 94,5% vor.5 Die Kombination wird derzeit in einer randomisierten Phase-III-Studie gegen VRd geprüft und einen künftigen Therapiestandard darstellen. Der Einsatz von Alkylanzien ist nur noch in Einzelfällen, etwa bei schwerer Niereninsuffizienz, zu erwägen;6 Carfilzomib könnte für Patienten mit Hochrisiko-Erkrankung interessant werden.7 Über eine Konsolidierung mit weiteren Zyklen des initial eingesetzten Triplets/Quadrupels oder einer Doppeltransplantation muss individuell entschieden werden, aufgrund der Datenlage besteht hier keine einheitliche Empfehlung. Unbestritten ist der Stellenwert einer Erhaltungstherapie mit Lenalidomid für alle Patienten, bei Unverträglichkeit steht mit Ixazomib eine (schwächere) Alternative zur Verfügung.8
Die größten Fortschritte wurden in den letzten Jahren bei Patienten erzielt, die nicht für eine intensive Behandlung infrage kommen. Mit der Kombination aus Daratumumab und Lenalidomid/Dexamethason (DRd, MAIA-Studie) wird bei >80% der Patienten eine tiefe Remission (≥VGPR) erreicht, 60% sind nach 48 Monaten noch rezidivfrei.9 DRd ist somit einer der neuen Standards in der Therapie älterer Patienten, alternativ bietet sich VRd über 8 Zyklen mit anschließender Weiterbehandlung mit Rd bis zur Progression10 an. Das in der Leitlinie formal gleichgestellte Schema mit Daratumumab und oralem Melphalan (D-VMP) wird aus Gründen der Praktikabilität und Verträglichkeit nur selten zum Einsatz kommen (Abb. 1).
Therapieoptionen im Rezidiv
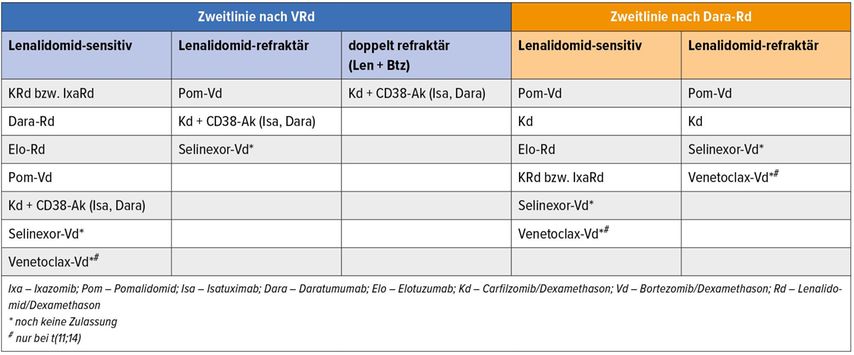
Seit der letzten Auflage der Leitlinien ist die Zahl der Optionen im Rezidiv sprunghaft angestiegen und beinahe unübersichtlich (Tab. 1,2). Durch den breiten Einsatz von Lenalidomid mit oder ohne Bortezomib in der Erstlinie kommt den Proteasomenhemmern und IMiD der zweiten Generation große Bedeutung zu. Carfilzomib/Dexamethason (Kd) ist das einzige Zweierschema mit vernünftiger Wirksamkeit und von Vorteil im Gesamtüberleben (OS),11 im Übrigen sollen nach Möglichkeit Dreifachkombinationen eingesetzt werden. Die Zugabe eines CD38-Antikörpers (Daratumumab12 bzw. Isatuximab)13 zu Carfilzomib bringt Ansprechraten von >80% und eine Risikoreduktion bzgl. Progression von 40% gegenüber Kd, sodass hier eine hervorragende Behandlung für Antikörper-naive Patienten zur Verfügung steht. Für eine Reexposition gegenüber einem CD38-Antikörper nach Vorbehandlung in der Erstlinie liegen bisher keine ausreichend belastbaren Daten vor.
Eine wichtige Rolle in der Rezidivtherapie kommt auch Pomalidomid zu: Im Triplet mit Bortezomib (PVd) wird ein medianes PFS von 17,8 Monaten bei Lenalidomid-refraktären Patienten in der Zweitlinie erreicht.14 Für die Kombination von Pomalidomid und den monoklonalen Antikörpern Isatuximab (CD38; ICARIA-Studie)15 bzw. Elotuzumab (SLAMF7; ELOQUENT-3)16 wird bei Patienten mit ≥2 Vortherapien ein PFS von 11 Monaten berichtet; beide Schemata sind deshalb zum Einsatz ab dem zweiten Rezidiv empfohlen. Ebenso bereits in die Empfehlung aufgenommen wurde Pomalidomid/Dex + Daratumumab, obwohl die Phase-III-Daten bei Erstellung noch nicht verfügbar waren (APOLLO-Studie).17
Mit Venetoclax und Selinexor haben zwei neue Substanzen bereits Eingang in die Leitlinie gefunden, obwohl deren Zulassung durch die EMA noch nicht absehbar ist. Venetoclax zeigte in der BELLINI-Studie bei Kombination mit Bortezomib/Dexamethason sehr hohe Ansprechraten, allerdings ein kürzeres Gesamtüberleben verglichen mit Vd in der Gesamtpopulation. Ein günstiges akzeptables Nutzen-Risiko-Verhältnis besteht dagegen bei MM-Fällen mit t(11;14) und/oder BCL2-Überexpression,18 weshalb die Kombination in dieser Kohorte weiter untersucht wird und nach Ausschöpfen der zugelassenen Optionen außerhalb der Zulassung erwogen werden kann. Selinexor ist als Hemmer des nukleären Transportproteins XPO1 mit einem neuen Wirkmechanismus ausgestattet und oral verfügbar, erfordert wegen der Gefahr erheblicher v.a. gastrointestinaler Toxizität aber eine sehr engmaschige Betreuung der Patienten. In der Kombination mit Bortezomib/Dexa ist Selinexor bei geringerer Einzeldosis besser verträglich, das Ansprechen bei Patienten mit 1–3 Vortherapien lag in der BOSTON-Studie bei 76,4% mit einem PFS von knapp 14 Monaten.19
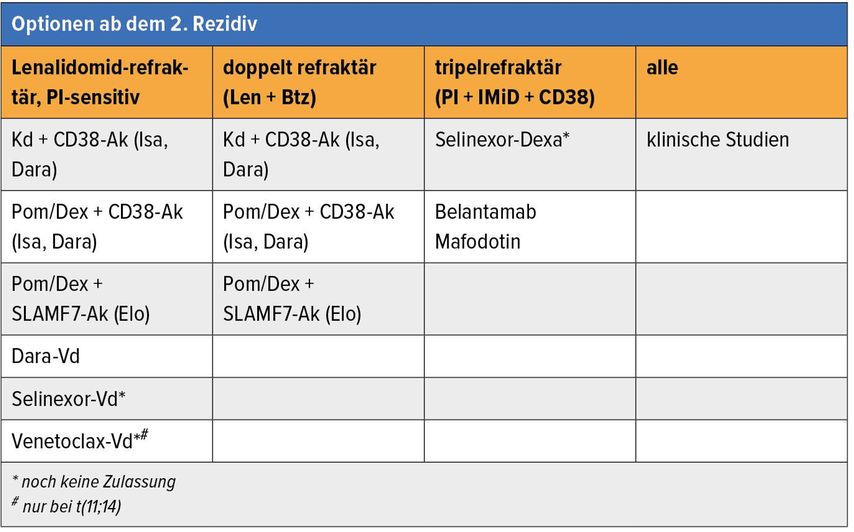
Nach Versagen von Proteasomenhemmern (PI), IMiD und CD38-Antikörpern ist die Prognose der betroffenen Patienten mit einer mittleren Überlebenszeit von <10 Monaten weiterhin verheerend. In dieser Situation steht abgesehen von Selinexor/Dexamethason (STORM-Studie: Ansprechrate 26%, PFS 3,7 Monate)20 jetzt das Antikörper-Toxin-Konjugat Belantamab Mafodotin zur Verfügung. In der Phase-II-Studie wird in der Monotherapie ein Ansprechen von 30% erreicht,21die PFS/OS-Daten sind noch unreif. Die häufig auftretenden Keratopathien stellen eine neue Herausforderung im interdisziplinären Management der betroffenen Patienten dar, darüber hinaus ist das Nebenwirkungsprofil günstig und macht die Substanz zu einem guten Kombinationspartner (z.B. Pomalidomid, Bortezomib).
Ausblick
Im Fokus der klinischen Forschung stehen derzeit immuntherapeutische Konzepte wie CAR-T-Zellen und bispezifische Antikörper, die überwiegend gegen BCMA gerichtet sind und bald eine prominente Rolle in der Myelomtherapie einnehmen werden. Mit dem ersten CAR-T-Produkt bb2121 wird bei sehr schwer vorbehandelten Patienten ein Ansprechen von >80% erreicht, das jedoch zeitlich begrenzt ist (PFS 11,8 Monate).22 2021 wird die Zulassung für bb2121 ebenso erwartet wie für Cilta-Cel, das beeindruckende Phase-I/II-Daten (ORR: 97%, PFS nach 12 Monaten 77%) aufweist.23
Bispezifische Antikörper zeichnen sich gegenüber den Zellprodukten durch ihre unmittelbare Verfügbarkeit aus, sind nach dem Entwicklungsstopp der Leitsubstanz AMG420 aber noch in früher klinischer Prüfung. Aus Phase-I-Studien werden Ansprechraten von 52–80% berichtet, durch die Einführung von Immunglobulin-Domänen und die dadurch verlängerte Halbwertszeit werden ein Therapieintervall von bis zu 3 Wochen und/oder die subkutane Gabe möglich. Neurologische Nebenwirkungen scheinen nicht im Vordergrund zu stehen, zytokinvermittelte Ereignisse sind durch supportive Maßnahmen gut kontrollierbar. Es bleibt zu hoffen, dass entsprechende Studienkonzepte auch in Österreich aufgelegt werden und den Patientinnen und Patienten in Bälde zur Verfügung stehen.
Literatur:
1 Dimopoulos MA et al.: Ann Oncol 2021; 32: 309-22 2 Cavo M et al.: Lancet Haematol 2020; 7: e456-e468 3 Perrot A et al.: ASH 2020, Abstr. #143 4 Moreau P et al.: Lancet 2019; 394: 29-38 5 Kaufman J et al.: ASH 2020, Abstr. #549 6 Bachmann F et al.: Cancers (Basel) 2021; 13: 1322 7 Weisel K et al.: EHA 2020, Abstr. #S204 8 Dimopoulos MA et al.: Lancet 2019; 393: 253-64 9 Kumar SK et al.: ASH 2020, Abstr. #2276 10 Durie BG et al.: Lancet 2017; 389: 519-27 11 Dimopoulos MA et al.: Lancet Oncol 2017; 18: 1327-37 12 Dimopoulos MA et al.: Lancet 2020; 396: 186-97 13 Moreau P et al.: EHA 2020; Abstr. #LBA2603 14 Richardson PG et al.: Lancet Oncol 2019; 20: 781-94 15 Attal M et al.: Lancet Oncol 2019; 394: 2096-2107 16 Dimopoulos MA et al.: N Engl J Med 2018; 379: 1811-22 17 Dimopoulos MA et al.: ASH 2020; Abstr. #412 18 Harrison S et al.: ASH 2019; Abstr. #142 19 Dimopoulos MA et al.: ASCO 2020; Abstr. #8501 20 Chari A et al.: N Engl J Med 2019; 381: 727-38 21 Lonial S et al.: Lancet Oncol 2020; 21: 207-21 22 Munshi NC et al.: NEngl J Med 2021; 384: 705-16 23 Madduri D et al.: ASH 2020; Abstr. #177
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...