Multiples Myelom: verschwimmende Altersgrenzen
Autoren:
Univ.-Prof. Dr. Heinz Ludwig1
OA Dr. Martin Schreder1, 2
1 Wilhelminen-Krebsforschungsinstitut
c/o 1. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie und Palliativmedizin, Klinik Ottakring, Wien
2 1. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie und Palliativmedizin, Klinik Ottakring, Wien
Korrespondenz:
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Nur wenige Tage, aber viele Flugmeilen liegen zwischen den letzten Meetings von ASCO und EHA. Es ist nicht verwunderlich, dass sowohl auf amerikanischem als auch auf europäischem Boden dieselben therapeutischen Innovationen auf dem Gebiet des multiplen Myeloms präsentiert wurden. Im Folgenden sollen die wesentlichsten Ergebnisse bei jüngeren und älteren Patient:innen getrennt vorgestellt werden, wobei die bisherigen Grenzen zwischen „für eine Transplantation geeignet“ oder „nicht geeignet“ allmählich zu verschwimmen scheinen.
Keypoints
-
Erfolgreiche Phase-III-Studien mit Isatuximab-Kombinationen (GMMG-HD7, IMROZ, BENEFIT) haben den Stellenwert dieses CD38-Antikörpers in der Erstlinientherapie untermauert.
-
Belantamab-Mafodotin erlebt ein Revival aufgrund der erfolgreichen Studien DREAMM-7 und DREAMM-8 bei Patient:innen mit zumindest einer Vortherapie.
-
Neben „Homemade“-CAR-T-Zellen wird intensiv an der Optimierung von CAR-T-Zell-Produkten gearbeitet, wie z.B. schnellerer Produktionszeit, stärkerer Expansion und längerer Persistenz von CD8-positiven CAR-T-Zellen, Produkten, die an zwei Epitope binden, geringere Immunogenität aufweisen bzw. auf allogenen Spender:innen beruhen.
-
Bispezifische Antikörper haben sich aufgrund ihrer „Off the shelf“-Verfügbarkeit und ihrer beachtlichen Wirkung in der klinischen Praxis weitgehend etabliert. Erste Daten sprechen für eine hervorragende Wirksamkeit von bispezifischen Antikörpern, die an FcRH5 als Zielstruktur binden. Ihre Einführung in die Klinik würde die Behandlungsmöglichkeiten erweitern und Patient:innen mit ungenügendem Ansprechen bzw. mit Rezidiv nach Behandlung mit BCMA- bzw. GCPR5D-spezifischen Therapien eine weitere Option einräumen.
„Junge“ Patient:innen
Die Studie CASSIOPEIA (Dara-VTd vs. VTd-Induktionstherapie gefolgt von Dara-Erhaltungstherapie oder Beobachtung) hat die Überlegenheit einer CD38-Kombination mit einem Protease-Inhibitor (PI), IMID und Dexamethason unter Beweis gestellt.
Ein Update von Prof. Philippe Moreau, MD, nach einer medianen Nachbeobachtungszeit von fünf Jahren zeigte einen überwältigenden Nutzen der Daratumumab-VTd-Kombination in allen wesentlichen Zielpunkten, nämlich Gesamtansprechrate (ORR), Komplettremission (CR), negativer minimaler Resterkrankung (MRDneg), progressionsfreiem Überleben (PFS) und Gesamtüberleben (OS), wobei die Überlebensrate zum Zeitpunkt von 72 Monaten bei 86,7% in der Quadruplet-Gruppe und bei 77,7% im VTd-Arm lag (HR: 0,55; 95% CI: 0,42–073; p<0,0001).1
Die Randomisierung der Patient:innen in eine Gruppe mit Daratumumab-Erhaltungstherapie und in eine unbehandelte Kontrollgruppe ergab als weiteren wichtigen Befund einen PFS-Vorteil der erstgenannten Gruppe. Das längste PFS wurde bei Patient:innen beobachtet, die sowohl in der Induktions- als auch in der Erhaltungstherapie-Phase Daratumumab erhielten, wodurch das mediane PFS um ≈2,5 Jahre (≈7,0 vs. ≈4,5 Jahre) verlängert werden konnte. Allerdings würde heute die Kontrollgruppe der Erhaltungstherapie zumindest Lenalidomid erhalten, was aber zu Studienbeginn in Frankreich nicht als Standard zugelassen war.
Nach der Erstvorstellung der CASSIOPEIA-Studie haben mehrere Studien die überlegene Wirksamkeit von „Quadruplets“ unter Beweis gestellt und als Standard etabliert. Dazu zählen in erster Linie randomisierte Phase-III-Studien wie PERSEUS und IsKia, aber auch GMMG-HD7, sowie mehrere Phase-II-Studien wie CONCEPT, OPTIMUM/MUK5 und IFM-2018-04.
Ein Update der PERSEUS-Studie nach einem medianen Follow-up von 47,5 Monaten zeigte die beachtliche Überlegenheit der Dara-VRd-Kombination über VRd in Bezug auf PFS (PFS-Rate zum Zeitpunkt von 43 Monaten: 84,7% vs. 63,2%) sowie auf die MRDneg-Rate.2
Unter der Quadruplet-Therapie erreichten 44,2% der Patient:innen einen MRDneg-Status (10–6), während dies nur bei 31,3% der Patient:innen im Kontrollarm der Fall war. Weiters wurden beim EHA-Meeting erstmals die Ergebnisse zum sekundären Endpunkt der GMMG-HD7-Studie, nämlich der CR- und MRD-Rate nach Induktion und Transplantation, präsentiert.3
In die Studie wurden 662 Patient:innen eingebracht und auf Isatuximab-VRd oder VRd alleine randomisiert. Nach drei Zyklen einer sechswöchigen Induktionstherapie erfolgte eine Intensivierung mit einer Hochdosistherapie plus autologer Stammzelltransplantation (ASCT), wobei für Patient:innen mit Hochrisiko-Zytogenetik sowie für jene, die nicht in CR waren, eine Doppeltransplantation vorgesehen war.
Danach wurden die Patient:innen in eine Erhaltungstherapie über 36 Monate mit Isatuximab+Lenalidomid bzw. mit Lenalidomid alleine randomisiert. Primärer Endpunkt war die MRDneg-Rate nach Ende der Induktionstherapie (drei Zyklen über jeweils sechs Wochen) und der sekundäre Endpunkt waren CR und MRDneg-Rate nach Beendigung der Intensivierung. 582 Patient:innen absolvierten zumindest eine ASCT, davon 170 eine Tandem-ASCT.
Die vorgestellten Daten zeigen eine signifikant tiefere Ansprechrate mit ≥VGPR („very good partial remission“) von 82,8% vs. 68,7% und ≥CR von 43,5% vs. 34,0% für die Quadruplet-Kombination im Vergleich zu VRd alleine. Zudem erreichten signifikant mehr Patient:innen im Quadruplet-Arm einen negativen MRD-Status (Isa-VRd: 66,2% vs. RVd: 47,7%).
Im klinischen Alltag ist die Quadruplet-Therapie aus Anti-CD38-Antikörper, Proteasom-Inhibitor, Immunmodulator und Dexamethason bereits aufgrund der Daten aus den Studien CASSIOPEIA und PERSEUS in der Erstlinie bei transplantationsgeeigneten Patient:innen mit neu diagnostiziertem multiplem Myelom etabliert (TE NDMM). Neben Daratumumab stehen nunmehr auch Phase-III-Daten für den Einsatz von Isatuximab in der Induktion bei TE-NDMM-Patient:innen zur Verfügung.
Man darf daher vermutlich mit einer baldigen Zulassung von Isatuximab in der Erstlinie sowohl bei transplantationsfähigen als auch bei konventionell behandelten Patient:innen rechnen.
„Ältere“ Patient:innen
Sowohl beim ASCO- als auch beim EHA-Meeting wurde als wichtigste Neuerung für ältere Patient:innen die IMROZ-Studie von Facon et al. vorgestellt.4
In diese Studie wurden 444 Patient:innen im Alter von 65–80 Jahren (median: 72 Jahre) eingeschlossen und in einem Verhältnis von 3:2 in einen Therapiearm mit Isatuximab-VRd bzw. VRd randomisiert. Als Induktionstherapie wurden vier sechswöchige Zyklen VRD+/–Isatuximab verabreicht. Danach wurde die Behandlung mit vierwöchigen Zyklen, jedoch ohne Bortezomib, bis zum Progress bzw. zu Intoleranz weiter fortgeführt. Als primärer Endpunkt wurde PFS gewählt.
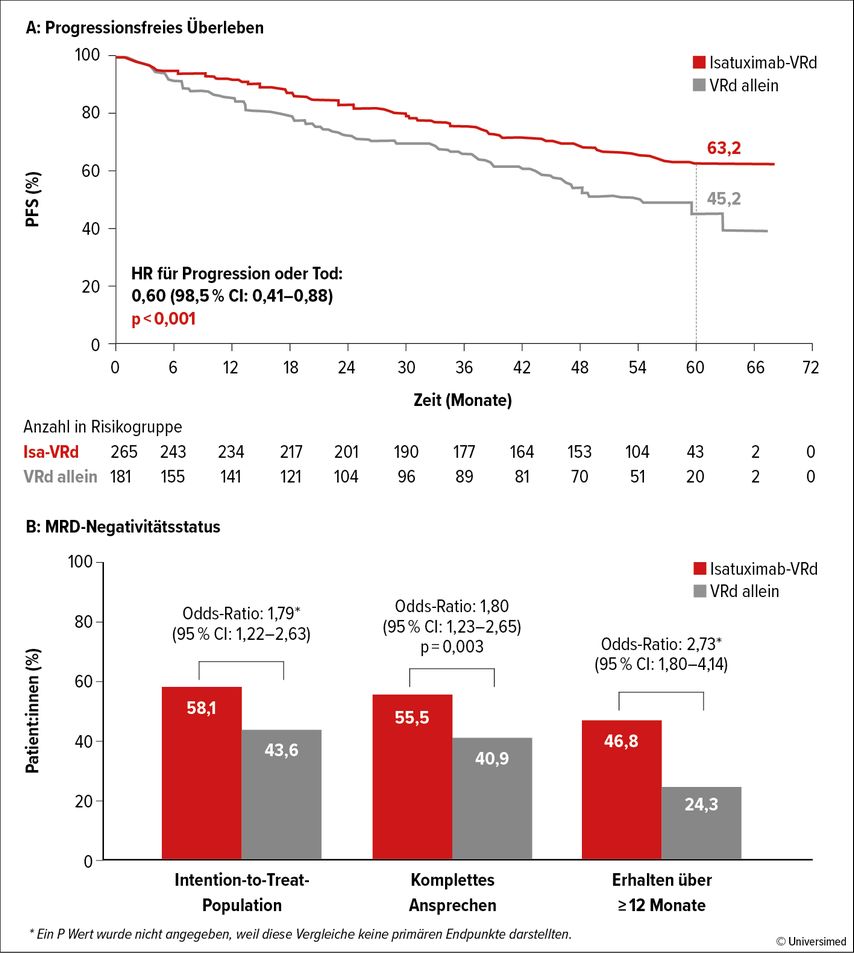
Nach einer medianen Nachbeobachtung von fünf Jahren fand sich eine signifikante Verlängerung des PFS im Quadruplet-Arm (medianes PFS nicht erreicht vs. 54,3 Monate im Kontrollarm; HR: 0,596; 98,5% CI: 0,406–0,876; p<0,001; Abb. 1A). Diese Werte entsprechen einer Risikoreduktion von 40% für Progression oder Mortalität.
In beiden Therapiegruppen wurden hohe Gesamtansprechraten erreicht (Isa-VRd: 91,3%; VRd: 92,3%). Die MRDneg-Rate sowie die Rate an anhaltender MRDneg (≥12 Monate) waren in der Quadruplet-Gruppe deutlich höher (58,1% vs. 43,6% bzw. 46,8% vs. 24,3%; Abb. 1B).
Abb. 1: A: Isatuximab-VRd führt im Vergleich zu VRd zu einer signifikanten Verlängerung des PFS bei älteren Patient:innen ohne Transplantation (IMROZ-Studie; modifiziert nach Facon T et al).4 B: Isatuximab-VRd führt zu einer signifikant höheren Rate an MRDneg-Befunden in der ITT-Gruppe und bei jenen mit kompletter Remission sowie zu einer höheren Rate an andauernder (≥12 Monate) MRDneg (modifiziert nach Facon T et al.)4
Interessant in diesem Zusammenhang ist die deutlich kürzere Zeit bis zum Erreichen eines MRDneg-Befundes in der Kombinationstherapiegruppe im Vergleich zu VRd alleine (median 14,7 vs. 32,7 Monate). Obwohl die Nachbeobachtungszeit für den Vergleich des Gesamtüberlebens noch zu kurz ist, wurde zum Zeitpunkt von fünf Jahren eine numerisch höhere Überlebensrate für die Quadruplet-Therapiegruppe (72,3% vs. 66,3%; HR: 0,776; 95% CI: 0,047–1,48) beobachtet, was einer Risikoreduktion für Mortalität von 22,4% entspricht.
Bemerkenswert ist die gute Toleranz der Immunchemotherapie, was sich unter anderem in der signifikant längeren Dauer der Quadruplet-Behandlung (53,2 vs. 31,3 Monate) und dem fast identischen Verlauf der Lebensqualität beider Behandlungsgruppen zeigte. Neuropathien von Grad 3/4 wurden bei 7,2% (Isa-VRd) bzw. 6,1% (VRd) der Patient:innen beobachtet, obwohl die Gabe von Bortezomib nach der Induktionstherapie beendet wurde.
Insgesamt war die Rate an AE inklusive AE von Grad ≥3 in beiden Studienarmen vergleichbar. Die beachtlichen Ergebnisse übertreffen bei Weitem die Resultate der SWOG-Studie (VRd vs. Rd, medianes PFS: 41 vs. 29 Monate; Log-Rank p=0,003), aber auch jene der MAIA-Studie (medianes PFS: 61,9 vs. 34,4 Monate; HR: 0,55; 95% CI: 0,45–0,67; p<0,0001).
Die erste von der IFM-Gruppe durchgeführte akademische Studie für ältere Patient:innen (65–80 Jahre, medianes Alter 73 Jahre) ist die Studie BENEFIT (IFM 2020–05), die die Bedeutung von Bortezomib in Kombination mit Isatuximab-Rd mit Isa-Rd vergleicht.5 Bortezomib wurde an Tag 1, 8 und 15 eines vierwöchigen Zyklus im Zuge der Induktionstherapie (zwölf Zyklen) und danach nur mehr an den Tagen 1 und 15 für weitere sechs Zyklen verabreicht. Als Erhaltungstherapie erhielten beide Gruppen Isatuximab 1x/Monat und Lenalidomid an den Tagen 1–21.
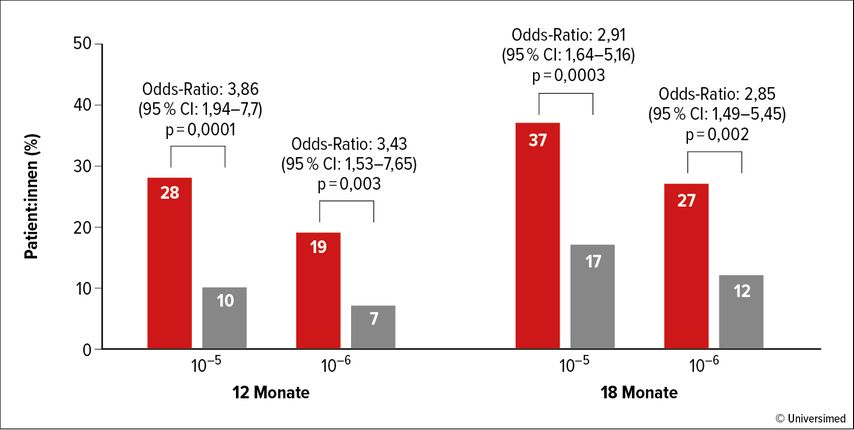
Die MRDneg-Rate lag nach acht Monaten bei 36% bzw. 17% in der Isa-VRd- bzw. in der Isa-Rd-Gruppe, womit der primäre Endpunkt der Studie erreicht wurde (Abb. 2). Die Gesamtansprechrate lag bei 83% bzw. 78%, die Zeit bis zum Erreichen einer ≥VGPR war in der Isa-VRd-Gruppe mit 2,1 Monaten deutlich kürzer als in der Kontrollgruppe (3,7 Monate). Nach einem medianen Follow-up von 23,5 Monaten lässt sich kein Unterschied im PFS bzw. OS erkennen.
Abb. 2: MRD-Rate unter Isa-VRd bzw. Isa-Rd bei für eine Transplantation nicht geeigneten Patient:innen 12 bzw. 18 Monate nach Behandlungsbeginn (modifiziert nach Leleu X et al.)5
Die Nebenwirkungen waren in beiden Therapiegruppen vergleichbar mit Ausnahme einer höheren Rate von Grad-2-Neuropathien im Quadruplet-Therapiearm (27% vs. 10%). Grad-3-Neuropathien wurden bei vier Patient:innen in der experimentellen und bei einem Patienten in der Vergleichsgruppe festgestellt. Im „Forest Plot“ lässt sich eine hohe Wirksamkeit bei Patient:innen mit zytogenetischem Hochrisiko-Profil erkennen, was den Einsatz der Quadruplet-Kombination gerade auch bei älteren Patient:innen nahelegt.
Studien bei relapsierter/resistenter Myelomerkrankung
Neben den zahlreichen Berichten über die Ergebnisse mit CAR-T-Zell-Therapien und bispezifischen Antikörpern wurden bei den ASCO- und EHA-Jahrestreffen die Studien DREAMM-7 und DREAMM-8 erstmals der Öffentlichkeit vorgestellt. Diese Studien sind aus mehreren Gründen von hohem Interesse, da Belantamab-Mafodotin (Belamaf) derzeit eine Alleinstellung als Anti-BCMA-Antikörper-Toxin(Monomethylauristatin)-Konjugat einnimmt. Als Monotherapie führt es bei umfangreich vorbehandelten Patient:innen zu einer Ansprechrate von etwa 35%, kann aber mit einer therapielimitierenden Augentoxizität vergesellschaftet sein.
Leider wurde Belamaf aufgrund der Ergebnisse der DREAMM-3-Studie sowohl von der FDA als auch von der EMA vom Markt genommen. Die Studie zeigte zwar einen numerischen Vorteil bzgl. PFS für Belamaf gegenüber Pomalidomid/Dexamethason (11,2 vs. 7,0 Monate), dieser Unterschied war aber statistisch nicht signifikant. Viele Myelomexpert:innen konnten diesen Schritt nicht nachvollziehen, da Belamaf bei einem Teil der Patient:innen zu lang anhaltenden Remissionen führen kann. Nun wurden von Mateos et al. erstmals die Ergebnisse der DREAMM-7-Studie vorgestellt.6
494 Patient:innen mit RRMM und ≥1 Vortherapie wurden in eine Gruppe mit Belamaf-Velcade-Dexamethason (BVd) bzw. in einen Arm mit Dara-Vd (DVd) randomisiert. Etwa 50% der Patient:innen waren mit Lenalidomid vorbehandelt und ca. 33% wurden als Lenalidomid-refraktär eingestuft. Belamaf (2,5mg/kg) wurde alle drei Wochen und Bortezomib 2x/Woche bis Zyklus 8 verabreicht.
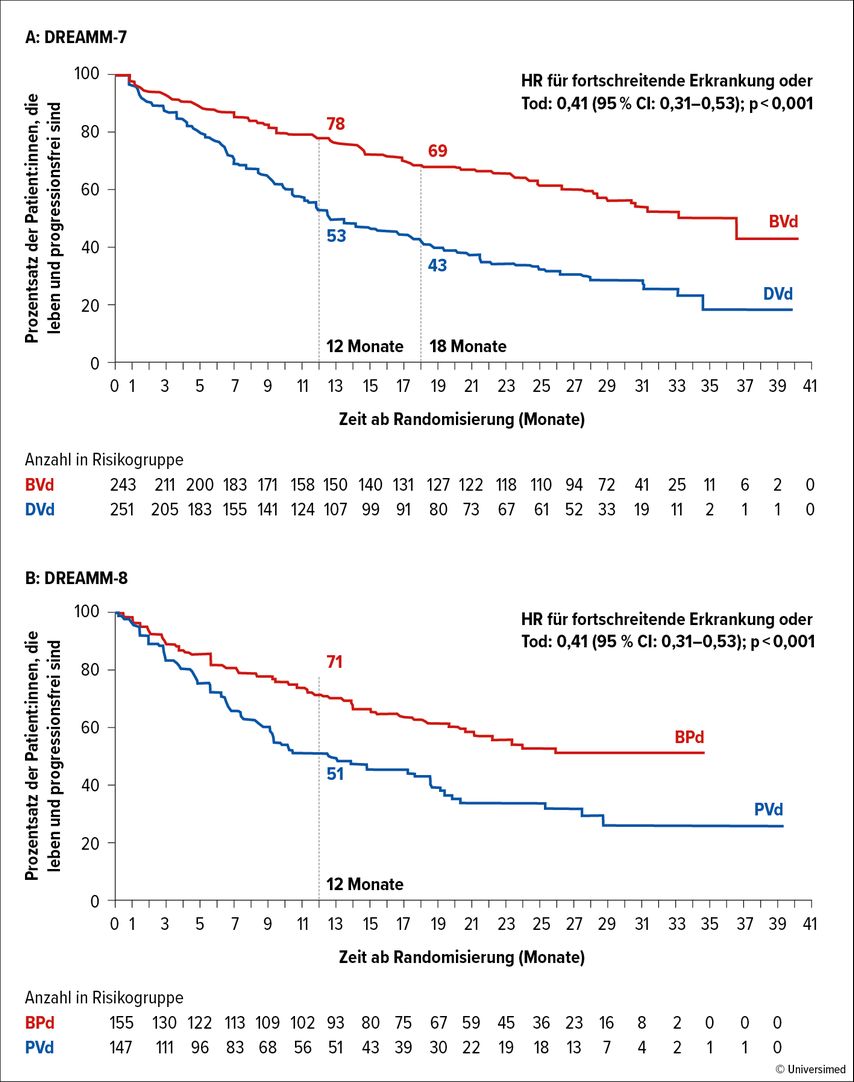
Nach einer medianen Nachbeobachtungszeit von 28,2 Monaten zeigten sich in der BVd-Gruppe eine höhere Gesamtansprechrate (82,7%) verglichen mit der DVd-Gruppe (71,3%), ein tieferes Ansprechen (sCR: 14,0% vs. 5,2%) sowie ein signifikant längeres PFS (medianes PFS: 36,6 vs. 13,4 Monate; HR: 0,41; 95% CI: 0,31–0,53; p<0,001; Abb. 3A). Auch bezüglich Gesamtüberleben wurde bereits ein Vorteil für die BVd-Kombination beobachtet (HR: 0,57; 95% CI: 0,40–0,80; p<0,0005).
Therapiebedingte Nebenwirkungen von Grad 3/4 wurden bei 90% der BVd- und bei 67% der DVd-Patient:innen beobachtet und SAE bei 50% bzw. bei 37% der Patient:innen beschrieben. Augentoxizität wurde erwartungsgemäß viel häufiger in der Belamaf-Gruppe verzeichnet (79% vs. 29%). Therapiebedingte Nebenwirkungen, die zu einer Beendigung der Studie führten, fanden sich bei 26% der BVd- und bei 15% der DVd-Patient:innen
Eine ähnliche Erfolgsgeschichte stellt die DREAMM-8-Studie dar, die in der „Late-Breaking Session“ des EHA-Kongresses von Prof. Meletios Dimopoulos, MD, vorgestellt wurde.7 In diese Studie wurden 302 Patient:innen mit Lenalidomid-refraktärem MM und ≥1 Vortherapie einbezogen und in einen Behandlungsarm mit Belamaf-Pd (BPd) bzw. in eine Gruppe mit PVd(Pomalidomid-Velcade-Dexamethason) randomisiert.
25% der Patient:innen im BPd-Arm und 29% der Studienteilnehmer im PVd-Arm hatten davor eine Anti-CD38-Therapie erhalten. Nach einer medianen Nachbeobachtungszeit von 21,8 Monaten war der Median des PFS in der BPd-Gruppe noch nicht erreicht, während dieser in der PVd-Gruppe bei 12,7 Monaten lag (HR: 0,52; 95% CI: 0,37–0,73; p<0,001; Abb. 3B). Die PFS-Rate zum Zeitpunkt von zwölf Monaten lag bei 71% in der BPd- und bei 51% in der PVd-Gruppe; die Ansprechraten lagen bei 77% und 72%, während die Rate an≥CR bei 40% bzw. 16% lag. Bezüglich Gesamtüberleben fand sich ein positiver Trend für BPd (HR: 0,77; 95% CI: 0,53–1,14).
Abb. 3: A: Belantamab-Velcade-Dexamethason (BVd) führte in der Studie DREAMM-7 zu einer signifikanten PFS-Verlängerung im Vergleich zu Daratumumab-Velcade-Dexamethason (DVd) bei Patient:innen mit RRMM und zumindest einer Vortherapie (modifiziert nach Mateos MV et al).6 B: Belantamab-Pomalidomid-Dexamethason (BPd) führte in der Studie DREAMM-8 zu einer signifikanten PFS-Verlängerung im Vergleich zu Pomalidomid-Velcade-Dexamethason (PVd) bei Lenalidomid-refraktären Patient:innen mit RRMM und zumindest einer Vortherapie (modifiziert nach Dimopoulos M et al.)7
AE von Grad 3/4 wurden bei je 91% und 73% der Patient:innen verzeichnet. Augentoxizität wurde bei 89% beobachtet, davon Grad 3/4 bei 43% der BPd- und bei 30% bzw. 2% der PVd-Gruppe. Im BPd-Arm trat die okuläre Toxizität vorwiegend in den ersten drei Monaten auf, wobei vor allem Visusverschlechterung und trockene Augen berichtet wurden. Durch Dosisreduktion und/oder Intervallanpassungen konnten diese okulären Nebenwirkungen gut beherrscht und die Behandlungen meist fortgesetzt werden. Unter BPd-Therapie wurden mehr Infektionen als unter PVd beobachtet (82% vs. 60%). 15% der Patient:innen in der BPd-Gruppe und 12% der PVd-Patient:innen beendeten die Studie wegen AE; tödliche AE fanden sich in beiden Therapiearmen in einer Frequenz von 11%.
Aufgrund dieser überzeugenden Ergebnisse der Belamaf-basierten Kombinationen BVd (vs. DVd) und BPd (vs. PVd), die einen signifikanten PFS-Vorteil aufzeigten, ist mit einer Zulassung dieser Therapieoptionen bei Patient:innen mit zumindest einer Vortherapie in absehbarer Zeit zu rechnen.
Weitere bemerkenswerte Berichte
Vielerorts wird versucht, die Wirksamkeit von CAR-T-Zellen durch Optimierung des Antigenrezeptors zu steigern, wie z.B. in Konstrukten mit dualer Antigenspezifität. Die Antigenbindungsdomänen stammen dabei üblicherweise von nichthumanen Antikörpern und werden vom Immunsystem der Patient:innen potenziell als fremd angesehen, was zur Verkürzung der Halbwertszeit und Wirksamkeit führen kann.
Mit Anitocabtagen autoleucel wurde nun ein CAR-T-Zell-Konstrukt entwickelt, das aus synthetischen D-Domain-Proteinen besteht, die aufgrund ihrer geringen Größe (≈8kDa) Vorteile wie hohe Membranexpression und geringe Immunogenität aufweisen. Frigault et al. haben mit diesen gegen BCMA gerichteten CAR-T-Zellen bei insgesamt 32 Patient:innen mit RRMM und mindestens drei Vortherapien eine Ansprechrate von 100% erzielt, wobei 92,9% einen MRD-negativen Status (10–5) erreichten.8 Gutes Ansprechen wurde auch bei Patient:innen mit extramedullärer Erkrankung sowie bei jenen mit zytogenetischem Hochrisiko-MM beobachtet. Das progressionsfreie Überleben nach zwei Jahren lag bei 56%. Die Therapie wurde hervorragend toleriert, sodass die weitere klinische Entwicklung mit Spannung verfolgt werden sollte.
Roeloffzen et al. berichteten über eine Subgruppe der in die CARTITUDE-2-Studie eingebrachten Patient:innen, nämlich über 17 Patient:innen (medianes Alter: 54 Jahre), die auf eine adäquate Induktionstherapie inklusive ASCT ungenügend angesprochen haben (<CR) und daher einer Behandlung mit Cilta-cel gefolgt von einer Lenalidomid-Erhaltungstherapie unterzogen wurden.9
Durch die CAR-T-Zell-Therapie wurde eine Ansprechrate von 94% erreicht (CR: 5,9%; sCR: 88,2%); ein MRDneg-Status (10–5) konnte bei 12 von 15 (80%) getesteten Patient:innen erzielt werden. Zum Zeitpunkt von 18 Monaten war ein Patient verstorben, die PFS- und OS-Raten lagen bei 93,8%. Aus der Präsentation ging nicht hervor, ob die Festlegung des ISS-Stadiums nach der Transplantation erfolgte, da alle 17 Patient:innen mit ISS-Stadium I angeführt wurden.
Diese günstige Ausgangslage dürfte nicht nur die guten Ergebnisse, sondern auch die geringe passagere Neurotoxizität (ICANS 1/17, andere Neurotoxizität 6/17) erklären. Die mittlere maximale CAR-T-Zell-Expansion lag bei 2129 Zellen/μl, was möglicherweise auf die geringe Tumorlast zurückzuführen ist.
Unter den zahlreichen Präsentationen zu bispezifischen Antikörpern (BsAK) sollen hier die Ergebnisse mit Cevostamab vorgestellt werden, einem BsAK, der an FcRH5 bindet. FcRH5 wird fast ausschließlich auf Zellen der B-Zell-Reihe exprimiert, mit höchster Dichte auf Plasmazellen, und ist daher ein attraktives Therapietarget.
Kumar et al. zeigten präliminäre Ergebnisse zu 21 Patient:innen, die Cevostamab in Step-up-Dosis (0,3mg, 3,3mg und schließlich 160mg) erhalten haben, wobei die finale Dosis alle drei Wochen per Infusion bis zu Progression/Therapieabbruch appliziert wurde.10 Die mediane Anzahl an Vortherapien betrug sechs, elf Patient:innen erhielten zuvor eine CAR-T-Zell-Therapie und zehn wurden mit einem Antikörper-Wirkstoff-Konjugat (ADC) vorbehandelt. Die Gesamtansprechrate lag bei 67% (73% bei CAR-T-Zell-Therapie und 60% bei ADC-Vorbehandlung).
Ein Zytokinfreisetzungssyndrom (Grad 1/2) wurde bei 71% der Patient:innen fast ausschließlich am Beginn der Behandlung beobachtet, wobei die mediane Zeit bis zum Auftreten mit acht Stunden und die mediane Dauer mit einem Tag angegeben wurden. Andere eventuell relevante Nebenwirkungen wurden nicht berichtet.
Literatur:
1 Moreau P et al.: Daratumumab (dara) + bortezomib/thalidomide/dexamethasone (d-vtd) followed by dara maintenance in transplant-eligible (te) newly diagnosed multiple myeloma (ndmm): >6-year update of CASSIOPEIA. EHA 2024; Abstr. #S204 2 Sonneveld P et al.: Daratumumab + bortezomib/lenalidomide/dexamethasone in transplant-eligible patients with newly diagnosed multiple myeloma: analysis of minimal residual disease in the PERSEUS trial. EHA 2024; Abstr. #S201 3 Raab M et al.: Isatuximab, lenalidomide, bortezomib and dexamethasone for newly-diagnosed, transplant-eligible multiple myeloma: post transplantation interim analysis of the randomized phase IIIGMMG-HD7 trial. EHA 2024; Abstr. #S202 4 Facon T et al.: Phase 3 study results of isatuximab, bortezomib, lenalidomide, and dexamethasone (Isa-VRd) versus VRd for transplant-ineligible patients with newly diagnosed multiple myeloma (IMROZ). ASCO 2024; Abstr. #7500 5 Leleu X et al.: Randomized phase 3 study of isatuximab (isa) plus lenalidomide and dexamethasone (rd) with bortezomib (v) versus isard in patients with newly diagnosed transplant ineligible multiple myeloma (ndmm ti). EHA 2024; Abstr. #S203 6 Mateos MV et al.: Results from DREAMM-7 a randomized phase 3 study of belantamab mafodotin + bortezomib, and dexamethasone vs daratumumab + bortezomib, and dexamethasone in relapsed/refractory multiple myeloma. EHA 2024; Abstr. #S214 7 Dimopoulos M et al.: Results from the randomized phase 3 DREAMM-8 study of belantamab mafodotin plus pomalidomide and dexamethasone vs pomalidomide plus bortezomib and dexamethasone in relapsed/refractory multiple myeloma. Abstr. #LB3440 8 Frigault M et al.: Phase 1 study of anitocabtagene autoleucel for the treatment of patients with relapsed and/or refractory multiple myeloma: results from at least 1-year follow-up in all patients. EHA 2024; Abstr. #S207 9 Roeloffzen W et al.: Ciltacabtagene autoleucel ± lenalidomide maintenance in newly diagnosed multiple myeloma with suboptimal response to frontline autologous stem cell transplant: CARTITUDE-2 cohort D. EHA 2024; Abstr. #S205 10 Kumar S et al.: Cevostamab in patients with rrmm who are triple-class refractory and have received a prior BCMA-targeted ADC or CAR t-cell: initial results from the phase I/II CAMMA 2 study. EHA 2024; Abstr. #210
Die Ergebnisse der DREAMM-Studien wurden zeitgleich mit den oralen Präsentationen im New England Journal of Medicine veröffentlicht:
– DREAMM-7: Hungria V et al.: Belantamab mafodotin, bortezomib, and dexamethasone for multiple myeloma. NEngl J Med 2024; online ahead of print
– DREAMM-8: Dimopoulos MA et al.: Belantamab mafodotin, pomalidomide, and dexamethasone in multiple myeloma. N Engl J Med 2024; online ahead of print
Ebenso wurde die IMROZ-Studie zeitgleich zur öffentlichen Vorstellung im New England Journal of Medicine veröffentlicht:
– Facon T et al.: Isatuximab, bortezomib, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med 2024; online ahead of print
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...