Was war wichtig beim multiplen Myelom?
Autoren:
Univ.-Prof. Dr. Heinz Ludwig1
OA Dr. Martin Schreder2
Priv.-Doz. Dr. Niklas Zojer, PhD2
1 Wilhelminen-Krebsforschungsinstitut
c/o 1. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie und Palliativmedizin, Klinik Ottakring, Wien
2 1. Medizinische Abteilung
Zentrum für Onkologie, Hämatologie und Palliativmedizin, Klinik Ottakring, Wien
Korrespondenz:
Das sonnige San Diego bietet eine ideale Plattform für die Präsentation neuester wissenschaftlicher Ergebnisse, dies betrifft natürlich auch das multiple Myelom, wobei aufgrund der Vielzahl an Präsentationen hier nur eine subjektiv gefärbte Auswahl von Präsentationen vorgestellt werden kann.
Keypoints
-
Bei zwölf Patient:innen mit Hochrisiko-SMM wurde mit Teclistamab eine MRDneg-Rate von 100% erzielt; eine Studie in dieser Indikation mit CAR-T-Zellen ist geplant.
-
Die PERSEUS-Studie belegt die Überlegenheit einer CD38-Antikörper-VRd-Kombination gegenüber VRd in der Erstlinientherapie jüngerer Patient:innen mit MM; eine Zulassung der Viererkombination ist zu erwarten.
-
Bei „fitten“ älteren Patient:innen (median 72 Jahre) war eine Viererkombination mit 18 Zyklen Dara-KRd Therapieprotokollen mit vier Zyklen Dara-KRd überlegen.
-
Das CELMoD („cereblon ligase E3 degrader“) Mezigdomid zeigt hohe Wirksamkeit bei vorbehandelten, Lenalidomid-refraktären Patient:innen.
-
Mit Talquetamab (Target GPRC5D) behandelte Patient:innen können nach Rezidiv erfolgreich mit BCMA-gerichteter Therapie behandelt werden.
-
Ide-cel- und Cilta-cel-CAR-T-Zell-Therapien sind konventioneller Rezidivbehandlung bzgl. Ansprechrate und PFS überlegen. Bei akzeptablen behandlungsbedingten Nebenwirkungen ist zudem die gesundheitsbezogene Lebensqualität besser.
„Smoldering“ multiples Myelom
Die bisher vorliegenden Algorithmen für die Voraussage einer möglichen Transformation eines „smoldering“ multiplen Myeloms (SMM) in ein multiples Myelom (MM) sind nach wie vor unbefriedigend.
Das von der Mayo Clinic entwickelte und von María-Victoria Mateos in einer größeren Patient:innenpopulation bestätigte 20/20/20-Modell (BMPC >20%, M-Protein >20g/l, FLC-Ratio >20) wird in den meisten Studien als Grundlage für die Selektion von Hochrisiko-SMM-Patient:innen herangezogen, wobei letztgenannte Gruppe zum Zeitpunkt zwei Jahre ein Risiko von 43% für eine Transformation in ein aktives MM aufweist. Durch das Hinzufügen bestimmter zusätzlicher Parameter wie Zytogenetik bzw. sogenannter „Evolving“-Faktoren (Reduktion des Hämoglobins und/oder Anstieg des Paraproteins) kann die prognostische Voraussagekraft verbessert werden.1 Unter diesen Gegebenheiten ist es nicht überraschend, dass in einer aktuellen Umfrage unter amerikanischen Hämatolog:innen sich nur 8% für einen sofortigen Behandlungsbeginn, jedoch 92% dagegen ausgesprochen haben.2
In der Studienlandschaft sieht es allerdings völlig anders aus. Hier kann man mit aggressiven Therapiekonzepten das Augenmerk der Kollegenschaft auf sich ziehen.
Nadeem Omar hat den bispezifischen Antikörper (BsAk) Teclistamab bei zwölf Patient:innen mit Hochrisiko-SMM, die einen „Evolving“-Phänotyp aufwiesen, eingesetzt. Dabei waren im Behandlungsplan insgesamt 24 Zyklen vorgesehen. Zum Zeitpunkt der Präsentation wurden eine Ansprechrate von 100%, eine Rate an Komplettremissionen (CR) von 83% und eine Rate an negativer minimaler Resterkrankung (MRDneg) von 100% beobachtet. Die Behandlung war mit den für BsAk bekannten Nebenwirkungen wie Cytokin-Release-Syndrom (CRS) bei 75% der Patient:innen verbunden. Diese wurden allerdings nur als Grad1/2 eingestuft.3
Einen Schritt weiter geht Irene Ghobrial mit einer Studie, in der sie CAR-T-Zellen bei dieser Patient:innengruppe einsetzen möchte (NCT05767359). Leider handelt es sich bei fast allen klinischen Studien zum SMM nur um Phase-II-Studien ohne unbehandelte Kontrollgruppe. Dies ermöglicht keine Aussage bezüglich eines potenziellen Überlebensgewinns.
Erstlinientherapie bei Transplantations-geeigneten Patient:innen
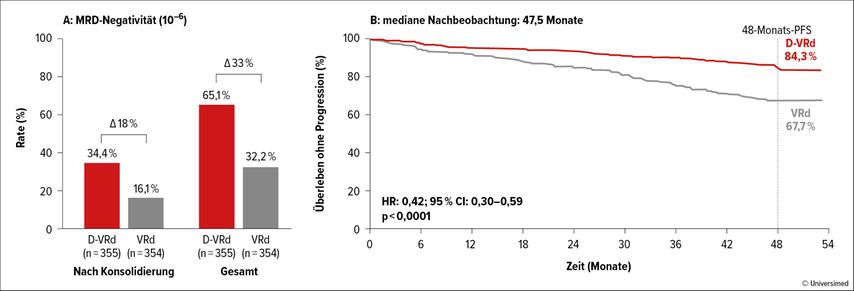
Im Vordergrund des Interesses stand die PERSEUS-Studie, die auch in der „Late breaking“-Sitzung vorgestellt wurde. Pieter Sonneveld und Kolleg:innen haben Daratumumab-VRd (D-VRd) mit VRd bei insgesamt 709 Patient:innen verglichen. Initial wurden vier Zyklen Induktionstherapie, gefolgt von einer autologen Stammzelltransplantation (ASCT) und zwei Zyklen Erhaltungstherapie mit denselben Therapieprotokollen wie bei der Induktion verabreicht. Danach erhielt die D-VRd-Gruppe eine Erhaltungstherapie mit Dara-Revlimid über zumindest sieben Zyklen, während für die Kontrollgruppe eine Erhaltungsbehandlung mit Revlimid vorgesehen war. Bei Patient:innen des experimentellen Arms, die eine „anhaltende“ MRD-Negativität von mehr als zwölf Monaten erreichten, wurde die Gabe von Daratumumab beendet und anschließend nur mehr Revlimid als Erhaltungstherapie verabreicht. MRDpos-Patient:innen wurden mit Dara-Revlimid weiterbehandelt. In die Studie wurden außergewöhnlich viele Patient:innen mit günstiger Prognose einbezogen: 52,4% bzw. 50,4% befanden sich im ISS-Stadium I und 14,7% bzw. 18,5% entsprachen den Kriterien eines biochemisch definierten MM, also einer Vorstufe des CRAB-positiven MM. Bei diesem nicht unbedingt die klinische Realität widerspiegelnden Kollektiv wurde erwartungsgemäß eine sehr hohe CR-Rate erreicht (D-VRd: 87,9% vs. VRd: 70,1%). Ein MRDneg-Status (10–6) wurde bei 65,1% respektive bei 34,4% beobachtet (Abb. 1A). Bemerkenswert ist, dass 64% der Patient:innen mit Daratumumab-Revlimid-Erhaltungstherapie Daratumumab nach zwei Jahren beenden konnten, da sie anhaltend (>12 Monate) MRDneg waren.4
Nach einer medianen Nachbeobachtung von 45,5 Monaten lag die PFS-Rate zum Zeitpunkt vier Jahre bei 84,3% in der D-VRd- und bei 67,7% in der VRd-Gruppe (HR: 0,42; p<0,0001). Damit wurde der primäre Endpunkt der Studie, eine signifikant höhere PFS-Rate, erreicht (Abb. 1B).
Abb.1: PERSUS-Studie: A: MRDneg-Rate nach Konsolidierung sowie höchste MRDneg-Rate während der Studie. B: PFS in der Dara-VRd- und VRd-Gruppe (modifiziert nach Sonneveld P et al.)4
Alle Subgruppen der eingeschlossenen Patient:innen profitierten von der Antikörperkombination mit Ausnahme der 220 Patient:innen, die 65 Jahre oder älter waren. Letztgenannte Ergebnisse sind überraschend, da die Kombination eines CD38-Antikörpers mit VMP oder Rd in früheren Studien bei älteren Menschen einen Überlebensvorteil aufzeigen konnte.
Die Analyse des Gesamtüberlebens ergab keinen Unterschied nach der immerhin mehr als vier Jahre dauernden Nachbeobachtungszeit. Auch zeigte sich kein relevanter Unterschied bezüglich der Nebenwirkungen in beiden Behandlungsgruppen.
Ein ähnliches Therapiekonzept wurde in der ISKIA-Studie (EMN 24) verfolgt. Hier wurden 302 Patient:innen mit einem Alterslimit von <70 Jahren in eine Gruppe mit Isatuximab-KRd oder mit KRd randomisiert. Nach vier Zyklen Induktion wurde eine ASCT vorgenommen und die Behandlung mit vier Zyklen Konsolidierung fortgeführt. Danach folgte eine sogenannte leichte Konsolidierung mit zwölf Zyklen reduzierter Dosis von Isa-KRd bzw. KRd. Als primäres Ziel der Studie wurde die MRD-Negativität nach der Beendigung der ersten Konsolidierungszyklen gewählt.
Erwartungsgemäß wurde mit der Antikörperkombination ein höherer MRDneg-Status erzielt (67% vs. KRd 48%), sodass die Studie ihr primäres Ziel erreicht hat. Durch die Kombination von KRd mit einem CD38-Antikörper wurde die Nebenwirkungsrate nicht wesentlich beeinflusst. Ausnahme waren die infusionsbedingten Reaktionen, die bei 24% der Patient:innen unter Isa-KRd beobachtet wurden (20% Grad 1/2, 4% Grad ≥3). Eine weitere Aufschließung der MRD-Rate bei Patient:innen mit unterschiedlichem zytogenetischem Risiko ergab eine erstaunlich hohe Wirksamkeit von 77% der Isa-KRd-Kombination auch bei Patient:innen mit ≥2 HRCA (Hochrisiko-zytogenetische Aberrationen).Patient:innen derselben Risikoklasse wiesen unter KRd nur eine MRD-Rate von 27% auf. Ein Forest Plot bestätigte die hohe Wirksamkeit der Isa-KRd-Kombination bei Patienten der Hochrisikogruppe mit ≥2 HRCA.5
Die Studie IFM 208-04 wurde speziell für Patient:innen mit Hochrisiko-Zytogenetik (del17p, t[4;14], t[14;16], zumindest eine HRCA) konzipiert. Bemerkenswert ist, dass von den 50 eingeschlossenen Patient:innen 30 ≥2 HRCA aufwiesen. Entsprechend der Hochrisikokonstellation der Betroffenen wurden zwei Stammzelltransplantationen vorgenommen: die erste nach sechs Zyklen Dara-KRd-Induktion und die zweite nach Konsolidierung mit vier Zyklen Dara-KRd. Anschließend folgte eine Erhaltungstherapie mit Daratumumab und Lenalidomid über zwei Jahre. Nach der zweiten Transplantation lag die Ansprechrate bei 100% und die MRDneg-Rate bei 94%. Zum Zeitpunkt 30 Monate nach Therapiebeginn lagen PFS- und OS-Rate bei 80% bzw. 91%. Insgesamt sind dies hervorragende Ergebnisse bei einer Hochrisiko-Population. Allerdings muss eine längere Nachbeobachtungszeit abgewartet werden, da diese Patient:innen üblicherweise wieder relativ rasch rezidivieren.6
Erstlinientherapie bei älteren nichttransplantationsgeeigneten Patient:innen
María-Victoria Mateos präsentierte die Daten für die GEM-2017FIT-Studie, in die 462 Patient:innen im Alter von 65 bis 80 Jahren (median 72 Jahre) eingeschlossen wurden. Das Ziel der Studie lag in der Erhöhung der MRDneg-Rate um 20% im Vergleich zu der in einer früheren Studie mit je neun Zyklen VMP und Rd beobachteten MRDneg-Rate von 20% bei einer Sensitivität von 10–5. In der vorliegenden Studie wurde das Therapieprotokoll (9 Zyklen VMP, gefolgt von 9 Zyklen Rd) nun um vier Zyklen Dara-Rd erweitert und mit zwei weiteren Therapiegruppen verglichen, ein Therapiearm mit 18 Zyklen KRd gefolgt von vier Zyklen Dara-Rd und eine weitere Therapiegruppe, für die 18 Zyklen Dara-KRd vorgesehen waren. Danach wurden Patient:innen abhängig vom MRD-Status entweder mit Daratumumab und Lenalidomid kontinuierlich weiterbehandelt oder einer Observationsgruppe zugeordnet. Die Ergebnisse zeigen einen schrittweisen Anstieg der MRDneg-Rate in Abhängigkeit vom Therapieprotokoll. Patient:innen mit VMP-Rd erreichten eine MRDneg-Rate (10–5) von 33%. Bei der zweiten Gruppe (KRd gefolgt von Dara-KRd) konnte eine MRDneg-Rate von 75% und bei der dritten Gruppe (Dara-KRd) von 84% erreicht werden. Das PFS nach 30 Monaten zeigte keinen Unterschied zwischen den KRd-Gruppen (83% unter KRd, 79% unter Dara-KRd), war aber unter VMP-Rd mit 73% signifikant niedriger (p=0,01).7
Therapieergebnisse bei relapsierten bzw. refraktären Patient:innen
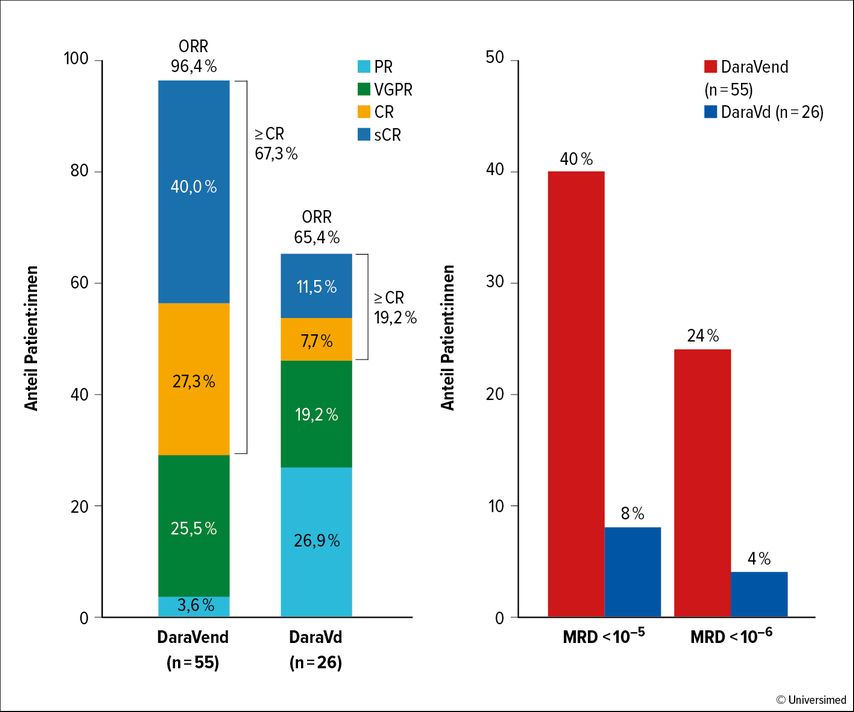
Abb. 2: Ansprechraten und MRDneg-Raten unter DaraVend bzw. unter DaraVd (modifiziert nach Bahlis N et al.)8
Die Inhibition des Anti-Apoptose-Proteins Bcl-2, das bei t(11;14)-Translokation verstärkt exprimiert ist, stellt eine interessante zielgerichtete Behandlungsoption dar. Die erste randomisierte Studie mit Venetoclax-Dexamethason (BOSTON-Studie) zeigte unter Bcl-2-Inhibition zwar höhere Remissionsraten, aber keinen PFS- oder OS-Vorteil. Nizar Bahlis hat nun die Kombination von Dara-Venetoclax-Dexamethason (DaraVend) mit DaraVd bei Patient:innen mit t(11;14) verglichen. Es wurde eine Ansprechrate von 96,4% vs. 65,4% erreicht (p<0,0001) sowie eine MRDneg-Rate (10–5) von 40% vs. 8% (Abb. 2). Mit DaraVend konnte das PFS um mehr als das Doppelte im Vergleich zu DaraVd verlängert werden (46,3 vs. 15,5 Monate).8
Leider wurde in der Canova-Studie, die zur Registrierung von Venetoclax führen sollte, das primäre Studienziel verfehlt: eine signifikante Verlängerung des PFS beim Vergleich von Venetoclax-Dexamethason mit Pomalidomid-Dexamethason (9,9 vs. 5,8 Monate).9 Dies dürfte zum Teil auf die mit zunehmender Vorbehandlung einhergehende Entdifferenzierung der Myelomzellen zurückzuführen sein. Dies führt zu einer Endkuppelung der Korrelation zwischen Tumorzellen und Paraproteinproduktion. Dadurch wird es bei klinisch progredienten Patient:innen schwieriger, die (Protein-)Kriterien einer Progression zu erfüllen. Solche Patient:innen werden von verantwortungsvollen Prüfärzt:innen aus der Studie genommen und zensiert, wodurch die Power der Studie reduziert wird.
Die Bestätigung dieser Überlegungen ergibt sich aus der weitaus längeren Zeit bis zur nächsten Therapie in der Verum- im Vergleich zur Kontrollgruppe (21,2 vs. 8,3 Monate; p=0,001). Hervorzuheben sind zudem die höheren Remissionsraten (62% vs. 35%) sowie das numerisch längere Gesamtüberleben im Venetoclax-Dexamethason-Studienarm (32,4 vs. 24,5 Monate; p=0,067).
Mittlerweile werden neue Bcl-2-Inhibitoren evaluiert, wozu auch die besonders erfolgversprechende Substanz Sonrotoclax zählt. Dieser Bcl-2-Inhibitor blockiert auch Mcl-1, weist allerdings eine weitaus kürzere Halbwertszeit als Venetoclax auf. Hang Quach konnte mit diesem Bcl-2/Mcl-1-Inhibitor in Kombination mit Dexamethason eine Ansprechrate von 70% bei umfangreich vorbehandelten Patient:innen (>3 Vortherapien inklusive eines Proteasom-Inhibitors, eines IMiDs sowie eines CD38-Antikörpers) beobachten. Das Therapieregime wurde gut toleriert. Die häufigsten Nebenwirkungen betrafen hämatologische Veränderungen sowie eine erhöhte Inzidenz von Covid-19.10
Paul Richardson hat die Ergebnisse von drei Patient:innenkohorten, die mit Mezigdomid behandelt wurden, vorgestellt. Mezigdomid ist ein CELMoD (CRBN-E3-Ligase-Modulator). Es führt zu einer schnellen und effizienten Degradation von CRBN und CRBN-Zielproteinen, wie AEOLUS, IKARUS und IRF4. In Kombination mit Daratumumab und Dexamethason konnte bei umfangreich vorbehandelten Patient:innen abhängig vom Dosierungsschema eine Ansprechrate zwischen 61,1% und 88,9% erzielt werden. Ähnliche Resultate wurden auch in Kombination mit Elotuzumab-Dex beobachtet.
Diese Ergebnisse übertreffen die Resultate, die mit Pomalidomid-Kombinationen bei Lenalidomid-refraktären Patient:innen erzielt werden konnten. Dies unterstützt die Erwartung, dass mit Mezigdomid auch bei Patient:innen mit anderen Vortherapien und in anderen Kombinationen gute Ergebnisse erzielt werden können.11
Bispezifische Antikörper
Derzeit sind in Europa zwei bispezifische Antikörper (Teclistamab und Elranatamab) mit BCMA als Target und ein weiterer, der an GPR5C als Zielstruktur bindet (Talquetamab), registriert. Die hohe Wirksamkeit bispezifischer Antikörper (BsAk) ist mittlerweile gut belegt, allerdings sind mögliche Nebenwirkungen zu beachten, zum Beispiel das Auftreten eines Cytokin-Release-Syndroms (CRS) – in der Regel nur Grad 1–2 – bei etwa 70% der Patient:innen sowie eine erhöhte Infektionsrate. Zur Reduktion des Risikos eines CRS wird eine Step-up-Dosierung (d.h. Beginn an Tag 1 mit ultraniedrigen Dosierungen, gefolgt von einer reduzierten Dosis an Tag 4) vor der Standarddosierung empfohlen. Mit der Verabreichung von Tocilizumab (ein Anti-IL-6-Rezeptor-Antikörper) kann das Risiko für ein CRS deutlich reduziert werden.
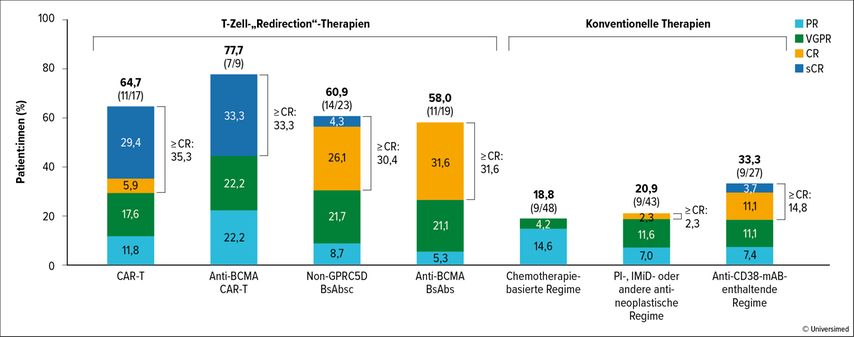
In der klinischen Praxis stellt sich die Frage nach der optimalen Sequenz des Einsatzes von BsAk- und CAR-T-Zell-Therapie, wobei gerade bei letztgenannter Behandlung funktionsfähige T-Zellen ohne T-Zell-Seneszenz wichtig sind. Interessant ist auch die Frage, wie weit eine BCMA-„redirecting“-Therapie nach Versagen von Talquetamab (Zielstruktur GPRC5D) wirksam ist. Sanchez et al. konnten in dieser Situation mit Anti-BCMA-CAR-T-Zellen (77,8%), aber auch mit Anti-BCMA-BsAbs (57,9%) hohe Ansprechraten erreichen. Das ist eine wichtige Information für die klinische Praxis (Abb. 3).12
Abb. 3: MonumenTAL-1-Studie – BCMA-„redirecting“-Therapie nach Versagen von Talquetamab (modifiziert nach Sanchez L et al.)12
CAR-T-Zell-Therapien
Mit beiden in Europa registrierten CAR-T-Zell-Produkten (Cilta-cel und Ide-cel) konnten in prospektiv randomisierten Vergleichsstudien eine überlegene Ansprechrate und ein verlängertes PFS im Vergleich zum Standard of Care erzielt werden. So wurden in der Studie CARTITUDE-3 mit Cilta-cel im Vergleich zu PVD oder DaraPd eine signifikant höhere Gesamtansprechrate und ein signifikant längeres PFS (medianes PFS noch nicht erreicht vs. 11,8 Monate; HR: 0,26; p<0,001) erzielt.13
In der KarMMa-3-Studie zeigten Daten zur Lebensqualität eine deutliche Verbesserung des Global-Health-Status und der Müdigkeit im Vergleich zur konventionellen Therapie – und das trotz der kurz nach CAR-T-Zell-Infusion erhöhten Toxizität mit hämatologischen Nebenwirkungen Grad 3/4 und Nausea.14 Bemerkenswert ist allerdings, dass bisher keine Gesamtüberlebensdaten berichtet wurden. Das lässt darauf schließen, dass durch die CAR-T-Zell-Therapie trotz des eindrucksvollen PFS-Vorteils bisher keine signifikante Verlängerung des Gesamtüberlebens bei vorbehandelten Patient:innen mit MM zu beobachten ist. Außerdem wurde bei einem mit CAR-T-Zellen (Cilta-cel) behandelten Patient:innen ein T-Zell-Lymphom als SPM („second primary malignancy“) beobachtet. Derzeit stehen 22 Fälle von SPM nach etwa 20000 CAR-T-Zell-Applikationen in allen Indikationen bei der FDA zur näheren Bewertung an. Rein zahlenmäßig betrachtet wurde diese Komplikation nur bei einer extremen Minderheit der Behandelten beobachtet. Dabei ist derzeit unklar, ob die Betroffenen bereits vor der CAR-T-Zell-Therapie eine maligne Zweiterkrankung aufwiesen oder diese erst nach und eventuell aufgrund der CAR-T-Zell-Behandlung aufgetreten ist (oder wahrscheinlicher aufgrund zytotoxischer Therapie in früheren Linien).
Literatur:
1 Mateos MV et al.: Blood Cancer J 2020; 10(10): 102 2 Mohyuddin GR et al.: eClinicalMedicine 2023; 65: 102272 3 Omar N et al.: ASH 2023; Abstr. #206 4 Sonneveld P et al.: ASH 2023; LBA 1 5 Gay F et al.: ASH 2023; Abstr.#4 6 Touzeau C et al.: ASH 2023; Abstr. #207 7 Mateos MV et al.: ASH 2023; Abstr. #209 8 Bahlis N et al.: ASH 2023; Abstr.#338 9 Mateos MV et al.: IMS 2023, OA #52 10 Quach H et al.: ASH 2023; Abstr. #1011 11 Richardson P et al.: ASH 2023; Abstr. #1013 12 Sanchez L et al.: ASH 2023; Abstr. #2009 13 Rodriguez-Otero P et al.: ASH 2023; Abstr. #1028 14 Delforge M et al.: ASH 2023; Abstr. #1003
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...