Molekularpathologische Diagnostik beim fortgeschrittenen Prostatakarzinom
Autor:
Prof. Dr. med. Wolfram Jochum
Institut für Pathologie
Kantonsspital St. Gallen
E-Mail: wolfram.jochum@kssg.ch
Genomische Veränderungen in Tumorzellen nachzuweisen, die ein Ansprechen auf neuere Systemtherapien voraussagen lassen, ist das Ziel der molekularpathologischen Diagnostik beim fortgeschrittenen Prostatakarzinom. Molekulare Biomarkertestungen werden aktuell vorallem im Stadium des metastasierten kastrationsresistenten Prostatakarzinoms durchgeführt.
Keypoints
-
Molekularpathologische Analysen ergänzen die histopathologische Diagnostik vor allem im Stadium des metastasierten kastrationsresistenten Prostatakarzinoms.
-
Die Tumortestung auf BRCA1/BRCA2-Mutation bzw. auf einen Defekt der DNA-Mismatchreparatur kann Patienten identifizieren, die auf eine Therapie mit einem PARP-Inhibitor (Olaparib, Rucaparib) bzw. mit einem Immuncheckpoint-Inhibitor (Pembrolizumab) ansprechen könnten.
-
Bei Prostatakarzinompatienten mit Nachweis einer somatischen Mutation in einem DNA-Reparaturgen sind genetische Beratung und Keimbahntestung zu prüfen.
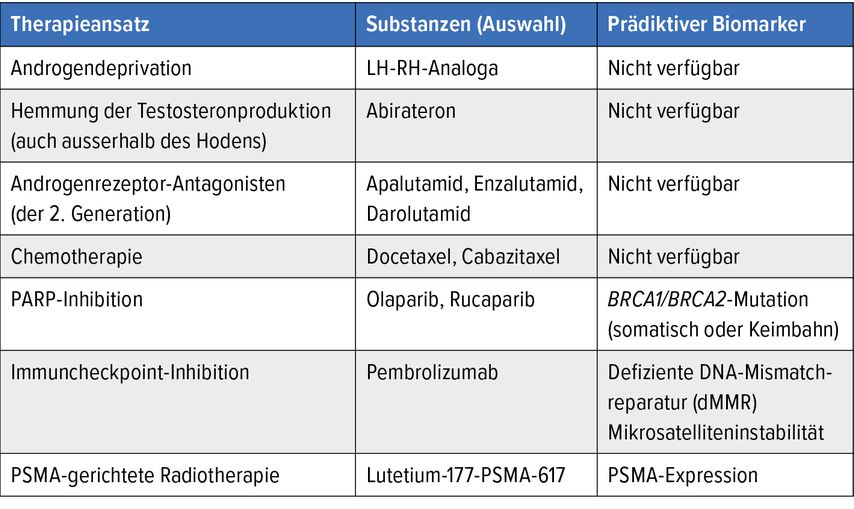
Für die Systemtherapie des fortgeschrittenen Prostatakarzinoms stehen verschiedene Behandlungsansätze zur Verfügung, die als Mono- oder Kombinationstherapie zur Anwendung kommen.1 Neben der Androgendeprivationstherapie (ADT) werden in Abhängigkeit vom Erkrankungsstadium die selektive Inhibition des Androgenrezeptor(AR)-Signalwegs, Chemotherapien, zielgerichtete Therapien und die PSMA(prostataspezifisches Membranantigen)-gerichtete Radiopharmakotherapie eingesetzt. Tabelle 1 bietet eine Übersicht über den aktuellen Stand prädiktiver Biomarker bei Systemtherapien des fortgeschrittenen Prostatakarzinoms.
Androgendeprivationstherapie
Die ADT wird in allen Stadien des fortgeschrittenen Prostatakarzinoms eingesetzt, teils in Kombination («ADT Plus») mit einem Inhibitor der Testosteronproduktion (Abirateron), mit einem Androgenrezeptor-Antagonisten (Apalutamid, Enzalutamid, Darolutamid) oder mit Docetaxel. Bisher sind keine molekularen Biomarker verfügbar, die ein Nichtansprechen auf eine primäre ADT vorhersagen lassen.
Unter ADT entwickelt sich regelhaft bei allen Patienten eine Krankheitsprogression infolge einer erworbenen (sekundären) Resistenz auf ADT (sog. Kastrationsresistenz). Die klinisch, radiologisch oder biochemisch nachgewiesene Progression unter wirksamer ADT markiert den Übergang in ein kastrationsresistentes Prostatakarzinom (CRPC). Meistens liegt das CRPC in einem metastasierten Stadium vor. Wesentliche Entstehungsmechanismen einer ADT-Resistenz sind Amplifikationen, Mutationen und Splicevarianten (besonders die Variante AR-V7) des AR-Gens.2,3 Die genannten Veränderungen des AR-Gens können mittels molekularer Verfahren in Gewebeproben und zirkulierenden Tumorzellen nachgewiesen werden, haben allerdings bisher keine klinisch-therapeutische Bedeutung im Einzelfall.
Bei rund 20% der Patienten mit AR-gerichteter Therapie entwickelt sich aus dem azinären Adenokarzinom der Prostata ein kleinzelliges neuroendokrines Karzinom.4 Der Nachweis dieser mit einer schlechten Prognose assoziierten Transformation erfolgt durch die pathologische Analyse einer Gewebe-/Zellprobe. Neben dem charakteristischen Phänotyp der Karzinomzellen ist der Nachweis einer Expression neuroendokriner Marker (Synaptophysin, Chromogranin A, CD56) diagnostisch.
Poly(ADP-Ribose)-Polymerase(PARP)-Inhibitoren
Bei etwa 20% der Prostatakarzinome finden sich somatische Mutationen in Genen, die für Proteine codieren, die an der Reparatur von DNA-Schäden mittels homologer Rekombination (HR) beteiligt sind.5,6 Dazu gehören unter anderem «breast cancer 1» (BRCA1), BRCA2, «ataxia teleangiectasia mutated» (ATM), «BRCA1-interacting protein 1» (BRIP1), Checkpoint-Kinase 2 (CHEK2) und «partner and localizer of BRCA2» (PALB2). In Zellen mit fehlender HR-Reparatur können PARP(Poly[ADP-Ribose]-Polymerase)-Inhibitoren den Zelltod durch Apoptose induzieren. In der PROfound-Studie verlängerte Olaparib das progressionsfreie Überleben und das Gesamtüberleben von Patienten mit metastasiertem CRPC (mCRPC), falls in den Tumorzellen eine Mutation im BRCA1-, BRCA2- oder ATM-Gen vorlag.3,8 Auch Rucaparib und Talazoparib zeigten in klinischen Studien Wirksamkeit bei mCRPC mit einer pathogenen BRCA-Mutation.9,7
In der Schweiz ist Olaparib für die Verwendung bei mCRPC nach Versagen einer neuen endokrinen Therapie zugelassen, falls eine BRCA1- oder BRCA2-Mutation vorliegt (somatisch oder in der Keimbahn). Die Testung kann an archiviertem Karzinomgewebe durchgeführt werden, das bereits bei Diagnosestellung entnommen wurde. Methodisch wird in der Regel die Hochdurchsatzsequenzierung («next-generation sequencing», NGS) eingesetzt. Dieses Verfahren ermöglicht den Nachweis weiterer genomischer Alterationen in der gleichen Analyse.
Ipatasertib
Ipatasertib hemmt die Aktivität der Serin/Threonin-Kinase AKT, einer Hauptkomponente des PI3K(Phosphoinositid-3-Kinasen)-Signaltransduktionswegs.
In der IPATential150-Studie wurde die Wirksamkeit einer Behandlung mit Ipatasertib in Kombination mit Abirateron bei Patienten mit mCRPC untersucht.10 Bei mCRPC mit einem PTEN(«phosphatase and tensin homolog»)-Funktionsverlust führten Ipatasertib/Abirateron zu einem signifikant verlängerten radiografischen progressionsfreien Überleben im Vergleich zu Placebo/Abirateron.
Ein Funktionsverlust des Tumorsuppressors PTEN liegt bei rund 50% der Prostatakarzinome vor, wird durch homozygote Deletion oder Mutationen des PTEN-Gens verursacht und ist mit einer gesteigerten Aktivierung des PI3K/AKT-Signalwegs assoziiert. Eine PTEN-Inaktivierung in Tumorzellen kann direkt durch DNA-Analyse (Sequenzierung, fluoreszente In-situ-Hybridisierung [FISH]) oder durch PTEN-Immunfärbung nachgewiesen werden.
Immuncheckpoint-Inhibitoren
Bei 2–3% der fortgeschrittenen Prostatakarzinome liegt in den Tumorzellen ein Ausfall der DNA-Mismatchreparatur (MMR) vor.11 In mehreren Ländern hat der Immuncheckpoint-Inhibitor Pembrolizumab eine Tumortyp-agnostische Zulassung und kann eingesetzt werden, falls eine MMR-Defizienz vorliegt. Der Nachweis erfolgt durch immunhistochemische Expressionsanalyse der DNA-Mismatchreparatur-Proteine MutL-Homolog 1 (MLH1), MutS-Homolog 2 (MSH2), MSH6 und PMS1-Homolog 2 (PMS2) oder durch Analyse der Tumor-DNA auf Mikrosatelliteninstabilität (MSI).
Hereditäre Tumorprädisposition
Rund 10% der Patienten mit Prostatakarzinom tragen eine Keimbahnmutation in einem DNA-Reparaturgen (BRCA2, ATM, CHEK2, BRCA1, MLH1, MSH2, MSH6, PMS2). Keimbahnmutationen in den genannten Genen führen zu einem bis zu 8-fach erhöhten Erkrankungsrisiko für ein Prostatakarzinom. Eine in Tumorzell-DNA nachgewiesene pathogene Sequenzvariante kann auf das Vorliegen einer Keimbahnmutation und somit auf eine erbliche Grundlage des Prostatakarzinoms hindeuten. Daher sollten Patienten vor einer genomischen Tumortestung darüber informiert werden, dass sich bei der Analyse Hinweise auf eine Keimbahnmutation ergeben können. Bei Nachweis einer somatischen Mutation in einem DNA-Reparaturgen sind eine genetische Beratung und eine Keimbahntestung indiziert.
PSMA-gerichtete Radiopharmazeutika
Das PSMA wird von Prostatakarzinomzellen auf der Zelloberfläche exprimiert. Kürzlich wurde bei mCRPC die Wirksamkeit einer Radioliganden-Therapie mit Lutetium-177(Lu-177)-PSMA-617 in zwei randomisierten Therapiestudien dokumentiert.12,13 Die PSMA-Expression kann mittels Immunfärbungen an Tumorgewebsproben untersucht werden. Der klinische Nutzen dieser Analyse ist jedoch gering, da die PSMA-Expression mittels PSMA-PET/CT (Positronenemissions-Tomografie/Computertomografie) direkt in vivo untersucht werden kann.
Ausblick
Durch die Entwicklung neuer zielgerichteter Therapieansätze wird die Zahl der klinisch relevanten molekularen Biomarker weiter zunehmen. Bei Patienten ohne verfügbares Tumorgewebe könnte sich zellfreie Tumor-DNA (cfDNA) im Plasma zu einer Alternative für den Nachweis von genomischen Alterationen mit prädiktiver und/oder prognostischer Bedeutung entwickeln.
Literatur:
1 Parker C et al.; ESMO Guidelines Committee: Ann Oncol 2020; 31: 1119-34 2 Sartor O, de Bono JS: N Engl J Med 2018; 378: 645-57 3 de Bono J et al.: N Engl J Med 2020; 382: 2091-102 4 Aggarwal R et al.: J Clin Oncol 2018; 36: 2492-503 5 Cancer Genome Atlas Research, Network: Cell 2015; 163: 1011-25 6 Robinson D et al.: Cell 2015; 161: 1215-28 7 de Bono JS et al.: Lancet Oncol 2021; 22: 1250-64 8 Hussain M et al.;ROfound trial investigators: N Engl J Med 2020; 383: 2345-57 9 Abida W et al.;Triton investigators: J Clin Oncol 2020; 38: 3763-72 10 Sweeney C et al.: Lancet 2021; 398: 131-42 11 Abida W et al.: JAMA Oncol 2019; 5: 471-78 12 Hofman M S et al.;Group Prostate Cancer Trials: Lancet 2021; 397: 797-804 13 Sartor O et al.;Vision investigators: N Engl J Med 2021; 385: 1091-103
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...