
Molekulare Therapiestratifizierung beim Mammakarzinom
Leiter Brustzentrum
Medizinbereich Frau-Kind<br>Universitätsspital Zürich<br>E-Mail: konstantin.dedes@usz.ch
Die Zunahme des Verständnisses molekularer und genomischer Grundlagen bei der Entstehung und Behandlung von Karzinomen hat zu einer Identifizierung möglicher molekularer Targets geführt. Während Immuntherapien bei anderen Tumorentitäten wie dem Melanom oder dem nichtkleinzelligen Lungenkarzinom (NSCLC) bereits Einzug in den klinischen Alltag gehalten haben, ist die «Landscape» der Immuntherapien beim Mammakarzinom noch in den Kinderschuhen. Doch was hat die Precision Pathology beim Brustkrebs bisher gebracht?
Keypoints
-
Es hat bereits ein Umdenken von histologischen zu genomisch getriebenen Therapiestratifizierungen stattgefunden.
-
Die Stratifizierung der Mammakarzinome basierend auf prädiktiven molekularen Biomarkern beherbergt die Möglichkeit, eine Subgruppe von Patientinnen zu identifizieren, welche von einer Targeted Therapy oder Immuntherapie profitieren könnte.
-
Strategien sollten das Screening von seltenen Genveränderungen (z.B. NTRK-Fusion) beinhalten.
-
Eine interdisziplinäre Besprechung von Befunden an einem molekularen Tumorboard ist essenziell, um eine optimale Behandlung der Patientinnen zu gewährleisten.
Bereits früh hat man in der Behandlung des Mammakarzinoms den Vorteil von personalisierter Medizin und individualisierter Therapie festgestellt. Mithilfe von morphologischen wie auch histopathologischen Aspekten konnten beim Mammakarzinom Subtypen abgegrenzt werden, die bei Vorliegen von Östrogen- und Progesteronrezeptoren und dem HER2-Rezeptor («human epidermal growth factor receptor 2») mit endokriner Therapie und gegen den HER2-Rezeptor gerichteten Antikörpern behandelt werden können.
Mit mRNA-Genexpressionstests wie dem Oncotype DX, Mammaprint oder EndoPredict konnten zusätzlich zu Markern wie der Tumorgrösse und dem Proliferationsmarker Ki-67 spezifischere Aussagen über die Notwendigkeit einer adjuvanten Chemotherapie bei hormonabhängigen Mammakarzinomen gemacht werden. Dadurch war es möglich, aggressivere Tumoren von weniger aggressiven Tumoren zu unterscheiden und herauszufiltern. Gleichwohl hat sich eine Untergruppe von Patientinnen herauskristallisiert, die nicht von einer Chemotherapie profitiert.1 Damit hat sich das Mammakarzinom vom«one fits all»zum«one fits one» abgehoben.
Doch längst bedienen wir uns darüber hinaus molekularer Therapiestratifizierungsmethoden, die als prädiktive Biomarker vorhersagen können, welche individualisierte Therapie den Patientinnen angeboten werden kann. Gross angelegte Basket Trials stratifizieren nicht mehr nach Tumortyp und Histologie, sondern bilden parallel markerbasierte Kohorten (sog. Baskets) und schliessen Patienten mit verschiedenen Tumortypen ein.
Diese Übersicht soll Ihnen einen Überblick über die aktuelle Datenlage geben. In Abbildung 1 sind zudem molekulare Marker beim metastasierten Mammakarzinom zusammengefasst.
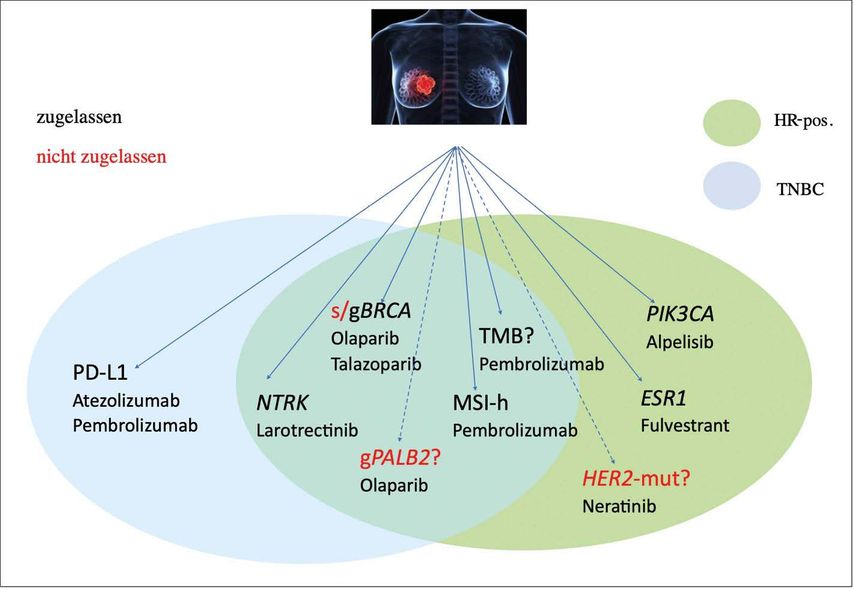
Abb. 1: Molekulare Marker beim metastasierten Mammakarzinom (blau: TNBC, grün: HR-pos.)
BRCA1/2 in Mammakarzinomen
Ca. 5% aller Mammakarzinome betreffen eine Subpopulation von Patientinnen mit «Germline»-BRCA(«Breast cancer»)-Mutation.2 Keimbahnmutationen im BRCA1/2-Gen sind häufiger bei jungen Patientinnen, positiver Familienanamnese, in der Ashkenazi-Population und bei tripelnegativem Brustkrebs (Hormonrezeptor[HR]-neg., HER2-neg.; TNBC). Analog den Ovarialkarzinomen zeigen TNBC eine Platinsensibilität sowie ein Ansprechen auf PARP(Poly[ADP-ribose]-Polymerase)-Inhibitoren.3
Tutt et al. konnten im TNT-Trial zeigen, dass die Gesamtansprechrate (ORR) unter Carboplatin im Vergleich zu Docetaxel bei Patientinnen mit fortgeschrittenem TNBC und «Germline»-BRCA1/2-Mutation verdoppelt werden konnte. Ein Vorteil für Subgruppen mit BRCA1-Methylierung oder Myriad-HRD(homologe Rekombinationsreparaturdefizienz)-positivem Status konnte im Gegensatz dazu jedoch nicht gezeigt werden.3 In der OlympiAD-Studie wurde die Anwendung von Olaparib, einem PARP-Inhibitor, bei HER2-negativem metastasiertem Brustkrebs und einer «Germline»-BRCA-Mutation untersucht. Das mediane progressionsfreie Überleben (PFS) war 2,8 Monate länger und die Krankheitsprogression 42% niedriger als mit einer Standardchemotherapie of «physician’s choice». Die finalen Daten konnten insgesamt keine signifikante Verlängerung des Gesamtüberlebens (OS) zeigen, ausser in der Gruppe von Patientinnen ohne vorgängige Chemotherapie in der Metastasierung, bei denen ein 7,9 Monate längeres medianes OS beobachtet werden konnte.2 Die Tatsache, dass Olaparib bei nicht vorbehandelten Patientinnen einen Benefit zeigt, wurde bereits vorgängig beschrieben.4
In der EMBRACA-Studie konnten Litton et al. zeigen, dass Talazoparib bei Patientinnen mit metastasiertem Mammakarzinom und gBRCA-Mutation einen signifikanten Vorteil gegenüber einer Standardchemotherapie aufwies. Das mediane PFS betrug 8,6 Monate versus 5,6 Monate in der Talazoparib-Gruppe (HR: 0,54; 95% CI: 0,41–0,71; p<0,001).5
Zusammenfassend sollte der BRCA-Mutationsstatus bei allen metastasierten Mammakarzinomen bestimmt werden, da eine BRCA-Mutation als prädiktiver Marker für die Vorhersage eines Ansprechens einer platinbasierten Chemotherapie oder zielgerichteten Therapie mit PARP-Inhibitoren herangezogen werden kann.
PD-L1-Expression
Mit den Ergebnissen der Phase-III-Studie ImPassion 130 wurde das Mammakarzinom in die Immuntherapie-Ära katapultiert. Die erste Zulassung eines Immuncheckpoint-Inhibitors zur Behandlung von Mammakarzinomen erhielt Atezolizumab, ein PD-L1(«Programmed cell death 1 ligand 1»)-Antikörper, welcher in Kombination mit Abraxane (nab-Paclitaxel) beim metastasierten TNBC geprüft wurde. Schmid und Kollegen konnten einen substanziellen Benefit im OS bei PD-L1-positiven, metastasierten, tripelnegativen Mammakarzinomen durch die Addition des Anti-PD-L1-Antikörper Atezolizumab zur «first line»-Chemotherapie mit nab-Paclitaxel zeigen. Das mediane OS war um knapp 10 Monate verlängert im Vergleich zum Chemotherapie-Arm.6
Ein vergleichbarer Benefit konnte in der Phase-III-Studie KEYNOTE-355 gezeigt werden, in welcher Patientinnen mit nicht vorbehandeltem, inoperablem oder metastasiertem TNBC eingeschlossen wurden. Bei Patientinnen, deren Tumoren PD-L1 mit einem Combined Positive Score (CPS) ≥10 exprimierten, führte Pembrolizumab plus Chemotherapie gegenüber Placebo und Chemotherapie zu einer klinisch und statistisch signifikanten Verlängerung des PFS um 4,1 Monate auf 9,7 Monate.7 Die erlaubten Chemotherapien waren nab-Paclitaxel, Paclitaxel oder Carboplatin/Gemcitabin. Geprüft werden nun Immuncheckpoint-Inhibitoren im neoadjuvanten Setting, wobei die Langzeitdaten abgewartet werden müssen. Erste Daten zeigen, dass sich eine Erhöhung der pCR(pathologische Komplettremission)-Raten erreichen lässt.8
Mikrosatelliteninstabilität
Le et al. konnten in einer Phase-II-Basket-Studie zeigen, dass «mismatchrepair»-defiziente solide Tumoren (dMMR) ein besseres Ansprechen auf eine PD-1-Blockade mit Pembrolizumab zeigten als MMR-profiziente Tumoren. Die Autoren beschreiben, dassdie Anzahl der mutationsassoziierten Neoantigene, welche aus einemdMMR resultieren, Ursache für das erhöhte Anti-PD-1(«Programmed cell death protein 1»)-Ansprechen dieser Subgruppe an Tumoren ist.9 Etabliert ist der Mikrosatelliteninstabilitäts(MSI)-Status vor allem bei den Kolorektal-, Endometrium- und Magenkarzinomen, bei denen er eine prädiktive und prognostische Bedeutung hat. MMR-defiziente Tumoren finden sich zwar nur sehr selten beim Mammakarzinom (1–2%), allerdings scheinen diese Karzinome besonders gut auf eine tumoragnostische Therapie anzusprechen und sollten diesbezüglich überprüft werden.10
ESR1-Mutation
Der ESR1(«Estrogen receptor 1»)-Mutationsstatus kann bestimmt werden bei metastasiertem, HR-positivem Mammakarzinom, um zu überprüfen, ob eine erneute endokrine Therapie mit einem Aromataseinhibitor zielführend ist. Bei Vorliegen einer ESR1-Mutation sollte Fulvestrant als endokrine Challenge gewählt werden, da Fulvestrant eine endokrine Resistenz gegen Aromataseinhibitoren umgehen kann und somit eine Therapiemöglichkeit bietet.
PIK3CA-Mutation
Die Antwort auf endokrine Resistenzen bei Patientinnen mit HR-positiven Mammakarzinomen, die lange mit endokriner Therapie behandelt wurden und einen Progress erleiden, lieferte die SOLAR-1-Studiengruppe.11 Ca. 40% aller HR-positiven, HER2-negativen Mammakarzinome beherbergen eine aktivierende Mutation im Gen «Phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit alpha» (PIK3CA), was wiederum zu einer Hyperaktivierung der Alpha-Isoform (p110α) der Phosphatidylinositol-3-Kinase (PI3K) führt. Alpelisib ist ein alpha-spezifischer PI3K-Inhibitor, der diese Isoform blockiert. Alpelisib zeigte in einer Phase-I-Studie mit Fulvestrant Ansprechraten von 29% bei PIK3CA-Mutation.12
In einer randomisierten Phase-III-Studie wurden bei HR-positiven, HER2-negativen, metastasierten Mammakarzinomen mit endokriner Vorbehandlung und Progression in einer Gruppe mit PIK3CA-Mutation und in einer Gruppe ohne Mutation das PFS und das Ansprechen unter Alpelisib mit Fulvestrant versus Placebo mit Fulvestrant verglichen. In der untersuchten Kohorte mit PIK3CA-Mutation zeigten sich ein verlängertes PFS von 11,0 versus 5,7 Monate und ein verlängertes OS von 7,9 Monaten bei endokrin vorbehandelten Patientinnen. Offen bleibt, wie Alpelisib mit weiteren antihormonellen Kombinationspartnern wirkt.11
NTRK-Fusionen
NTRK(«Neurotrophic tropomyosin receptor kinase»)-Fusionen haben sich in den letzten Jahren als Target für die Behandlung diverser solider Tumoren herausgestellt, wie sich in mehreren Case Reports und zuletzt Basket Trials gezeigt hat.13,14 Die Familie der Tropomyosin-Rezeptor-Kinasen (Trk) besteht aus 3 Membranproteinen (TrkA, TrkB and TrkC), welche durch die Gene NTRK1, NTRK2und NTRK3 kodiert werden und eine essenzielle Rolle in der Entwicklung und Funktion des Nervensystems spielen. NTRK-Fusionen, sog. intrachromosomale oder interchromosomale Rearrangements, führen zur Transkription dimerer Trk-Proteine mit einer aktivierten oder sogar überexprimierten Kinasefunktion.
Genfusionen des NTRK-Gens, bekannt vor allem bei infantilen Fibrosarkomen, beherbergen ein hohes onkogenes Potenzial, was auch im Falle des Mammakarzinoms, im Speziellen beim sekretorischen Mammakarzinom, gezeigt werden konnte.15 Dieser seltene Subtyp der invasiven Mammakarzinome wurde initial bei Kindern und Jugendlichen beobachtet, ist jedoch zum gleichen Anteil bei Erwachsenen vorliegend. 2002 berichteten Tognon et al. von der ETV6(«ETS variant transcription factor 6»)-NTRK3-Genfusion t(12;15)(p12;q26,1) als pathognomonischem Faktor dieses seltenen Karzinoms.15 Drilon et al. untersuchten die Wirkung von Larotrectinib, einem hochselektiven Trk-Inhibitor, bei soliden Tumoren mit NTRK-Fusionen in Kindern und Erwachsenen. Ein Ansprechen konnte unabhängig vom Tumortyp, Alter der Patienten und Fusionsstatus gezeigt werden. Es wurde kein «drug-related» Therapieabbruch beobachtet, was vermuten lässt, dass diese Substanz auch für Langzeittherapien geeignet wäre.16
HER2/HER3
Wir wissen, dass HER2-Mutationen vor allem bei hormonrezeptorpositiven, lobulären Mammakarzinomen auftreten können. Ein interessanter Ansatz wurde durch Hyman et al. in der SUMMIT-Studie gezeigt, in dem Neratinib (ein Pan-HER-Kinase-Inhibitor) in einem Basket Trial vor allem bei Mammakarzinomen, Gallenblasenkarzinomen und Zervixkarzinomen ein Ansprechen zeigte.17
HRD
In Anlehnung an BRCA-mutierte Mammakarzinome ist es nachvollziehbar, dass Mutationen in weiteren Genen, die an der homologen Rekombination beteiligt sind, zu einem Ansprechen auf PARP-Inhibitoren führen könnten. Kuemmel et al. berichteten in einem Case Report von einer Patientin mit BRCA-wt-metastasiertem Mammakarzinom, die ein Ansprechen auf Olaparib über 8 Monate zeigte. Das dramatische Ansprechen dieser Patientin wurde auf eine Sequenzvariante in der Keimbahn des PALB2(«Partner and localizer of BRCA2»)-Gens zurückgeführt und zeigt, so die Autoren, dass das klinische Potenzial von PARP-Inhibitoren auf Patientinnen mit genetischen Veränderungen, die auf einen HRD-positiven Status hindeuten, ausgeweitet werden sollte.18
Beim ASCO-Kongress 2020 präsentierten Tung et al. die Ergebnisse einer kleinen «Proofofprinciple»-Phase-II-Studie, in der gezeigt werden konnte, dass in Anlehnung an das Ansprechen auf Olaparib bei isolierten BRCA-Mutationen des Ovarialkarzinoms auch bei Mammakarzinomen eine isolierte somatische BRCA-Mutation oder eine «Germline»-non-BRCA-Mutation einen Angriffspunkt für die Therapie mit PARP-Inhibitoren bei metastasierten Mammakarzinomen darstellen kann. Eine Aktivität konnte bei gPALB2-oder sBRCA1/2-Mutation beobachtet werden, nicht jedoch bei ATM- oder CHEK2-Mutationen.19
«Tumor mutational burden»
Zur Schätzung der neoantigenen Expression eines Tumors kann die«tumor mutational burden» (TMB) herangezogen werden. Samstein et al. konnten in einer grossen Analyse von klinischen und genomischen Daten von 1622 immuntherapierten und 5371 nichtimmuntherapierten Patienten, welche an fortgeschrittenen, soliden Tumoren erkrankt waren, zeigen, dass eine hohe somatische TMB mit einem besseren Überleben assoziiert war. 20 Eine Monotherapie mit Pembrolizumab bei Tumoren mit einer TMB ≥10 mut/Mb erscheint möglich, jedoch müssen weitere Langzeitdaten abgewartet werden.
Literatur:
1 Sparano JA et al.: J Clin Oncol 2018; 36 (18_suppl): LBA1 2 Robson M et al.:N Engl J Med 2017; 377(6): 523-33 3 Tutt A et al.: Nat Med 2018; 24(5): 628-37 4 Kaufman B et al.: JClin Oncol 2015; 33(3): 244-50 5 Litton JK et al.: N Engl J Med 2018; 379(8):753-63 6 Schmid P et al.: Lancet Oncol 2020; 21(1): 44-59 7 Cortes J et al.: J Clin Oncol 2020; 38 (15_suppl): 1000 8 Mittendorf EA et al.: Lancet 2020; 396(10257): 1090-100 9 Le DT et al.: N Engl J Med 2015; 372(26): 2509-20 10 Bonneville R et al.: JCO Precis Oncol 2017; 2017: PO.17.00073 11 André F et al.: N Engl J Med 2019; 380(20): 1929-40 12 Juric D et al.: J Clin Oncol 2020; 36(13): 1291-9 13 Amatu A et al.: ESMO Open 2016; 1(2): e000023 14 Hong DS et al.: Ann Oncol 2019; 30(2): 325-31 15 Tognon C et al.: Cancer Cell 2002; 2(5): 367-76 16 Drilon A et al.: N Engl J Med 2018; 378(8): 731-9 17 Hyman DM et al.: Nature 2018; 554(7691): 189-94 18 Kuemmel S et al.: NPJ Breast Cancer 2020; 6(1): 31 19 Tung NM et al.: J Clin Oncol 2020; 38 (15_suppl): 1002 20 Samstein RM et al.:Nat Genet 2019; 51(2): 202-6
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...


