Moderne Axillachirurgie: primär und nach Systemtherapie
Autorin:
OÄ Dr. Stephanie Kacerovsky-Strobl
Leitung Brustgesundheitszentrum
Franziskus-Spital, Wien
Immer mehr Studien weisen darauf hin, dass Axillachirurgie bei Brustkrebspatient:innen weder primär noch sekundär mit einem Vorteil in der Prognose vergesellschaftet ist. Eindiagnostisches und therapeutisches Umdenken darf erwartet werden.
Axillachirurgie – primär
Seit den Anfängen der Mammachirurgie erleben wir ein stetes Bestreben der Deeskalation, einerseits, um das Morbiditätsrisiko zu senken, und andererseits, um ein schlechtes kosmetisches Ergebnis zu vermeiden – all dies unter Einhaltung der Patient:innensicherheit.
So verhält es sich auch in dem Bereich der Axillachirurgie bei Brustkrebspatient:innen.
ACOSOG Z0011: kein Überlebensvorteil bei Axilladissektion
Der Versuch der Deeskalation begann mit der vielzitierten und weitreichenden Arbeit von AE Giuliano zur Phase-III-Studie ACOSOG Z0011 über die Unterlassung einer Axilladissektion bei einer Lymphknotenmetastase im Sentinel-Lymphknoten.1
Die wohlbekannten und viel diskutierten Kritikpunkte waren vor allem das Miteinbeziehen von Mikrometastasen, welche bereits 2011 keine zwingende Indikation für eine Axilladissektion bei Patient:innen mit invasivem Brustkrebs darstellten. Auch die Phase-III-Studie IBCSG 23-01 konnte zeigen, dass bei Brustkrebs im Frühstadium (T1) bei Vorliegen einer Mikrometastasierung im Sentinel-Lymphknoten und entsprechender adjuvanter Therapie mit Bestrahlung der Brust und medikamentöser Therapie kein Überlebensvorteil für die Patient:innen mit Axilladissektion besteht.2
Als im Jahr 2021 die Zehn-Jahres-Datender ACOSOG-Z0011-Studie präsentiert wurden und die Kurven (Axilladissektion vs. keine Axilladissektion) nicht signifikant auseinanderwichen und somit kein Überlebensbenefit für die Patient:innen in der Axilladissektions-Gruppe gezeigt werden konnte, lag es auf der Hand, dass bei dieser Patient:innengruppe auf eine AD verzichten werden kann.3
Es sei erwähnt, dass hauptsächlich (mit knapp 70%) klinisch nodal-negative T1-Karzinome inkludiert wurden.
SOUND: kein Benefit für Biopsien
Einen wesentlichen Schritt weiter in Richtung Deeskalation der Axillachirurgie macht der SOUND-Trial (Phase III).4
Beim SOUND-Trial handelt es sich um eine prospektive, randomisierte Phase-III-Studie zur Nichtunterlegenheit. Die Fragestellung ist, ob es sicher sein kann, bei Patient:innen mit einem kleinen Brustkrebsherd und sonografisch negativer Axilla auf eine Sentinel-Lymphknoten-Biopsie (SNB) zu verzichten.
Inkludiert wurden in die Studie im Zeitraum Februar 2012 bis Juni 2017 insgesamt 1405 Frauen jeglichen Alters mit einem Tumor unter 2cm und klinisch negativer Axilla zum Zeitpunkt des Studieneinschlusses sowie dem Plan einer brusterhaltenden Operation und anschließender Bestrahlungstherapie.
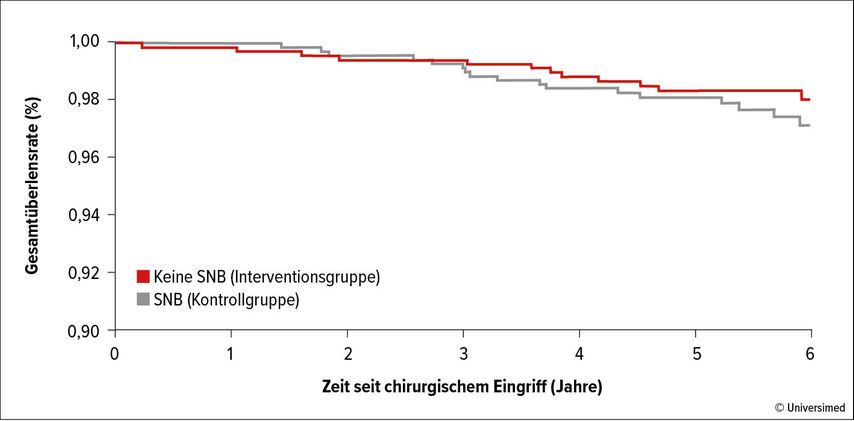
Die Ergebnisse, die im Rahmen der St.Gallen International Breast Cancer Conference 2023 präsentiert wurden, zeigten keinen Überlebensbenefit für jene Patient:innen, die einer Sentinel-Lymphknoten-Biopsie unterzogen wurden (Abb. 1). Hier sind jedoch die genauen Patient:innen-/Tumor-Charakteristika zu berücksichtigen. Es handelte sich vornehmlich um Luminal-A-Karzinome (ER: positiv, HER2: negativ, T1-Karzinome 0,8–1,5cm im Durchmesser). Lediglich knapp 14% der Patient:innen in der Sentinelgruppe hatten auch tatsächlich positive Lymphknoten in der Axilla (5,1% Mikrometastasen und 8,6% Makrometastasen sowie 0,6% mit mehr als vier positiven Lymphknoten).
Abb. 1: Überleben seit Axilladissektion/Sentinel-Lymphknoten-Biopsie (SNB) im SOUND-Trial. Modifiziert nach Gentilini OD et al.4
Diese Ergebnisse lassen die Vermutung aufkommen, dass ein Verzicht auch auf eine Sentinel-Lymphknoten-Biopsie für Patient:innen, die die Inklusionskriterien des SOUND-Trials erfüllen, eine Möglichkeit sein kann, sofern das Fehlen der Information über den Lymphknotenstatus keine Relevanz für die weitere adjuvante Therapie hat.
Unklar bzw. nicht vorhanden sind hier jedoch die Daten über die Art der adjuvanten Bestrahlung, die, sofern die Axilla mit einbezogen wurde, von Bedeutung sind.
McKevitt: Verzicht auf Biopsie bei ausgewählten Gruppen
Eine weitere Studie, die sich mit der Unterlassung der Sentinel-Lymphknoten-Biopsie beschäftigt, ist die Studie der Arbeitsgruppe von McKevitt.5
Hier lautet die Fragestellung, ob eine SNB bei Frauen mit klinisch negativer Axilla (cN0), einem Alter von über 70 Jahren und einem Luminal-A-Karzinom im Frühstadium überhaupt durchgeführt werden soll. Das brustkrebsfreie Überleben lag in dieser Studie bei 96% in beiden Gruppen, bei einem im Vergleich zu den anderen Studien kürzeren Nachbeobachtungsintervall von 4,3 Jahren.
Somit liegt auch hier ein klares Anzeichen dafür vor, dass in einer ausgewählten Patient:innengruppe auf eine Sentinel-Lymphknoten-Biopsie verzichtet werden kann, sofern die adjuvante Bestrahlung und Hormontherapie durchgeführt werden.
Axillachirurgie – nach neoadjuvanter Systemtherapie
Wie sieht das Vorgehen nun nach vorangeganener Systemtherapie aus?
Hier unterscheiden wir im Wesentlichen drei Gruppen:
-
Patient:innen, die vor Beginn der Systemtherapie klinisch und radiologisch eine negative Axilla aufweisen (cN0) und auch danach negativ sind (ypSN0)
-
Patient:innen, die initial positive Lymphknoten haben (cN1) und nach der Therapie nodal-negativ (ypSN0) werden
Patient:innen mit primär klinisch positiver Axilla (cN1), die auch nach der neoadjuvanten Systemtherapie positiv (ypSN1) bleiben
Zahlreiche Studien beschäftigen sich mit diesen drei Gruppen, einige davon sollen im Folgenden vorgestellt werden.
Für die erste Patient:innengruppe, die Patient:innen mit prä- und posttherapeutisch negativer Axilla, herrscht ein klarerKonsensus über das Vorgehen in der Axilla: Der Konsensus ist eine Sentinel-Lymphknoten-Biopsie. Dies wurde auch im Rahmen der St.Gallen International Consensus Konferenz 2017 bestätigt.
Die zweite Patient:innengruppe, jene Frauen, die initial, sprich vor der neoadjuvanten Systemtherapie, eine positive Axilla gezeigt haben und nach Beendigung der Systemtherapie einen Switch und somit eine negative Axilla aufweisen, steht im Fokus vieler Studien, die alle zum Ziel haben, die richtigen Lymphknoten sicher zu detektieren, sprich jene, die vor der Therapie noch positiv waren.
In der Phase-II-Studie ACOSOG Z107um die Arbeitsgruppe von Judy Boughey betrug die Falsch-negativ-Rate (FNR) in Bezug auf den Sentinel-Lymphknoten 10%, was weitere Studien und Methoden hervorbrachte, um in dieser Patient:innengruppe eine Axilladissektion sicher vermeiden zu können.6
Die Phase-III-Studie SENTINA zeigte eine zwar immer noch etwas höhere FNR von 7,3%, diese war jedoch schon etwas geringer als in vorangegangenen Studien.7
Die Studie SN FNAC wies mit knapp 5% bereits eine etwas geringere FNR auf.8
Weitere Studien beschäftigten sich mit der sogenannten TAD, der „targeted axilla dissection“, einer Methode, bei der vor der neoadjuvanten Chemotherapie (NACT)clipmarkierte Lymphknoten plus der Sentinel-Lymphknoten entfernt werden.
Einen Schritt weiter ging man mit dem MARI-Prinzip.9 Hier wird der positive Lymphknoten mit einem radioaktiven Seed selektiv markiert und nach neoadjuvanter Therapie mittels Gammasonde entfernt. Die Identifikationsrate lag hier bei 97% und die Falsch-negativ-Rate bei 7%.
Was bedeutet dies nun für den klinischen Alltag?
-
cN0→ypSN0 nach NACT: In diesem Setting herrscht aufgrund der aktuellen Studienlage Konsens, dass eine SNB ausreichend ist.
-
cN1→ypSN0 nach NACT: Aktuelle Entwicklungenlegen die Vermutung nahe, dass es in absehbarer Zeit auch hier Änderungen geben wird, im Augenblick sollte hier nur im Rahmen von Studien und TAD bei negativem Sentinel nach NACT auf eine Axilladissektion verzichtet werden.
cN1→ypN1 nach NACT: Hier liegen kaum Daten vor, die den Verzicht auf eine Axilladissektion stützen würden.
Die Zeichen der Zeit stehen weiterhin auf Veränderung und Deeskalation, es bleibt also spannend, wie wir in Zukunft unsere Patient:innen in der Axilla operieren werden.
Literatur:
1 Giuliano AE et al.: Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial. JAMA 2011; 305(6): 569-75 2 Galimberti V et al.: Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases (IBCSG 23-01): a phase 3 randomised controlled trial. Lancet Oncol 2013; 14: 297-305 3 Giuliano AE et al.: Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial. JAMA 2011; 305(6): 569-75 4 Gentilini OD et al.: Sentinel lymph node biopsy vs no axillary surgery in patients with small breast cancer and negative results on ultrasonography of axillary lymph nodes: the SOUND randomized clinical trial. JAMA Oncol 2023; 5 McKevitt E et al.: Sentinel node biopsy should not be routine in older patients with ER-positive HER2-negative breast cancer who are willing and able to take hormone therapy. Ann Surg Oncol 2021; 28(11): 5950-7 6 Boughey JC et al.: Alliance for Clinical Trials in Oncology. Sentinel lymph node surgery after neoadjuvant chemotherapy in patients with node-positive breast cancer: the ACOSOG Z1071 (Alliance) clinical trial. JAMA 2013; 310(14): 1455-61 7 Kuehn T et al.: Sentinel-lymph-node biopsy in patients with breast cancer before and after neoadjuvant chemotherapy (SENTINA): a prospective, multicentre cohort study. Lancet Oncol 2013; 14(7): 609-18 8 Boileau JF et al.: Sentinel node biopsy after neoadjuvant chemotherapy in biopsy-proven node-positive breast cancer: the SN FNAC study. J Clin Oncol 2015; 33(3): 258-64 9 Donker M, et al.: Marking axillary lymph nodes with radioactive iodine seeds for axillary staging after neoadjuvant systemic treatment in breast cancer patients: the MARI procedure. Ann Surg 2015; 261(2): 378-82
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...