Das chemische Milieu im Knochenmark und sein therapeutischer Nutzen
Autorinnen:
Prof. Dr. Daniela Krause
Direktorin
Universitätsmedizin
der Johannes-Gutenberg-Universität Mainz
Institut für Transfusionsmedizin – Transfusionszentrale
Raquel S. Pereira
Georg-Speyer-Haus, Institut für Tumorbiologie und Experimentelle Therapie, Frankfurt am Main
Korrespondenz:
Die Kalziumkonzentration im Knochenmarks-Mikromilieu (KMM) hat einen signifikanten Einfluss auf die Leukämie und beeinflusst über den kalziummessenden Rezeptor (CaSR) die Lokalisation von Zellen der akuten myeloischen Leukämie (AML) im KMM. CaSR ist ein entscheidender, hochdifferenziell agierender und therapeutisch angreifbarer Faktor bei der Leukämieprogression bei Mäusen und Menschen, indem er bei der AML die Selbsterneuerung von leukämischen Stammzellen (LSZ) über Kalzium-Signale aus dem KMM beeinflusst.
Keypoints
-
Kalziumionen bilden einen Gradienten im KMM.
-
Die Lokalisation von AML-Zellen innerhalb des KMM wird durch CaSR beeinflusst.
-
CaSR hat leukämiespezifische Auswirkungen auf das Fortschreiten der Erkrankung und reguliert die Selbsterneuerung von AML-LSZ.
-
Pharmakologische Beeinflussung von CaSR und seiner intrazellulären Signalübertragung könnte eine wirksame neue therapeutische Strategie darstellen.
In den letzten 20 Jahren wurden mehrere Studien über die Beschaffenheit der Mikroumgebung normaler hämatopoetischer Stammzellen (HSZ) und leukämischer Stammzellen (LSZ), nämlich das Knochenmarks-Mikromilieu (KMM), publiziert.
Das KMM ist eine komplexe Entität, die aus verschiedenen Zelltypen, der extrazellulären Matrix, löslichen und anderen Faktoren besteht. Dieses KMM beeinflusst die (Patho-)Physiologie normaler HSZ und LSZ und könnte ein therapeutisches Ziel bei Leukämie sein.1,2 Leukämiezellen sind in hohem Maße von diesem KMM abhängig, da die Interaktionen der Leukämiezellen mit den verschiedenen zellulären und azellulären Komponenten des KMM überlebensfördernde Mechanismen vermitteln und die Leukämiezellen vor Chemotherapien und zielgerichteten Therapieformen schützen.
Die Charakterisierung der Komponenten des KMM und die Identifizierung der Wechselwirkungen und Abhängigkeiten zwischen Leukämiezellen und ihrer Umgebung sind notwendig für mögliche innovative zielgerichtete Therapien. Die Modulation spezifischer Wechselwirkungen zwischen Leukämiezellen und ihrem KMM oder die Modulation des KMM selbst, um es für bösartige Zellen „unwirtlich“ zu machen und damit letztlich Leukämiestammzellen zu vernichten, sind neuartige und vielversprechende Strategien zur Ergänzung bestehender Therapien bei den Leukämien.3
Bisher wurde der Rolle chemischer Faktoren im leukämischen KMM, wie z.B. den Kalziumionen, die wichtige Bestandteile des KMM sind, relativ wenig Aufmerksamkeit gewidmet. Tatsächlich ist Kalzium der am häufigsten im Körper vorkommende Mineralstoff und ein wichtiger Bestandteil der Knochen. Es wird durch den (durch parathyroidales Hormon [PTH] induzierten) Knochenumbau freigesetzt. Kalziumionen spielen über den kalziummessenden Rezeptor (CaSR), einen G-Protein-gekoppelten Rezeptor, eine Rolle bei der Lokalisation, der Anhaftung an Proteine der extrazellulären Matrix (EZM) und der Einnistung normaler HSZ im KMM, wodurch eine normale Hämatopoese aufrechterhalten wird.4,5
Darüber hinaus wurde CaSR mit der Entwicklung verschiedener Krebsarten in Verbindung gebracht, wobei der Rezeptor je nach betroffenem Gewebe entweder als Tumorsuppressor oder als Onkogen fungiert.6 Die Rolle von CaSR und der damit verbundenen Signalwege in Leukämiezellen im lokalen KMM für die Krankheitsentwicklung war bisher jedoch nicht bekannt.
CaSR beeinflusst die Lokalisation von Leukämiezellen im KMM
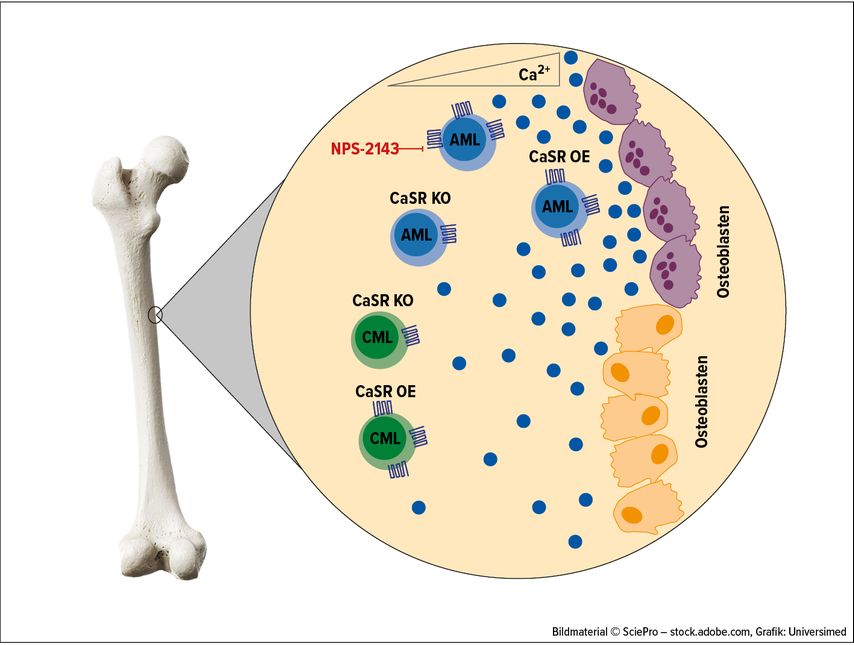
In unserem Artikel (Pereira RS et al.: Nat Comm 2023)7 haben wir gezeigt, dass Kalziumionen nicht gleichmäßig im KMM verteilt sind, sondern einen Gradienten mit höchsten Kalziumkonzentrationen in der Nähe des Endosteums bilden. Tatsächlich haben Kalziumionen sehr spezifische Auswirkungen auf Leukämiezellen, denn CaSR beeinflusst die Lage von Zellen der akuten myeloischen Leukämie (AML), die durch das Onkoprotein MLL-AF9 charakterisiert ist, nicht aber die von Zellen der chronischen myeloischen Leukämie (CML) innerhalb des KMM (Abb. 1).
Abb. 1: Intravitalmikroskopische Untersuchungen zeigten, dass CaSR die Lokalisation von AML-Zellen im KMM regulieren kann, nicht aber die von CML. Die Deletion von CaSR in AML-Zellen (CaSR-Knockout [KO]) und die Inhibition von CaSR mit dem Antagonisten NPS-2143 führen zu einer Lokalisation von AML-Zellen weiter weg vom endostalen Bereich. CaSR-überexprimierende Zellen („CaSR overexpression“ [OE]) hingegen sind näher am Endosteum lokalisiert. Bei CML-Zellen wurde keine Auswirkung auf die Lokalisation im KMM beobachtet.
CaSR reguliert die Pathogenese von Leukämien auf hochspezifische Weise
Wir beobachteten, dass der Kalziumgehalt im KMM bei der AML höher ist als bei anderen Leukämien. Ferner hat Kalziumexposition einen signifikanten Einfluss auf die Adhäsion, Migration, den intrazellulären Kalziumgehalt und die Expression von CaSR und den C-X-C-Chemokinrezeptor Typ 4 (CXCR4) auf AML-Zellen, während sie auf CML-Zellen keine Auswirkungen hat.
Darüber hinaus wird CaSR bei verschiedenen Leukämiearten unterschiedlich stark exprimiert, wobei die höchste Expression bei AML-Zellen vorliegt. Mithilfe von Mausmodellen, in denen leukämieinduzierende Zellen in gesunde Empfänger transplantiert wurden, konnten wir zeigen, dass CaSR eine höchst spezifische Rolle bei der Entwicklung der CML, der BCR-ABL1-assoziierten akuten lymphoblastischen B-Zell-Leukämie (B-ALL) und der MLL-AF9- oder MN1-assoziierten AML spielt. Insbesondere führt Defizienz von CaSR auf B-ALL- oder CML-initiierenden Zellen zu einer Beschleunigung der Krankheit, während dies bei AML zu einer Verlängerung des Krankheitsverlaufes führt.
Umgekehrt führt eine Überexpression von CaSR auf CML-initiierenden Zellen zu einer Krankheitsverlängerung, während dies bei der AML mit einer Beschleunigung der Krankheit assoziiert ist. Sekundäre Transplantationsverfahren und Transplantationen von CaSR-defizienten AML-initiierenden Zellen in Grenzverdünnung zur Beurteilung zeigten, dass CaSR für die Selbsterneuerungsfähigkeit von LSZ bei AML notwendig ist.
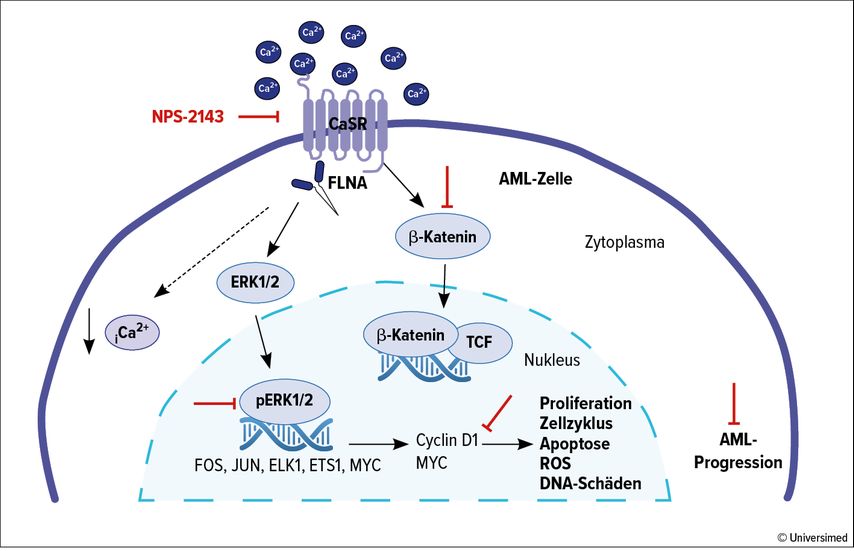
Bei der mit dem Onkoprotein MLL-AF9 assoziierten AML wurde gezeigt, dass CaSR die Proliferation, den Zellzyklus, die Apoptose, die Bildung reaktiver Sauerstoffspezies (ROS), die Differenzierung und DNA-Schäden in AML-Zellen beeinflusst. Auf molekularer Ebene interagiert CaSR mit Filamin A, welches Aktinfilamente miteinander vernetzt. Ferner moduliert CaSR die MAPK-ERK- und Wnt-β-Catenin-abhängige Signalgebung sowie den intrazellulären Kalziumspiegel in AML-Zellen.
Die Überexpression von CaSR führt zu einem höheren pERK/ERK-Verhältnis und höheren β-Catenin-, MYC- und Cyclin-D1-Spiegeln. Im Gegensatz dazu beobachteten wir eine Herabregulierung dieser Proteine, wenn CaSR defizient war (Abb. 2).
Abb. 2: CaSR aktiviert die MAPK-Signaltransduktionskaskade durch Phosphorylierung von ERK1/2, das in den Zellkern wandert und als Transkriptionsfaktor fungiert. CaSR stimuliert auch den Wnt/β-Catenin-Signaltransduktionsweg, indem es β-Catenin stabilisiert, dessen Akkumulation unterstützt und in den Zellkern verlagert. Im Zellkern bildet β-Catenin einen Komplex mit TCF, was zu einer Transkriptionsregulation führt. Die Aktivierung von MAPK und Wnt/β-Catenin-Signalen führt zur Hochregulierung von c-Myc und Cyclin D1, was zu einer verstärkten Proliferation, Zellzyklusprogression, ROS-Produktion und Anhäufung von DNA-Schäden sowie zu einer Inhibition der Apoptose führt. Infolgedessen tragen diese Prozesse zur Progression der AML bei. Der spezifische CaSR-Antagonist NPS-2143, dargestellt durch die roten Linien, kann die CaSR-Signalübertragung in verschiedenen Schritten blockieren und so die AML-Progression hemmen.
Möglicher therapeutischer Nutzen
Die Inhibition von CaSR mit dem spezifischen Antagonisten NPS-2143 in Kombination mit Standardchemotherapie in vivo reduzierte die Tumorlast und verlängerte das Überleben von Mäusen mit AML in syngenen und xenogenen Modellen effizienter als die Chemotherapie allein. Dies deutet darauf hin, dass eine Kombinationsbehandlung aus herkömmlicher Chemotherapie und CaSR-Inhibition das klinische Ergebnis bei AML-Patient:innen verbessern könnte.
Schlussfolgerung
Zusammengenommen deuten diese Ergebnisse darauf hin, dass CaSR und möglicherweise auch Kalziumionen aus dem KMM einen hochspezifischen Einfluss auf die verschiedenen Leukämiezellen haben und das Fortschreiten einer Leukämie beeinflussen.
Unsere Daten lassen die Hoffnung zu, dass gezielte Beeinflussung der CaSR-Signalübertragung ein neues Mittel im Arsenal der Leukämiebehandlung sein könnte, das mit konventionellen therapeutischen Strategien kombiniert werden kann.
Literatur:
1 Krause DS et al.: Differential regulation of myeloid leukemias by the bone marrow microenvironment. Nat Med 2013; 19(11): 1513-7 2 Méndez-Ferrer S et al.: Bone marrow niches in haematological malignancies. Nat Rev Cancer 2020; 20(5): 285-98 3 Krause DS, Scadden DT: A hostel for the hostile: the bone marrow niche in hematologic neoplasms. Haematologica 2015; 100(11): 1376-87 4 Adams GB et al.: Stem cell engraftment at the endosteal niche is specified by the calcium-sensing receptor. Nature 2006; 439(7076): 599-603 5 Lam BS et al.: Pharmacologic modulation of the calcium-sensing receptor enhances hematopoietic stem cell lodgment in the adult bone marrow. Blood 2011; 117(4): 1167-75 6 Tennakoon S et al.: The calcium-sensing receptor and the hallmarks of cancer. Biochim Biophys Acta 2016; 1863(6 Pt B): 1398-407 7 Pereira RS et al.: Distinct and targetable role of calcium-sensing receptor in leukaemia. Nat Commun 2023; 14(1): 6242
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...