Metastasiertes tripelnegatives Mammakarzinom: Immuntherapie immer und für alle?
Autor:
Priv.-Doz. DDr. Christoph Suppan
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin
LKH – Univ.-Klinikum Graz
E-Mail: christoph.suppan@medunigraz.at
Checkpoint-Inhibitoren gehören inzwischen zum Standard in der Behandlung des metastasierten tripelnegativen Mammakarzinoms (MTNMK). Laut bisherigen Phase-III-Studien beschränkt sich der Benefit durch diese Substanzklasse aber auf etwa 40% der Patient:innen – dienigen, deren Tumoren PD-L1-Positivität aufweisen. Ziel ist es nun, die Wirksamkeit der Immuntherapie auf alle Patient:innen auszudehnen und damit ein längeres Überleben zu ermöglichen.
Keypoints
-
Derzeit können wir bei positivem PD-L1-Status zwischen Atezolizumab und Pembrolizumab in der Erstlinie wählen.
-
Die Wahl der Chemotherapie ist an den jeweiligen Checkpoint-Inhibitor basierend auf den Phase-III-Studien gebunden.
-
Insbesondere die Kombination zwischen Antikörper-Wirkstoff-Konjugaten und Checkpoint-Inhibitoren gibt Hoffnung auf eine verbesserte Wirksamkeit, auch in der PD-L1-negativen Patient:innenpopulation.
Heterogenität
Die Heterogenität des MTNMK zeigt sich histologisch mit den unterschiedlichen Subtypen, auf molekularer Ebene mit den intrinsischen Subtypen, aber auch immunologisch anhand der unterschiedlichen Anzahl tumorinfiltrierender Lymphozyten (TIL).1,2 Wir finden hier unterschiedliche immunogene Zellen, was sich im unterschiedlichen Therapieansprechen widerspiegelt, und im Vergleich zu anderen Tumoren eine niedrigere Frequenz an somatischen Mutationen.3
Im Ökosystem des MTNMK unterscheiden sich die Krebszellen durch intrinsische und extrinsische Faktoren. Unterschiede im Genom mit den verschiedenen Genmutationen, im Transkriptom durch verschiedene mRNA-basierte Typisierungen und im Proteom mit der Expression von Proteinen wie TROP-2, HER2/3 oder PD-L1 zählen zu den intrinsischen Faktoren. Die Zellen des Tumormikromilieus, wie etwa stromale TIL, CD8+-T-Lymphozyten und diverse Immunsignaturen, zählen zu den extrinsischen Faktoren und bestimmen den Effekt einer Immuntherapie.4
Wirksamkeit der Immuntherapie
Im Gegensatz zum frühen Mammakarzinom beschränkt sich derzeit die Wirksamkeit der Immuntherapie auf die PD-L1-positive Population. Gründe dafür sind, dass die Immunogenität im Laufe der Erkrankung abnimmt und es molekulare Unterschiede zwischen Primärtumoren und Metastasen gibt. Die Levels der Immunaktivierung können sogar innerhalb der Metastasen unterschiedlich sein.5
Die KEYNOTE-119-Studie hat die Wirksamkeit von Pembrolizumab gegenüber einer Standardchemotherapie im metastasierten Setting bei mit ein oder zwei Therapielinien vorbehandelten Patient:innen untersucht. Hier zeigte sich keine signifikante Überlegenheit gegenüber der Chemotherapie unabhängig vom PD-L1-Status.6 Durch die Kombination mit Chemotherapie erhoffte man sich im nächsten Schritt eine Verbesserung der Wirksamkeit und eine Erhöhung der PD-L1-Sensitivität.7
In der Phase-III-Studie IMpassion-130 verlängerte Atezolizumab+nab-Paclitaxel gegenüber Placebo+nab-Paclitaxel das Gesamtüberleben von 17,9 auf 25,4 Monate (HR: 0,67) bei einer PD-L1-Positivität auf den Immunzellen von ≥1%. In der ITT-Population war der Unterschied nicht signifikant.8 Die Studie IMpassion-131 verwendete Paclitaxel statt nab-Paclitaxel als Kombinationspartner für Atezolizumab und zeigte keinen signifikanten Unterschied. Als mögliche Gründe hierfür werden beispielsweise die notwendige Kortisonbehandlung oder Unterschiede zwischen den Substanzen bezogen auf ihre Immunogenität diskutiert.9
Auch Pembrolizumab wurde in der Phase-III-Studie KEYNOTE-355 mit Chemotherapie (Paclitaxel, nab-Paclitaxel oder Carboplatin/Gemcitabin) kombiniert und zeigte einen signifikanten Vorteil im Gesamtüberleben gegenüber alleiniger Chemotherapie (HR: 0,73) bei einem „combinded positive score“ (CPS)≥10. Insbesondere therapienaive Patient:innen oder jene mit einem krankheitsfreien Intervall von zumindest zwölf Monaten profitierten, ein Taxan erwies sich als der präferierte Kombinationspartner.10
„Neue“ Kombinationen
Auch Anthrazykline werden immer wieder als immunmodulatorische Substanzen untersucht und insbesondere im neoadjuvanten Setting mit Immuntherapie kombiniert. Die Phase-IIb-Studie ALICE hat die Kombination von liposomalem pegyliertem Anthrazyklin und kontinuierlichem Cyclophosphamid+/–Atezolizumab bei Patient:innen untersucht, die maximal eine Chemotherapie im metastasierten Setting erhalten haben. Hier zeigte sich auch in einer kleinen Subgruppe der PD-L1-negativen Population ein signifikanter Benefit durch die Hinzugabe von Atezolizumab.11
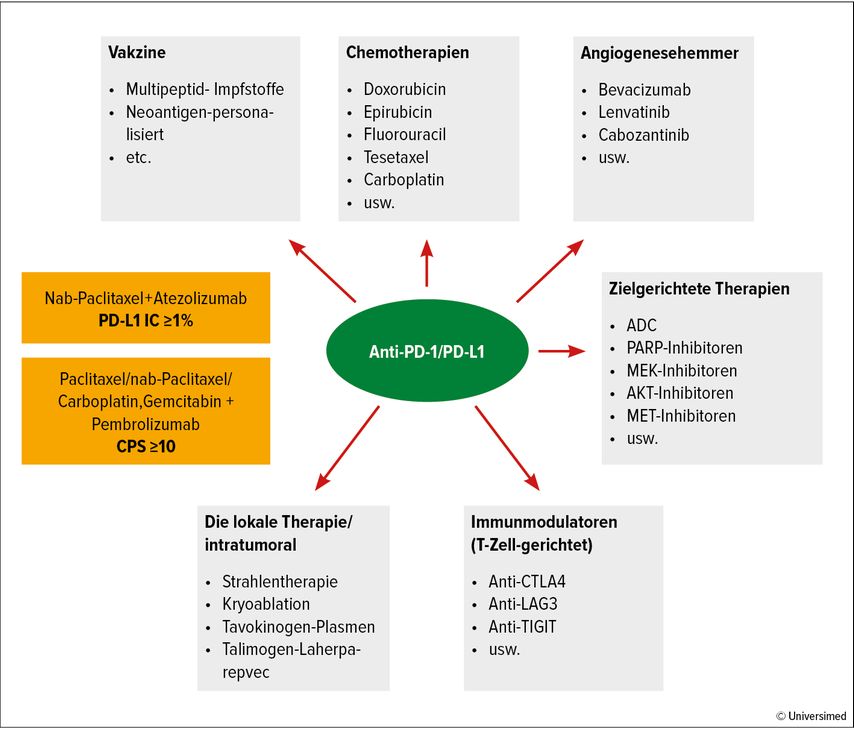
Über einen weiteren positiven Effekt, der unabhängig vom PD-L1-Status war, konnten wir letztes Jahr im Rahmen der Präsentation der BEGONIA-Studie erfahren: Frühe Daten zeigten für die Kombination des Antikörper-Wirkstoffkonjugats Datopotamab Deruxtecan mit dem Checkpointinhibitor Durvalumab sehr vielversprechende Ergebnisse in der Erstlinie.12 Wir erwarten in den nächsten Jahren eine Vielzahl an neuen Studien, in denen Immuntherapie mit unterschiedlichsten Substanzen wie Chemotherapie, ADC, zielgerichteten Substanzen, Vakzinen oder Lokalbehandlungen kombiniert wird (Abb.1).
Ein bahnbrechender Erfolg beim Melanom wurde heuer bereits mit einer Kombination aus einem mRNA-Vakzin und Pembrolizumab berichtet. Basierend auf den jeweiligen Tumoren der Patient:innen wurden mRNA-Vakzine, codierend für bis zu 34 Neoantigene, hergestellt und adjuvant verabreicht. Die Kombination mit Pembrolizumab konnte so das Rückfallsrisiko um 44% senken.13 Ob sich diese Strategie auch auf andere Tumorentitäten wie das MTNMK übertragen lässt, ist jedenfalls zu hoffen.
Bei all der Euphorie um die Anwendung von Immuntherapie dürfen wir aber auch das Thema der Toxizitäten nicht vernachlässigen. Insbesondere Hypophysitis, Schilddrüsenfunktionsstörung oder Nebenniereninsuffizienz können mit sehr hoher Wahrscheinlichkeit chronisch bleiben und damit die Lebensqualität mancher Patient:innen negativ beeinflussen.14
Auch wenn sich die Anwendung der Immuntherapie derzeit noch auf eine kleinere Patient:innenpopulation mit MTNMK beschränkt, geben neue Substanzen und Kombinationsstrategien Hoffnung auf baldige Änderungen in der Therapielandschaft, von denen unsere Patient:innen weiter profitieren werden.
Literatur:
1 Chen DS, Mellman I: Elements of cancer immunity and the cancer-immune set point. Nature 2017; 541(7637): 321-30 2 Bianchini G et al.: Triple-negative breast cancer: challenges and opportunities of a heterogeneous disease. Nat Rev Clin Oncol 2016; 13(11): 674-90 3 Lawrence MS et al.: Mutational heterogeneity in cancer and the search for new cancer-associated genes. Nature 2013; 499(7457): 214-8 4 Bianchini G et al.: Treatment landscape of tripelnegative breast cancer - expanded options, evolving needs. Nat Rev Clin Oncol 2022; 19(2): 91-113 5 Garcia-Recio S et al.: Multiomics in primary and metastatic breast tumors from the AURORA US network finds microenvironment and epigenetic drivers of metastasis. Nat Cancer 2023; 4(1): 128-47 6 Winer EP et al.: Pembrolizumab versus investigator-choice chemotherapy for metastatic tripelnegative breast cancer (KEYNOTE-119): arandomised, open-label, phase 3 trial. Lancet Oncol 2021; 22(4): 499-511 7 Bailly C et al.: Combined cytotoxic chemotherapy and immunotherapy of cancer: modern times. NAR Cancer 2020; 2(1): zcaa002 8 Emens LA et al.: First-line atezolizumab plus nab-paclitaxel for unresectable, locally advanced, or metastatic tripelnegative breast cancer: IMpassion130 final overall survival analysis. Ann Oncol 2021; 32(8): 983-93 9 Miles D et al.: Primary results from IMpassion131, a double-blind, placebo-controlled, randomised phase III trial of first-line paclitaxel with or without atezolizumab for unresectable locally advanced/metastatic tripelnegative breast cancer. Ann Oncol 2021; 32(8): 994-1004 10 Cortes J et al.: Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic tripelnegative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet 2020; 396(10265): 1817-28 11 Røssevold AH et al.: Atezolizumab plus anthracycline-based chemotherapy in metastatic tripelnegative breast cancer: the randomized, double-blind phase 2b ALICE trial. Nat Med 2022; 28(12): 2573-83 12 Schmid P et al.: 166MO Datopotamab deruxtecan (Dato-DXd) + durvalumab (D) as first-line (1L) treatment for unresectable locally advanced/metastatic tripelnegative breast cancer (a/mTNBC): Initial results from BEGONIA, a phase Ib/II study. Ann Oncol 2022; 33: S199 13 Khattak A et al.: Abstract CT001: A personalized cancer vaccine, mRNA-4157, combined with pembrolizumab versus pembrolizumab in patients with resected high-risk melanoma: efficacy and safety results from the randomized, open-label Phase 2 mRNA-4157-P201/Keynote-942 trial. Cancer Research 2023; 83(Suppl. 8):CT001-CT 14 Johnson DB et al.: Immune-checkpoint inhibitors: long-term implications of toxicity. Nat Rev Clin Oncol 2022; 19(4): 254-67
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...