MDS-Update vom ASH 2022
Autor:
OA Univ.-Prof. Dr. Michael Pfeilstöcker, MBA
3. Medizinische Abteilung
Hanusch-KH, Wien
E-Mail: michael.pfeilstoecker@oegk.at
Wie jedes Jahr bot der ASH-Kongress in New Orleans aktuelle Informationen zu myelodysplastischen Syndromen. Das hybride Format ermöglichte rege Diskussionen und einen vertiefteren Gedankenaustausch. Neben rezenten Daten zu therapeutischen Optionen, etwa dem neuen Checkpoint-Inhibitor Sabatolimab, wurden auch die neuen Klassifikationen und Prognoseinstrumente diskutiert.
Neue Klassifikationen und Prognosesysteme
Zur Verbesserung der Klassifikation von myelodysplastischen Syndromen (MDS) liegen von der WHO und der „International Consensus Classification“ (ICC) 2022 veröffentlichte Vorschläge vor, die sich zum Teil überlappen, aber auch Unterschiede aufweisen. Das IPSS-M(„molecular international prognosis scoring system“)-Prognoseinstrument ist das mittlerweile dritte publizierte Tool zum Thema Einschluss molekularer Daten in die Prognoseabschätzung. Diese Modelle standen beim ASH-Meeting auf dem Prüfstand. Validierungskohorten wurden unter anderem vom Moffitt Cancer Center (Florida, USA), Münchner Leukämielabor (MLL) und der europäischen Initiative GenoMed4All präsentiert.
Zur Klassifikation bestätigten Daten des Moffitt Cancer Center (n=2231) die genetisch definierten Entitäten MDS mit SF3B1-Mutation, mit Deletion 5q und mit biallelischer TP53-Alteration (bi-TP53). Ein Cut-off-Wert von 5% für Blasten korreliert besser mit dem Outcome als ein solcher von 10%. MDS-F (mit Fibrose) lässt sich als Entität bestätigen. Vorgeschlagen wird eine alternative Definition des bi-TP53 durch VAF (Varianten-Allel-Frequenz) >50% oder zwei TP53-Mutationen oder eine Mutation in Kombination mit isolierter Dele-tion 17 oder komplexem Karyotyp. Zum IPSS-M bestätigen alle Kohorten die nominell höhere Vorhersagekraft im Vergleich zum IPSS-R mit einem Upgrading vieler Patienten in Richtung schlechterer Prognose. Bezüglich fehlender Daten zur Berechnung des IPSS-M wird ein „Core-Mutationsset“ (15 Gene) vorgeschlagen, mit dem eine 80%ige Genauigkeit erreicht werden kann.
Eine Weiterentwicklung stellt die Evaluierung der 735 MLL-Patienten dar. Aus einer Clusteranalyse schlagen die Autoren eine Hierarchie von neun biologisch definierten Entitäten mit prognostischer Bedeutung vor, unabhängig von der Knochenmarks-Blastenzahl:
-
biallelische TP53-Inaktivierung
-
komplexer Karyotyp
-
RUNX1-Mutation
-
ASXL1-Mutation
-
del(5q)
-
SF3B1-Mutation
-
Mutationen in DNMT3A, TET2, U2AF1, SRSF2 und/oder ZRSR2
-
Mutation in zumindest einem anderen von 21 rekurrent bei MDS mutierten Genen
-
keine der angeführten Veränderungen
Eine Verbesserung von Klassifikation und Prognoseinstrumenten ist – falls klinisch relevant – sicher zu begrüßen. Das gleichzeitige Bestehen verschiedener Klassifikationen und Prognosesysteme ist für die Praxis und für klinische Studien problematisch und von allen Diskutanten wurde erhofft, dass ein Konsens gefunden werden könne. Bis dahin müssen möglichst alle relevanten Parameter erhoben werden – die Evaluierung einzelner Patienten bleibt individuell. Generell werden mehr Patienten mit höherem Risiko identifiziert, die vermutlich einer intensiveren Behandlung zugeführt werden. Der Vorteil einer entsprechenden Strategie bleibt derzeit offen und müsste erst in klinischen Studien gezeigt werden. Prinzipiell sind brauchbare Klassifikationen, die klinische Entitäten mit therapeutischer Konsequenz definieren, wichtiger als Prognose-Scores für heterogene Krankheitsgruppen.
Viele spannende Daten zumNiedrigrisiko-MDS
Weiterhin steht die Behandlung der transfusionsbedürftigen Anämie mit dem Ziel der Transfusionsunabhängigkeit im Fokus der Bemühungen bei Patienten mit Niedrigrisiko-MDS.
Luspatercept im Real-World-Setting
Luspatercept ist als erster Ausreifungsaktivator zur Behandlung transfusionsbedürftiger Niedrigrisiko-MDS-Patienten mit Ringsideroblasten nach Versagen Erythropoese-stimulierender Agenzien (ESA) zugelassen. Am ASH-Kongress wurden US-amerikanische Real-World-Daten zur Anwendung in der täglichen Praxis präsentiert.
Die retrospektive Kohortenstudie schloss insgesamt 253 Patienten ein, die Luspatercept mindestens 3 Monate erhalten hatten und mindestens 3 Monate nachbeobachtet wurden. Nach einer ersten Analyse mit 76 Patienten hatten 29,0% der Patienten die Luspatercept-Therapie während dieser Zeit abgebrochen (Toxizität war kein Abbruchgrund, 45,5% der Abbrecher waren progredient). Auffällig in dieser Kohorte war, dass 54,5% noch mit der Startdosis behandelt wurden. Zur Effizienz zeigte die Endauswertung mit 253 Patienten bei niedriger Transfusionslast eine Transfusionsunabhängigkeit über 24 Wochen von 90%, bei moderater Transfusionslast eine von 58%. Somit werden die Studienergebnisse – hohe Effizienz und niedrige Toxizität – im Real-World-Setting bestätigt.
Zusätzlich wurden in einer Posterpräsentation erste Daten zum Überleben unter Luspatercept aus den Zulassungsstudien präsentiert. Da diese nicht für eine entsprechende Auswertung gepowert waren und die Beobachtungsdauer noch zu kurz ist (für solche Analysen wären Jahre zu veranschlagen), sind die Ergebnisse nicht signifikant. Sie zeigen aber einen deutlichen Trend: Das mediane Gesamtüberleben (OS) im Luspatercept-Arm wurde nicht erreicht und betrug im Placebo-Arm 58,3 Monate (p=0,8694). Responder (sowohl unter Luspatercept als auch mit Placebo) lebten signifikant länger als Non-Responder.
Niedrig dosiertes Lenalidomid – späterer Transfusionsbedarf?
Lenalidomid ist für transfusionsbedürftige ESA-refraktäre Patienten mit del(5)(q)-Syndrom zugelassen. Die Sintra-Rev-Studie untersuchte nunmehr, ob eine niedrig dosierte Lenalidomidtherapie (5mg täglich) bei noch nicht transfusionsbedürftigen Patienten mit del(5)(q) den Beginn eines Transfusionsbedarfs verzögern kann.
In einer Phase-III-Studie erhielten daher 54 Patienten Lenalidomid oder Placebo über 2 Jahre (median 66 Wochen). Die Zeit bis zur Transfusion war signifikant verlängert (66,3 M. vs. 11,6 M.). 80% der Patienten unter Lenalidomid erzielten zusätzlich eine zytogenetische Response. OS und AML(akute myeloische Leukämie)-Transformation waren nicht unterschiedlich, ebenso die Rate an unerwünschten Ereignissen (AE), allerdings waren diese im Lenalidomidarm häufiger Substanz- bezogen. Niedrig dosiertes Lenalidomid kann daher den Beginn der Transfusionsbedürftigkeit bei del(5)(q)-Patienten hinauszögern. Der Preis ist die längere Expositionsdauer gegenüber Lenalidomid, Langzeitdaten fehlen derzeit naturgemäß noch.
Imetelstat als Möglichkeit für transfusionsbedürftige Patienten
Der Telomeraseinhibitor Imetelstat wird für transfusionsbedürftige MDS-Patienten entwickelt. Günstiges Ansprechen wurde für Non-del(5)(q)- und HMA(hypomethylierende Substanzen)-naive Patienten berichtet. Im Rahmen der Phase-II-Studie IMerge erhielten 38 solche Patienten alle 4Wochen Imetelstat-Infusionen.
29% erreichten Transfusionsunabhängigkeit (TI) >1 Jahr (entspricht 69% der ≥8-Wochen-Responder). 27 Patienten hatten MDS-RS (Ringsideroblasten), von diesen erzielten 37% TI >1 Jahr. Bei SF3B1-mutierten Patienten erzielte mehr als die Hälfte eine ≥50% VAF-Reduktion, die mit längerer TI-Dauer und rascherem Ansprechen korrelierte. AE waren vergleichbar mit denen der Gesamtstudienpopulation, insbesondere die bekannte reversible Thrombozytopenie und Neutropenie.
Imetelstat kristalliert sich daher als Option für transfusionsbedürftige Patienten heraus. Einzelne Subgruppen (MDS-RS, SF3B1-mutiert), die derzeit evaluiert werden, dürften von besonders langen Ansprechzeiten profitieren.
MDS mit höherem Risiko: erste Ergebnisse zu Sabatolimab Phase II
Sabatolimab (MBG453) als neuer Checkpoint-Inhibitor (Target: TIM-3) wird in Kombination mit hypomethylierenden Substanzen untersucht. Beim ASH-Kongress wurden die ersten Daten der Stimulus-MDS1-Studie präsentiert, einer randomisierten placebokontrollierten Phase-II-Studie bei 127 Patienten mit intermediärem oder hohem Risiko. Sabatolimab oder Placebo wurde an den Tagen 8 und 22 von 28-tägigen Zyklen verabreicht, Azacytidin (bei 89% der Patienten) oder Decitabin (bei 11%) nach Standard-Protokoll.
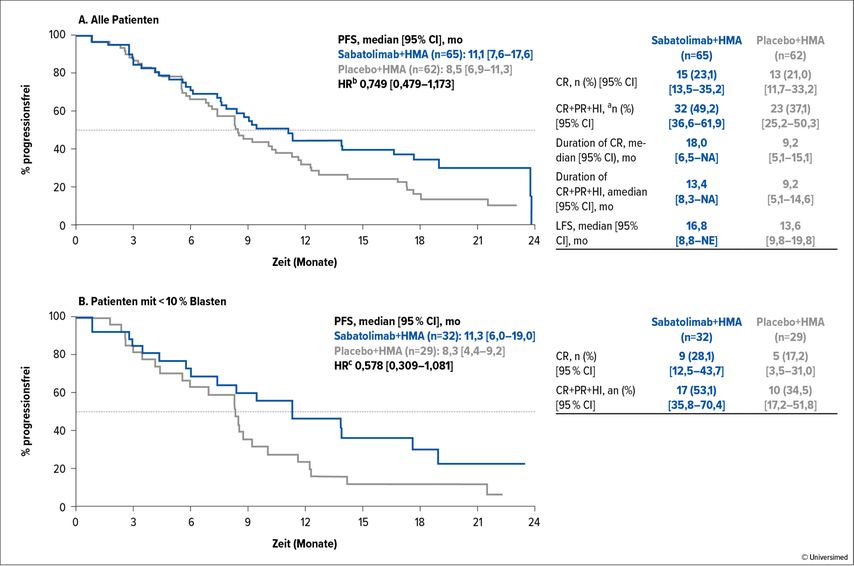
Bei den primären Endpunkten progressionsfreies Überleben (PFS; 11,1 vs. 8,5 Monate, Abb. 1A) und Komplettremissions(CR)-Rate (21,5% vs. 17,7% – upgedatet bei der Primäranalyse 23,1% vs. 21,0%) fanden sich keine signifikanten Unterschiede. In der Kaplan-Meier-Kurve gab es Hinweise auf verzögerte Effekte – möglicherweise wie bei anderen Checkpoint-Inhibitoren. Weiters war in der Subgruppe der Patienten mit unter 10% Blasten ein Vorteil im PFS (Abb. 1B) und der CR-Rate zu verzeichnen. Die Hämatotoxizität war nicht unterschiedlich, eine schwere Pneumonitis als Immunereignis wurde im Sabatolimab-Arm verzeichnet.
Abb. 1: Kaplan-Meier-Plot des PFS + Tabelle der Endpunkte für (A) alle Patienten und (B) Patienten mit <10% BM-Blasten unter Sabatolimab+HMA vs. Placebo+HMA. a Beeinhaltet Mark-CR mit HI und stabile Erkrankung mit HI. b Berechnet mit Cox-Model ll, stratifiziert mit dem Revised International Prognostic Scoring System. c Berechnet mit unstratifiziertem Cox-Model ll. HI, hämatologische Verbesserung; HR, Hazard-Ratio; LFS, Leukämie-freies Überleben; NA, „not available“; NE, „not estimable“; PR, partielle Remission. Modifiziert nach Zeidan AM et al., ASH 2022, Abstr. #853
Auch wenn die primären Endpunkte der Studie nicht erreicht wurden, bleibt die gut verträgliche Substanz von Interesse. Vorgestellte Daten suggerieren einen Vorteil bei geringerem Risiko und längerer Beobachtungsdauer. Die Folgestudie Stimulus-MDS2 mit dem primären Endpunkt OS hat bereits fertig rekrutiert und wird uns weitere Informationen bieten.
Ausblick
Neben den genannten Studien wurde beim ASH-Kongress eine Vielzahl von neuen Substanzen in präklinischen und Phase-I-Studien präsentiert, deren klinisches Potenzial noch ungewiss ist. Ob für Hochrisiko-MDS die Azacytidin-Monotherapie als bisheriger Standard abgelöst werden kann, werden fertig rekrutierte Phase-III-Studien mit diversen Kombinationspartnern wie Venetoclax, Magrolimab oder Sabatolimab in naher Zukunft zeigen. Deren Ergebnisse waren beim ASH-Kongress 2022 noch nicht verfügbar.
Literatur:
beim Verfasser
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...