mCRC, HCC, CCC: Chirurgie und neoadjuvante Konzepte
Autoren:
Prim. Univ.-Prof. Dr. Thomas Grünberger
Abteilungsvorstand
Abteilung für Chirurgie und HPB-Zentrum
Klinik Favoriten
Gesundheitsverbund Wien
E-Mail: tgruenberger@icloud.com
Dr. Yawen Dong
Abteilung für Chirurgie und HPB-Zentrum
Klinik Favoriten
Gesundheitsverbund Wien
E-Mail: yawen.dong@gesundheitsverbund.at
Wie auch in den vergangenen Jahren konnte sich die onkologisch interessierte Welt beim Jahrestreffen der American Society of Clinical Oncology (ASCO) 2022 wieder an neuen Erkenntnissen und zum Teil an Ergebnissen, die den klinischen Alltag verändern werden, erfreuen. In dieser Zusammenfassung beschränken wir uns auf die Highlights der Abstracts, die sich mit der chirurgischen Behandlung des Leber-metastasierten Kolorektalkarzinoms (mCRC) beschäftigt haben, und solche, die potenziell zu einem geänderten Vorgehen beim hepatozellulären Karzinom (HCC) bzw. beim cholangiozellulären Karzinom (CCC) führen könnten.
Die Chirurgie von Lebermetastasen wird zunehmend differenzierter und spezialisierter. Diese Entwicklung basiert auf anderen biologischen Parametern als lediglich auf Anzahl und Größe der Metastasen. Die sich auch heuer in aller Munde befindende Immuntherapie hat beim mCRC lediglich beim Patienten mit Mikrosatelliten-Instabilität (MSI) einen Stellenwert. Dort ist sie allerdings eindrucksvoll bestätigt. So hat sie z.B. beim Patienten mit MSI-Rektalkarzinom, beim HCC und CCC eine große Zukunftsperspektive.
CAIRO-5: Evaluation durch Expertenpanel
Eine erste Auswertung der wichtigen CAIRO-5-Studie, die den primären Zugang zu Patienten mit potenziell sekundär resektablem Leber-metastasiertem CRC definieren soll, liegt vor.1 In dieser Auswertung wurde über die Effektivität von Doublet- vs. Tripeltherapie plus Bevacizumab bei Patienten mit RAS- oder BRAF-mutiertem und/oder rechtsseitigem Kolonkarzinom berichtet.
Ein wesentlicher Unterschied zu den herkömmlich bekannten Studien ist die Tatsache, dass alle Patientenbilder, die das Ausmaß der Lebermetastasierung zeigten, vor Therapiebeginn von einem Expertenpanel der Leberchirurgie gemeinsam mit Gastrointestinalradiologen hinsichtlich der Resektabiliät begutachtet werden mussten. Das gleiche Panel urteilte nach definiertem Restaging nach zwei Monaten über potenziell erreichte sekundäre Resektabilität.
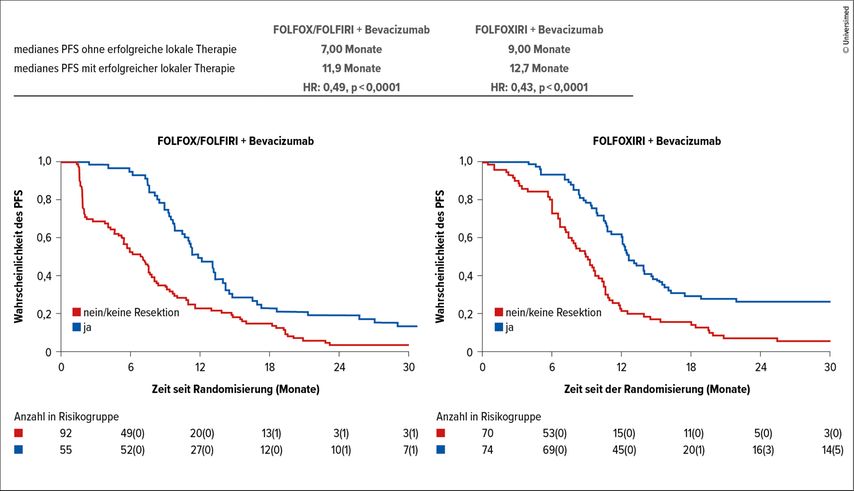
Nach einem medianen Follow-up von 41 Monaten wurde der primäre Endpunkt der Verlängerung des PFS in der Tripeltherapie-Gruppe signifikant erreicht: 10,6 vs. 9,0 Monate (HR: 0,77; 96% CI: 0,60–0,99; p=0,038). Auch die sekundären Endpunkte Gesamtansprechrate (ORR: 53,5% vs. 33,3%) und sekundäre R0/R1-Resektionsrate (51% vs. 37%) wurden in der FOLFOXIRI(Folinsäure, 5-Fluorouracil, Oxaliplatin, Irinotecan)+Bevacizumab-Gruppe mit Signifikanz erreicht (Abb. 1).
Abb. 1: Studie CAIRO-5: progressionsfreies Überleben (PFS) nach Therapiegruppe und Erzielen einer sekundären Resektabilität. Modifiziert nach 1
Bei dem neuen Ansatz mit Involvierung des Expertenpanels war die Tatsache besonders interessant, dass die Turnaround-Zeit bis zur Entscheidung lediglich sechs Tage betrug und somit erfreulich kurz war, die Übereinstimmung bei der Einschätzung der Resektabilität aber nur bei 66% lag.
Prognose nicht von Resektion abhängig
Lang erwartet sind Analyse und Bestätigung der vorhandenen Ergebnisse anderer Studien bzgl. der Sinnhaftigkeit, Patienten mit langfristig nicht resektablen Metastasen des Kolonkarzinoms zur potenziellen Verbesserung ihrer Prognose vom Primum zu befreien.2
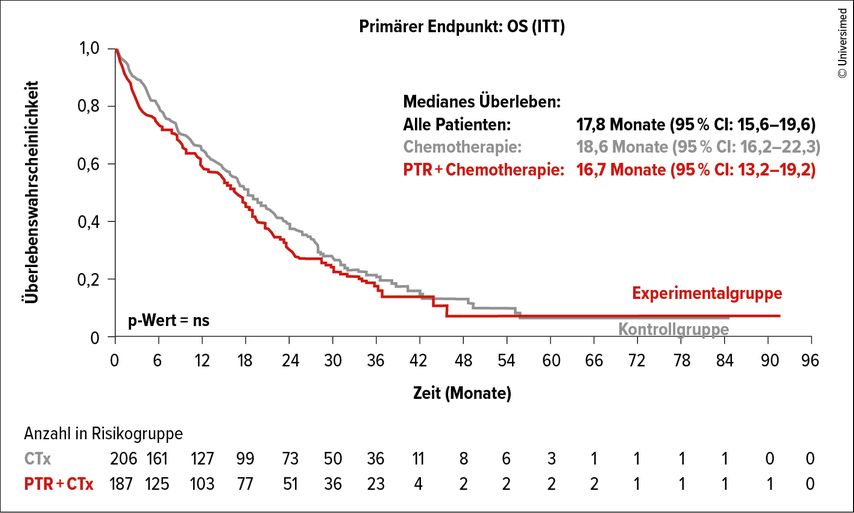
In einer deutsch-spanischen Studie konnte keine Verbesserung der Prognose durch Resektion des Primums gefunden werden (Abb. 2; Exklusion von Patienten mit Rektumkarzinom in dieser Studie). Es wurden 392 Patienten in hundert Studienzentren über zehn Jahre rekrutiert, von denen rund 60% nur ein Metastasen-tragendes Organ hatten (95% aller Patienten hatten nicht resektable Lebermetastasen). Interessant war die Tatsache, dass 24% der Primum-resezierten Patienten (vs. 6% in der Kontrollgruppe) nie eine Chemotherapie bekommen hatten und dass lediglich 9% in der nicht Primum-resezierten Gruppe im Laufe ihres Follow-ups eine Primum-bedingte Komplikation erlitten. Dieser Sachverhalt beeinflusste das Gesamtergebnis sicher wesentlich.
Abb. 2: Gesamtüberleben (OS) der Patienten in der SYNCHRONOUS-Studie. PTR, „Primary tumor resection“. Modifiziert nach 2
FOLFOX i.a.: ein Erfolg
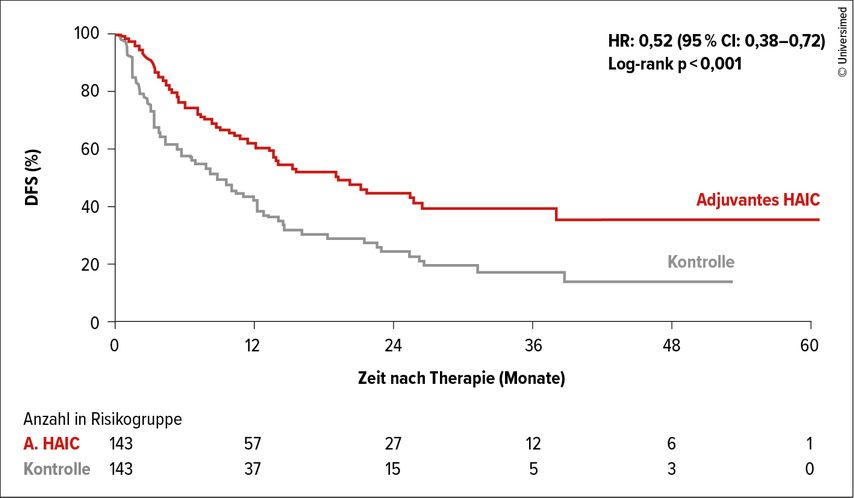
In einer chinesischen multizentrischen Phase-III-Studie wurden Patienten mit einer mikrovaskulären Tumorinvasion in der Präparathistologie entweder dem aktuellen Standard entsprechend nachgesorgt oder mittels adjuvanter transarterieller FOLFOX(Folinsäure, 5-Fluorouracil und Oxaliplatin)-Chemotherapie behandelt.3 Die intraarterielle (i.a.) Applikation war ident der intravenösen FOLFOX6-Dosierung. Der primäre Endpunkt krankheitsfreies Überleben (DFS) wurde sowohl in der ITT-Population (n=305) als auch in der nach Protokoll (PP) behandelten Gruppe (n=286) signifikant erreicht, was vor allem in Anbetracht der Tatsache, dass nur ein bis zwei Zyklen Chemotherapie gegeben wurden, beeindruckend ist (Abb. 3).
Abb. 3: Krankheitsfreies Überleben (DFS) bei intraarteriellem FOLFOX vs. Kontrolle. HAIC, „Hepatic arterial infusion chemotherapy“. Modifiziert nach 3
Das DFS in der PP-Population betrug 19,3 Monate in der FOLFOX-Gruppe vs. 8,9 Monate in der Kontrollgruppe (HR: 0,52; 95% CI: 0,38–0,72; p<0,001). Die 3-Jahres-OS-Raten für die PP-Patienten waren 80,9% in der Behandlungsgruppe vs. 72,9% in der Kontrollgruppe (p=0,067). Die Nebenwirkungen der intraarteriellen FOLFOX-Therapie waren überwiegend mild und es kam nicht zu letalen Komplikationen.
ICCA: präoperative Optionen
In einem präoperativen Setting wurde beim intrahepatischen Cholangiokarzinom (ICCA) in einer multizentrischen Studie eine Therapiekombination getestet, die in den USA in einer Phase-II-Studie bereits vielversprechende Daten erbracht hatte.4 Es wurden insgesamt 30 Patienten mit einem resektablen Hochrisiko-ICCA (definiert als: >5cm, multiple Tumoren, makrovaskuläre Invasion, Invasion regionaler Lymphknoten) mit vier Zyklen GAP (Gemcitabin 800mg/m2, Cisplatin 25mg/m2, nab-Paclitaxel 100mg/m2 Tag 1, 8; q21) vor einer kurativ intendierten Leberresektion über drei Monate hinweg behandelt. Bei 22 (73%) der inkludierten Patienten, die die vier präoperativen Zyklen erhielten, kam es zur Resektion. Zehn Patienten (33%) entwickelten eine Toxizität vom Grad 3–4, zumeist Neutropenie (17%) und Diarrhö (7%). Bei 50% musste die Dosis reduziert werden.
Radiologisch zeigten 23% ein partielles Ansprechen und 67% eine stabile Erkrankung. Geringe postoperative Komplikationen erlitten 9% der operierten Patienten; der mediane Spitalsaufenthalt war mit vier Tagen beeindruckend kurz. Die mediane Anzahl an Tumoren hingegen war mit 3,5 hoch. 32% der Patienten hatten schlecht differenzierte Tumoren, und bei median vier resezierten Lymphknoten waren 36% der Lymphknoten positiv.
Zusammenfassung: Take-Home-Message
Die Behandlung des mCRC wird deutlich individualisierter, sowohl im neoadjuvanten als auch im Induktionssetting. Auch im adjuvanten Algorithmus sollte die Therapiezusammensetzung unbedingt einer erweiterten Analyse von Patienten- und Tumorcharakteristika angepasst werden. Alte Behandlungssequenzen werden zunehmend aufgegeben und sind heute wesentlich von dem Stadium bei der Erstdiagnose und von spezifischer Molekulargenetik abhängig.
Mit den Daten der deutsch-spanischen Studie, die zeigt, dass bei nicht resektabler mCRC-Situation und asymptomatischen Patienten das Primum nicht chirurgisch behandelt werden muss, sondern ehebaldigst mit einer Systemtherapie begonnen werden sollte, ist die Frage der Resektion des Primums endgültig beantwortet.
Sehr erfreulich ist die Entwicklung der Behandlungsmöglichkeiten bei den primären Lebertumoren, wo neben den beeindruckenden Ergebnissen zur Immuntherapie auch andere Therapiezusammensetzungen gezeigt haben, dass sie das Überleben unserer Patienten deutlich verlängern können.
Einmal mehr ist die Diskussion jedes neu diagnostizierten Tumorpatienten in einem spezialisierten Meeting eines multidisziplinären Teams von vorrangiger Bedeutung, um eine auf Patienten- und Tumorcharakteristika abgestimmte ideale Therapieabfolge zu definieren. Wichtig bleibt zu erwähnen, dass diese initial diskutierten Patienten nach zwei Monaten mit einer aktualisierten Bildgebung neuerlich besprochen werden sollten.
Literatur:
1 Punt C et al.: FOLFOXIRI + bevacizumab versus FOLFOX/FOLFIRI + bevacizumab in patients with initially unresectable colorectal liver metastases (CRLM) and right-sided and/or RAS/BRAFV600E-mutated primary tumor: phase III CAIRO5 study of the Dutch Colorectal Cancer Group. JClin Oncol 2022; 40(Suppl 17): Abstr. #LBA3506 2 Rahbari N et al.: Randomized clinical trial on resection of the primary tumor versus no resection prior to systemic therapy in patients with colon cancer and synchronous unresectable metastases. J Clin Oncol 2022; 40(Suppl 17): Abstr. #LBA3507 3 Li S et al.: Postoperative adjuvant hepatic arterial infusion chemotherapy (HAIC) with FOLFOX to improve outcomes of patients with hepatocellular carcinoma with microvascular invasion: a prospective multicenter, phase 3, randomized controlled clinical trial. J Clin Oncol 2022; 40(Suppl 16): Abstr. #4013 4 Maithel SK et al.: NEO-GAP: a phase II single-arm prospective feasibility study of neoadjuvant gemcitabine/cisplatin/nab-paclitaxel for resectable high-risk intrahepatic cholangiocarcinoma. JClin Oncol 2022; 40(Suppl 16): Abstr. #4097
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...