Massgeschneiderte treffgenaue Therapie ist bei Hodentumoren State of the Art
Autoren:
Prof. Dr. med. Jörg Beyer1
Prof. Dr. med. Anja Lorch2
PD Dr. med. Christian Fankhauser3
PD Dr. med. Thomas Hermanns4
1Universitätsklinik für Medizinische Onkologie, Inselspital Bern
Universitätsklinik der Universität Bern
2Klinik für Medizinische Onkologie und Hämatologie, Universitätsspital Zürich
3Klinik für Urologie, Luzerner Kantonsspital
4Klinik für Urologie, Universitätsspital Zürich Universität Zürich
Korrespondenz:
E-Mail: joerg.beyer@insel.ch
Eine adäquate Vorgehensweise zur Diagnose, Therapie und Nachsorge von Hodentumoren ist durch Studiendaten gut belegt. Nationale und internationale Therapieleitlinien geben klare Empfehlungen für die häufigsten klinischen Szenarien.1–3 Dennoch müssen diese auf die individuelle klinische Situation heruntergebrochen und korrekt angewandt werden. EineÜbertherapie bei Patienten mit hoher Heilungsaussicht ist ebenso zu vermeiden wie Therapieverzögerungen und Dosisreduktionen bei weit fortgeschrittener Erkrankung.3
Keypoints
-
Zwei Drittel der Männer mit Hodentumoren werden heutzutage im lokalisierten Stadium I ohne Nachweis von Metastasen diagnostiziert. Die Heilungsaussichten in diesem Stadium betragen 99%.
-
In den metastasierten Tumorstadien haben sich die Heilungsaussichten in den letzten zwei Jahrzehnten deutlich verbessert.
-
Das Update der Klassifikation der International Germ Cell Cancer Cooperative Group (IGCCCG) erlaubt eine exakte Prognoseabschätzung auf der Grundlage aktueller Therapiestrategien.
-
Die Bestimmung von MicroRNA-371 im peripheren Blut ist ein vielversprechender neuer Biomarker, der Therapieüberwachung und Nachsorge in Zukunft erleichtern wird.
Initiale Diagnostik und Therapie
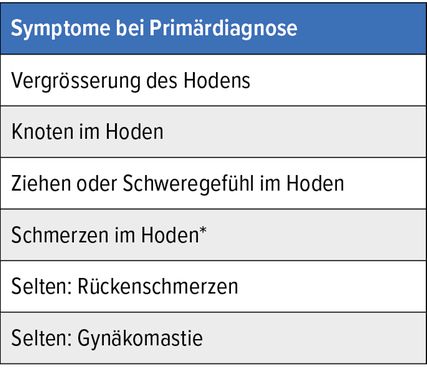
Tab. 1: Übersicht über mögliche Symptome bei Primärdiagnose. * Schmerzen im Hoden sprechen nicht gegen die Diagnose Hodenkrebs
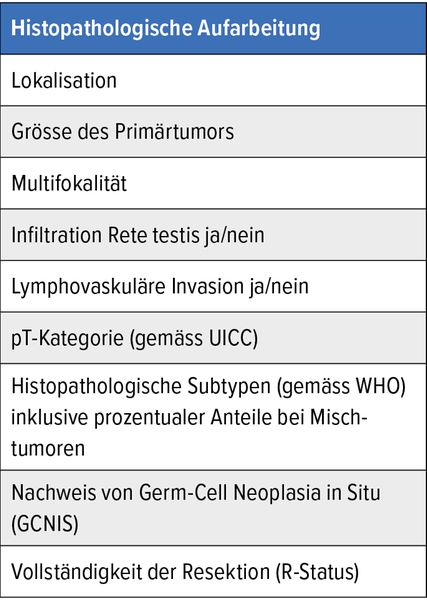
Tab. 3: Schritte der histopathologischen Aufarbeitung von Hodentumorbiopsien. pT, Primärtumor; UICC,Union Internationale Contre le Cancer; WHO, World Health Organization
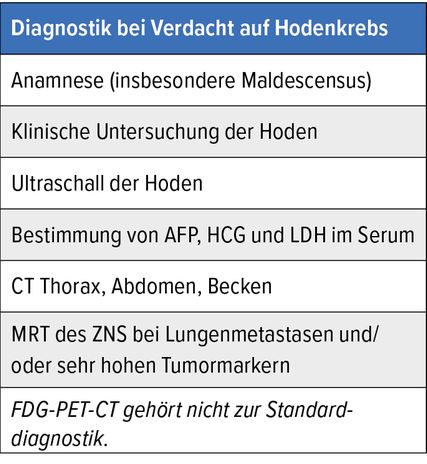
Die meisten Männer stellen sich aufgrund von Hodenvergrösserung, -verhärtung oder Hodenschmerzen beim Arzt vor (Tab. 1). Neben der klinischen Untersuchung sind vor allem die Ultraschalluntersuchung der Hoden und die Bestimmung der Tumormarker humanes Choriongonadotropin (HCG), Alpha-Fetoprotein (AFP) und Lactatdehydrogenase (LDH) für die Erhärtung der Verdachtsdiagnose relevant. Die Fehldiagnose einer Epididymitis sollte unbedingt vermieden werden. Besteht aufgrund erhöhter Tumormarker oder bei typischem Ultraschallbild der Verdacht auf einen malignen Hodentumor, ist die Orchiektomie über einen inguinalen Zugang indiziert. Bereits präoperativ sollten die weiteren Staginguntersuchungen durchgeführt werden. Diese beinhalten in der Regel eine Computertomografie (CT) des Thorax, des Abdomens und des Beckens. Bei Patienten mit Lungenmetastasen und/oder sehr hohen Tumormarkern sollte zusätzlich eine Magnetresonanztomografie (MRT) des Gehirns durchgeführt werden (Tab. 2). Eine 18F-Fluordesoxyglukose-Positronen-Emissions-Tomografie (FDG-PET-CT) ist nicht erforderlich.
Nach histologischer Aufarbeitung (Tab. 3) und komplettem Staging werden alle Patienten an einem interdisziplinären Tumorboard vorgestellt. Vor allem bei schwieriger Befundkonstellation und bei Patienten mit metastasierter Erkrankung ist die frühzeitige zusätzliche Kontaktaufnahme mit einem Expertenzentrum unbedingt empfehlenswert. Dies kann mittlerweile auch über ein kostenlos zugängliches Online-Portal des Swiss Testis Cancer Consult erfolgen (z.B. unter https://swisstecc.ch/landing ).
Strategien im Stadium I
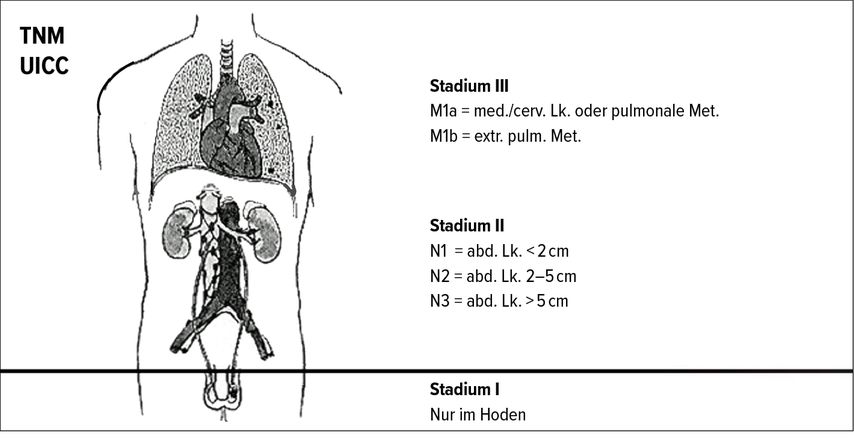
Im Stadium I ist die Erkrankung auf den Hoden beschränkt. Dies bedeutet, dass keine vergrösserten Lymphknoten und keine Organmetastasen im CT bzw. MRT nachweisbar sind (Abb. 1). Präoperativ erhöhte Tumormarker müssen nach Orchiektomie im Stadium I normalisiert sein, andernfalls muss die Normalisierung der Tumormarker abgewartet werden. Normalisieren sich die Tumormarker nicht oder steigen diese nach Orchiektomie erneut an, liegt auch ohne radiologischen Nachweis ein metastasiertes Tumorstadium vor.
Abb. 1: Stadieneinteilung von Hodenkrebs. Klinisch vor allem relevant ist die Unterteilung in das Stadium I, das auf den Hoden beschränkt ist, und in metastasierte Tumorstadien
Aktive Surveillance bzw. eine adjuvante Chemotherapie sind die beiden Standardoptionen bei Betroffenen im Stadium I (Tab. 4). Beim Seminom beträgt das Rezidivrisiko bei aktiver Surveillance je nach Risikofaktoren ca. 9–26%. Risikofaktoren sind Grösse des Primärtumors und eine Infiltration des Rete testis.4,5 Eine adjuvante Therapie mit einem Zyklus Carboplatin kann das Rezidivrisiko auf ca. 5% senken, aber nicht vollständig eliminieren.6 Wichtig ist bei der adjuvanten Therapie mit Carboplatin die volle Dosierung ohne sogenanntes «Capping».7 Beim Nichtseminom beträgt das Rezidivrisiko je nach Risikofaktoren ca. 15–50%. Risikofaktoren sind eine lymphovaskuläre Invasion und ein hoher Anteil an embryonalem Karzinom.8 Eine adjuvante Therapie mit einem Zyklus Cisplatin, Etoposid und Bleomycin kann das Rezidivrisiko auf unter 1% senken, stellt allerdings eine nebenwirkungsreiche Übertherapie für die Mehrzahl der Betroffenen dar.9 Patienten müssen daher in die Entscheidung über eine adjuvante Therapie versus eine aktive Surveillance einbezogen werden.10
Tab. 4: Strategien für Patienten mit Hodenkrebs in Stadium I. BEP: Cisplatin, Etoposid Tag 1–5 und Bleomycin nur Tag 1, 8, 15
Rezidive aus aktiver Surveillance können in der Regel frühzeitig erkannt und in der Regel durch eine Chemotherapie analog den primär metastasierten Tumorstadien geheilt werden. Allerdings ist hierzu eine gut strukturierte und konsequente Nachsorge erforderlich, um Rezidive mit weit fortgeschrittener Erkrankung zu vermeiden.
Prognoseabschätzung und Therapie metastasierter Tumorstadien
Die ursprüngliche Klassifikation der International Germ Cell Cancer Cooperative Group (IGCCCG) stellte bei ihrer Publikation 1997 einen erheblichen Fortschritt bei der Prognoseabschätzung und Therapieplanung dar.11 Allerdings basierte diese Klassifikation auf Daten, die vor 1990 erhoben worden waren. Daher hat das IGCCCG Update Consortium nochmals eine grosse Datensammlung angelegt, um die ursprüngliche IGCCCG-Klassifikation basierend auf Daten mit moderner Diagnostik und Therapie zu überprüfen.12,13 Tatsächlich hat sich seit der ursprünglichen Publikation der IGCCCG-Klassifikation die Prognose von Patienten mit metastasierten Hodentumoren deutlich verbessert.14
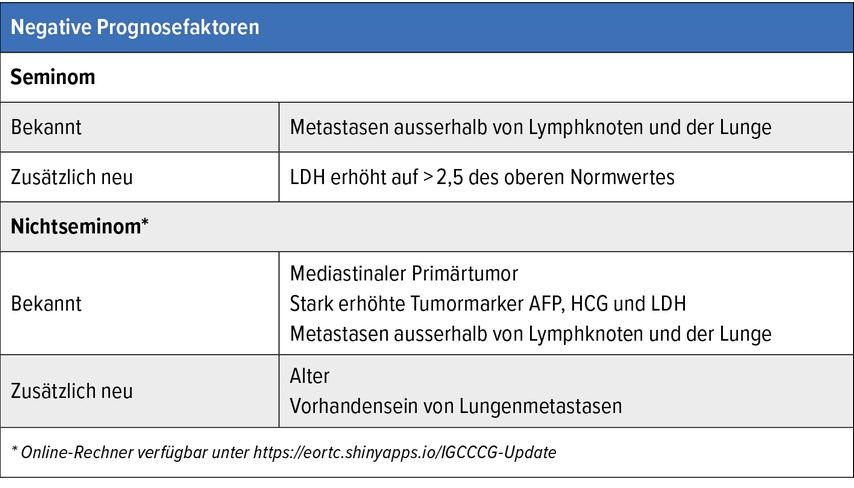
Die Prognosegruppen der ursprünglichen IGCCCG-Klassifikation haben sich in dem Update erfreulicherweise bestätigt, sodass die IGCCCG-Klassifikation im klinischen Alltag weiterhin verwendet werden sollte. Zusätzliche Prognosefaktoren sind jedoch beim Seminom die Höhe der LDH, beim Nichtseminom das Vorhandensein von Lungenmetastasen und das Alter der Betroffenen (Tab. 5).
Ein Werkzeug zur exakten Berechnung der Prognose metastasierter Patienten mit Nichtseminomen steht online zur Verfügung (unter https://eortc.shinyapps.io/IGCCCG-Update ). Die Therapie erfolgt dann stadiengerecht mit 3–4 Zyklen PEB (Cisplatin, Etoposid und Bleomycin) bzw. einem vergleichbar wirksamen Schema.1–3
Spezielle Therapiesituationen
Die Mehrzahl der Patienten wird mit Befunden diagnostiziert, bei denen das diagnostische und therapeutische Vorgehen in Leitlinien klar vorgegeben wird. Eine grosse Herausforderung stellen dagegen Patienten mit seltenen Präsentationen dar. Hier ist eine frühzeitige Kontaktaufnahme mit einem Expertenzentrum zwingend, um Diagnostik- und Therapiefehler zu vermeiden.
Patienten mit weit fortgeschrittener Erkrankung
Patienten mit weit fortgeschrittener Erkrankung und schlechter Prognose werden selbst bei konsequentem Einsatz von 4 Zyklen BEP häufig nicht geheilt. Dies betrifft insbesondere Patienten mit verzögertem Abfall der Tumormarker nach dem ersten Therapiezyklus, Patienten mit extrapulmonalen Organmetastasen und Patienten mit primär mediastinalen Nichtseminomen.15 Eine Dosisintensivierung stellt in Einzelfällen eine sinnvolle Strategie dar, um die unbefriedigenden Ergebnisse bei Therapie mit BEP zu verbessern.
Residualtumorresektionen
Patienten mit Nichtseminomen und Residualtumoren grösser als 1cm nach Chemotherapie müssen zeitnah eine sogenannte Residualtumorresektion erhalten, um eventuell vorhandene Teratomanteile und verbliebenen vitalen undifferenzierten Tumor zu entfernen. Bei Seminomen entfällt eine solche Residualtumorresektion unabhängig von der Grösse des Resttumors. Residualtumorresektionen sind anspruchsvoll und risikoreich und müssen daher zwingend an einem Expertenzentrum durchgeführt werden, das derartige Eingriffe regelhaft vornimmt.
Growing Teratoma Syndrome
Bei Patienten mit Anteilen von reifem Teratom kann unter Chemotherapie ein sogenanntes Growing Teratoma Syndrome auftreten, bei dem sich einerseits die Tumormarker normalisieren, andererseits eine Grössenzunahme radiologisch zystisch imponierender Tumoren nachweisbar ist. Wenn möglich sollte die initial geplante Chemotherapie stadiengerecht abgeschlossen werden und zeitnah eine Resektion der grössenprogredienten Tumoren vorgenommen werden. Eine Fortsetzung der Chemotherapie über die initial geplante Zykluszahl ist nutzlos.
Rezidivtherapie
Patienten im initialen Stadium I und mit Rezidiv aus aktiver Surveillance oder nach adjuvanter Chemotherapie werden wie Patienten mit de novo metastasierter Erkrankung behandelt. Die Therapie von Rezidiven nach Cisplatin-haltiger Primärtherapie ist komplex und nebenwirkungsreich und sollte zwingend an einem Expertenzentrum durchgeführt werden. Je nach Risikofaktoren kommen eine konventionelldosierte Chemotherapie sowieeine hochdosierte Chemotherapie mit autologer Stammzelltransplantation zum Einsatz.16,17 Spätrezidive mehr als zwei Jahre nach Cisplatin-haltiger Therapie werden vor allem bei singulärer Lokalisation und niedrigen Tumormarkern primär reseziert.
Palliative Therapie
Eine palliative Therapie ist bei Patienten mit Hodentumoren erfreulicherweise nur selten erforderlich. In Einzelfällen kann eine sogenannte «desperation surgery» noch eine Tumorkontrolle erzielen. Meistens kommen jedoch Chemotherapien mit Medikamenten zum Einsatz, die zuvor nicht angewandt worden sind.18 Der Einsatz von Tyrosinkinaseinhibitoren und von Immuntherapien wurde in Studien zwar untersucht, bislang jedoch ohne relevanten Erfolg.19 Auf nebenwirkungsreiche Therapien sollte zugunsten einer konsequenten palliativen Begleitung verzichtet werden.
MicroRNA-371 als neuer Biomarker
MicroRNA (miRNA) sind kurze, hoch konservierte, nichtcodierende Abschnitte von Ribonukleinsäure (RNA) bestehend aus etwa 22 Nukleotiden, die eine wichtige Rolle in dem komplexen Netzwerk der Genregulation, insbesondere beim Gen-Silencing spielen. Speziell miRNA-371 konnte bei metastasierten Hodentumoren im peripheren Blut korrelierend mit der Tumormasse nachgewiesen werden.20,21 Bei Patienten unter aktiver Surveillance zeigt miRNA-371 Rezidive sensitiv und spezifisch an sowie früher, als dies mit den üblichen Nachsorgeuntersuchungen der Fall ist.22 MiRNA-371 könnte daher vor allem in der Nachsorge von Patienten künftig die Zahl der erforderlichen CT- und MRT-Untersuchungen erheblich reduzieren.
Fazit
Die Heilungsaussichten von Patienten mit Hodentumoren haben sich in den letzten Jahrzehnten deutlich verbessert. Auch Patienten mit weit fortgeschrittener Erkrankung können mehrheitlich noch geheilt werden. Dennoch bleiben die Therapieentscheidungen im Einzelfall komplex. Eine frühzeitige Kontaktaufnahme mit einem Expertenzentrum ist daher auch bei scheinbar einfacher Fragestellung unbedingt empfehlenswert.
Literatur:
1 Honecker F et al: ESMO Consensus Conference on testicular germ cell cancer: diagnosis, treatment and follow-up. Ann Oncol 2018; 29: 1658-86 2 Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): S3-Leitlinie Diagnostik, Therapie und Nachsorge der Keimzelltumoren des Hodens. Langversion 1.1, 2020, AWMF-Registernummer: 043/049OL. Online unter https://www.leitlinienprogramm-onkologie.de/leitlinien/hodentumoren . Abgerufen am 27.3.2022 3 Beyer J et al.: Swiss germ-cell cancer consensus recommendations. Swiss Med Wkly 2021; 151: w30023 4 Mortensen MS et al.: A nationwide cohort study of stage I seminoma patients followed on a surveillance program. Eur Urol 2014; 66: 1172-8 5 Chung P et al.: Evaluation of a prognostic model for risk of relapse in stage I seminoma surveillance. Cancer Med 2015; 1: 155-60 6 Oliver RTD et al.: Radiotherapy versus single-dose carboplatin in adjuvant treatment of stage I seminoma: a randomised trial. Lancet 2005; 366: 293-300 7 Fehr M et al.: Carboplatin dose based on actual renal function: no excess of acute haematotoxicity in adjuvant treatment in seminoma stage I. ESMO Open 2018; 3: e000320 8 Daugaard G et al.: Surveillance for stage I nonseminoma testicular cancer: outcomes and long-term follow-up in a population-based cohort. J Clin Oncol 2014; 32: 3817-23 9 Tandstad T et al.: One course of adjuvant BEP in clinical stage I nonseminoma mature and expanded results from the SWENOTECA group. Ann Oncol 2014; 25: 2167-72 10 Oldenburg J et al.: Personalizing, not patronizing: the case for patient autonomy by unbiased presentation of management options in stage I testicular cancer. Ann Oncol 2015; 26: 833-8 11 Mead GM: International germ cell consensus classification: a prognostic factor- based staging system for metastatic germ cell cancers. J Clin Oncol 1997; 15: 594-603 12 Gillessen S et al.: Predicting outcomes in men with metastatic nonseminomatous germ cell tumors (NSGCT): results from the IGCCCG Update Consortium. J Clin Oncol 2021; 39: 1563-74 13 Beyer J et al.: Survival and new prognosticators in metastatic seminoma: results from the IGCCCG-Update Consortium. J Clin Oncol 2021; 39: 1553-62 14 Fankhauser CD et al.: Improved survival in metastatic germ-cell cancer. Ann Oncol 2018; 29: 347-51 15 Fizazi K et al.: Personalised chemotherapy based on tumour marker decline in poor prognosis germ-cell tumours (GETUG 13): a phase 3, multicentre, randomised trial. Lancet Oncol 2014; 15: 1442-50 16 The International Prognostic Factor Study Group: Prognostic factors in patients with metastatic germ cell tumors who experienced treatment failure with cisplatin-based first-line chemotherapy. J Clin Oncol 2010; 28: 4906-11 17 Lorch A et al.: Conventional-dose versus high-dose chemotherapy as first salvage treatment in male patients with metastatic germ cell tumors: evidence from a large international database. J Clin Oncol 2011; 29: 2178-84 18 Oing C et al.: Palliative treatment of germ cell cancer. Cancer Treat Rev 2018; 71: 102-7 19 Fankhauser CD et al.: Emerging therapeutic targets for male germ cell tumors. Curr Oncol Rep 2015; 17: 54 20 Leao R et al.: Circulating microRNAs, the next-generation serum biomarkers in testicular germ cell tumours: asystematic review. Eur Urol 2021; 80: 456-66 21 Dieckmann KP et al.: Serum levels of microRNA-371a-3p (M371 Test) as a new biomarker of testicular germ cell tumors: results of a prospective multicentric study. J Clin Oncol 2019; 37: 1412-23 22 Fankhauser CD et al.: Detection of recurrences using serum miR-371a-3p during active surveillance in men with stage I testicular germ cell tumours. Br J Cancer 2021; online ahead of print
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...