Mantelzelllymphom – die klinische Perspektive
Autoren:
Dr. med. Gabriel Scheubeck
Prof. Dr. med. Martin Dreyling
Medizinische Klinik und Poliklinik III
LMU Klinikum München – Campus Großhadern
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Mantelzelllymphom gehört zu den seltenen B-Zell-Lymphomen mit ungünstiger Prognose und gilt bislang als nicht heilbar. Durch die Einführung moderner Induktionstherapien, die Etablierung der autologen Transplantation und Zulassung zielgerichteter Therapien hat sich die Prognose in den letzten Jahrzehnten deutlich verbessert. Mit der CAR-T-Zell-Therapie KTE-X19 steht nun in der Rezidivtherapie ein völlig neuer Therapieansatz zur Verfügung, derdie Therapielandschaft beim Mantelzelllymphom nachhaltig erweitert.
Keypoints
-
Das Mantellzelllymphom ist durch die Translokation t(11;14) charakterisiert. Als Prädiktoren für einen ungünstigen Verlauf gelten neben einem hohen MIPI(-c)-Index die Risikofaktoren TP53-Alteration, hoher Ki-67-Index und der blastoide oder pleomorphe Subtyp.
-
In der Induktionstherapie wird eine Immunochemotherapie eingesetzt. Junge Patienten profitieren von der Hinzunahme hochdosierten Cytarabins und einer konsolidierenden autologen Stammzelltransplantation. Eine Rituximab-Erhaltungstherapie verlängert unabhängig vom Patientenalter das progressionsfreie wie auch das Gesamtüberleben.
-
Ibrutinib ist bei Patienten mit Frührezidiv (POD24) einer konventionellen Immunochemotherapie überlegen und sollte deshalb in dieser Situation bevorzugt werden.
-
Die CAR-T-Zell-Therapie ist derzeit die einzig empfohlene Therapie bei Ibrutinib-Versagern.
Das Mantelzelllymphom (MCL) macht in Westeuropa etwa 5–7% der malignen Lymphome des Erwachsenenalters aus und gehört damit zu den seltenen B-Zell-Non-Hodgkin-Lymphomen.1,2 Mit einer Inzidenz von 2–3/100000 betrifft das MCL insbesondere ältere Patienten in einem medianen Alter von 65 Jahren. Dabei sind Männer dreimal häufiger betroffen als Frauen und die Mehrheit der Patienten befindet sich im fortgeschrittenen Stadium.3 Die Stadieneinteilung erfolgt nach Ann Arbor oder den modifizierten Luganokriterien.4 Kontinuierliche molekularbiologische und therapeutische Entwicklungen haben die Prognose in den letzten Jahren deutlich verbessert, gleichwohl gilt das MCL nach wie vor als nicht heilbar.
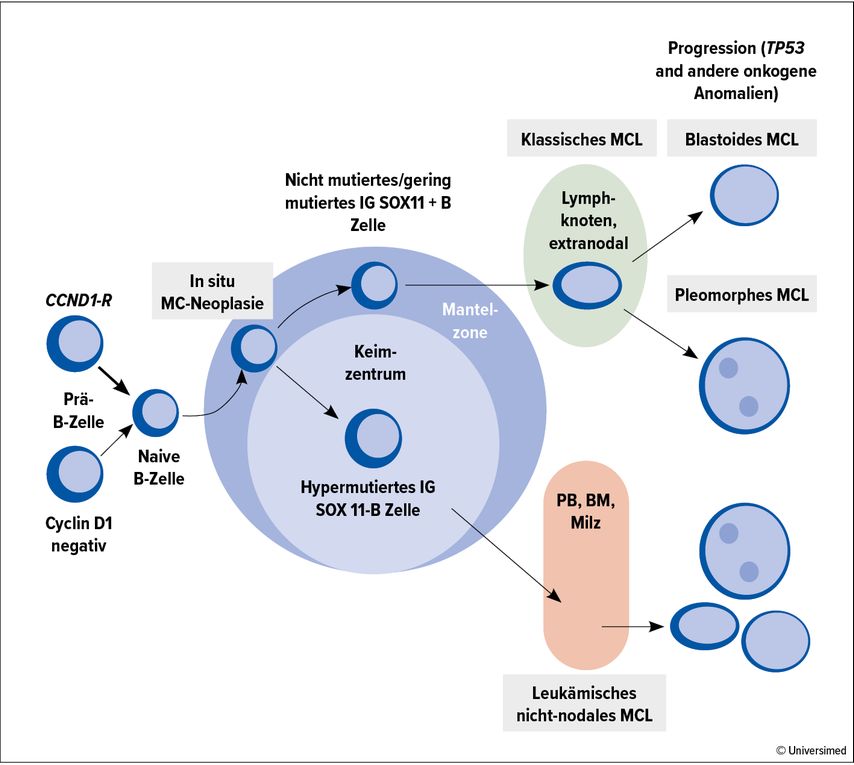
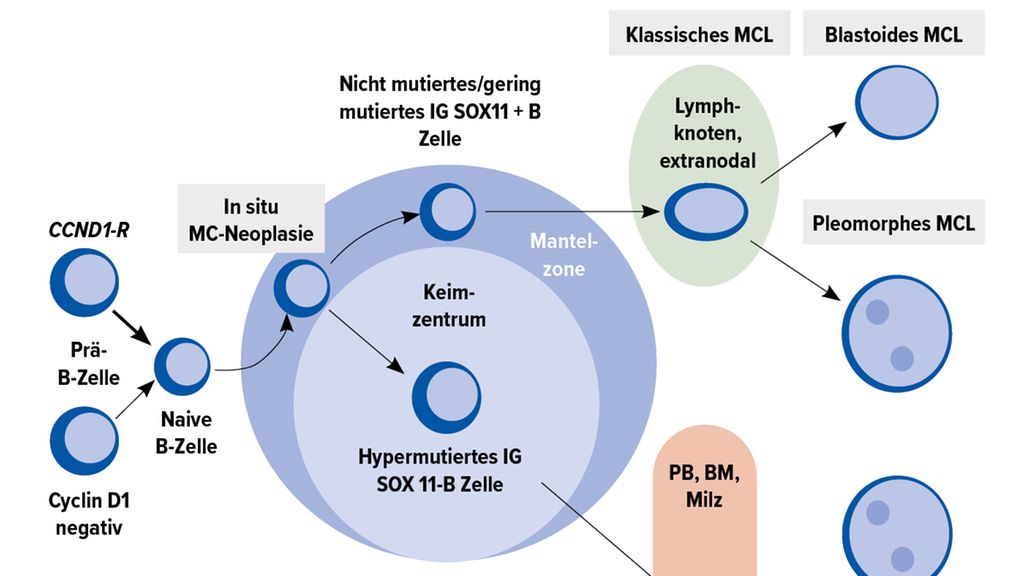
Charakteristisch ist der Nachweis der Translokation t(11;14) mit konsekutiver Cyclin-D1-Überexpression. Der klinische Verlauf ist heterogen. Historisch wurde es im Rahmen der Kiel-Klassifikation zunächst den indolenten Lymphomen zugerechnet, inzwischen wird das MCL aber nach der WHO-Klassifikation als aggressives Lymphom klassifiziert.5 Entsprechend können zwei Verlaufsformen unterschieden werden. Eine indolente leukämisch verlaufende kann von einer nodal verlaufenden Variante mit regelmässig aggressivem Verlauf abgegrenzt werden (Abb. 1).6–9
Prognostisch eignet sich der Mantle Cell Lymphoma International Prognostic Index (MIPI) zur Risikoeinteilung.10 Dieser Index berücksichtigt das Alter, den ECOG-Performance-Status, Serum-LDH- Level und die Leukozytenzahl. Daneben sind TP53-Alterationen, ein hoher Ki-67- Index (≥30%) und eine blastoide oder pleomorphe Histologie als biologische Risikofaktoren mit einer ungünstigen Prognose assoziiert und sollten deshalb bereits bei der Diagnosestellung evaluiert werden (Abb. 1).11–14 Der kombinierte MIPI-c-Index beinhaltet neben den MIPI-Faktoren zudem den Ki-67-Index und erlaubt eine nochmals bessere Unterscheidung der Risikogruppen.11 Im Rezidiv haben ein komplexer Karyotyp und ein Progress innerhalb von 12–24 Monaten nach Erstlinientherapie einen negativen prädiktiven Wert.15,16 Obwohl inzwischen verschiedene Hochrisikogruppen identifiziert wurden, erfolgt die Therapieauswahl neu diagnostizierter Patienten weiterhin vor allem auf Basis von Alter und Allgemeinzustand und nicht nach klinischen oder (molekular-)biologischen Risikofaktoren.
Abb. 1: Molekulare Pathogenese des MCL. BM, Knochenmark; CCND1-R; Cyclin D1; IG, Immunglobulin; MC, Mantelzelle; MCL, Mantelzelllymphom; neg, negativ; PB, peripheres Blut; SOX-11, SRY-Box Transcription Factor 11. Adaptiert nach Swerdlow et al.17
Die passende Erstlinientherapie
Meist besteht bei Erstdiagnose eine Behandlungsindikation. Bei der kleineren Gruppe von Patienten mit leukämischem MCL oder niedriger Tumorlast kann zunächst auch eine «Watch and wait»-Strategie verfolgt werden.
Polychemotherapie plus Rituximab beiPatienten ≤65 Jahren
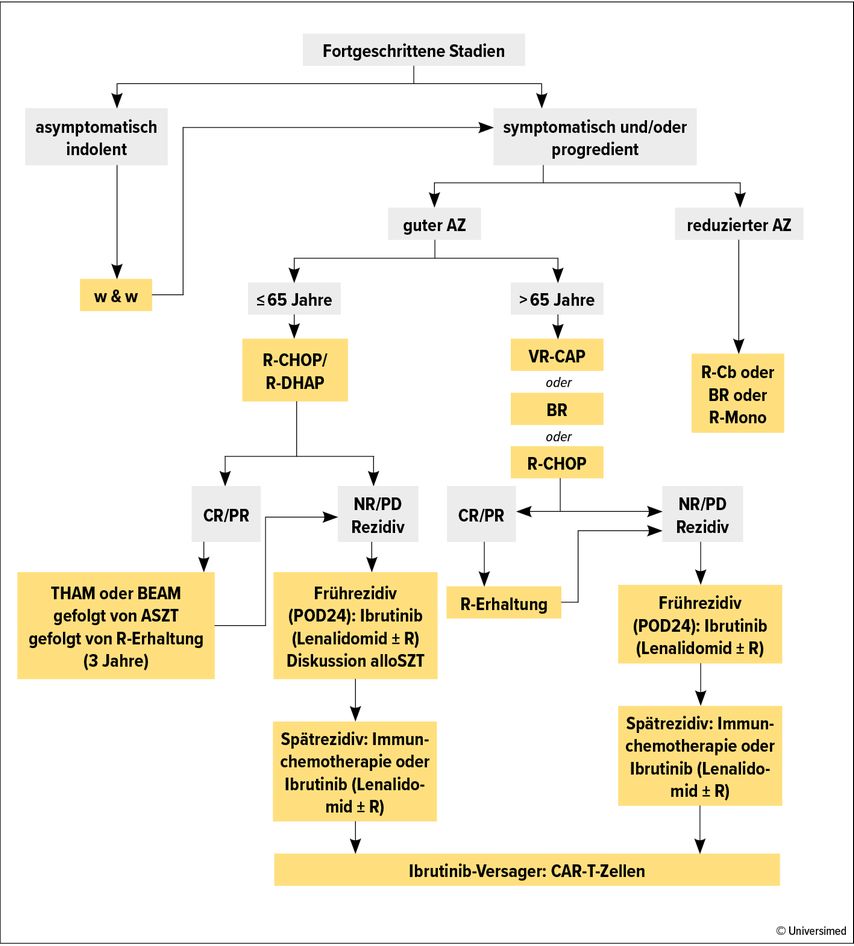
Die Erstlinientherapie beinhaltet typischerweise eine Polychemotherapie in Kombination mit dem CD20-Antikörper Rituximab (R). Die Intensivierung der Therapie durch die Hinzunahme von hochdosiertem Cytarabin hat das Ansprechen und die Prognose jüngerer Patienten nachhaltig verbessert.18,19 Lag das mediane Gesamtüberleben (OS) zu Beginn der Jahrtausendwende noch bei 2–3 Jahren, kann mit modernen Induktionsregimen ein progressionsfreies Überleben (PFS) von gut 5 Jahren erreicht werden.20,21 Die alternierende Induktion mit 3 Zyklen R-CHOP und 3 Zyklen R-DHAP gefolgt von einer myeloablativen Konditionierung nach BEAM- oder THAM-Schema und autologem Stammzellsupport definiert den derzeitigen Therapiestandard (Abb. 2). Eine dreijährige Erhaltungstherapie mit Rituximab verlängert nicht nur das PFS, sondern auch das OS nach autologer Stammzelltransplantation (ASZT)22 und sollte daher auch in Zeiten der Covid-19-Pandemie durchgeführt werden.
Die TRIANGLE-Studie (EudraCT#: 2014-001363-12) des Europäischen MCL-Netzwerks evaluiert den Stellenwert der ASZT im Zeitalter der zielgerichteten Therapien. Dabei wird der derzeitige Therapiestandard (R-CHOP/R-DHAP Induktionstherapie + ASZT) mit einer Ibrutinib-haltigen Induktionstherapie (IR-CHOP/R-DHAP) mit und ohne ASZT, aber jeweils mit Ibrutinib-Erhaltungstherapie in einem dreiarmigen Design verglichen. Die Rekrutierung endete im Dezember 2020. Mit den ersten Ergebnissen ist 2023 zu rechnen.
Abb. 2: Therapie-Algorithmus beim Mantelzelllymphom aus den Onkopedia-Leitlinien 2021. BR: Rituximab, Bendamustin; CR, komplette Remission; NR, keine Remission; PD, Progress der Erkrankung («progressive disease»); PR, partielle Remission; R-Cb: Rituximab, Chlorambucil; w&w: abwarten („watch and wait“). Modifiziert nach Smith et al.20
Immunchemotherapie für Patienten >65 Jahre
Patienten, die aufgrund ihres Alters nicht für eine ASZT qualifizieren, werden mit einer Immunochemotherapie (ICT) behandelt (Abb. 2). Der Antikörper Rituximab ist in allen Regimen etabliert. Als Chemotherapie-Backbone wird aufgrund der guten Verträglichkeit zunehmend häufiger Bendamustin (B) eingesetzt.23 Aber auch das (ggf. altersentsprechend dosisreduzierte Mini-)CHOP-Schema hat einen festen Stellenwert und bietet sich an, wenn eine prolongierte Infektanfälligkeit durch die T-Zell-Toxizität von Bendamustin vermieden werden soll. Eine sehr effektive und gleichzeitig gut verträgliche Alternative stellt das VR-CAP-Regime dar, in dem Vincristin aus dem R-CHOP-Schema durch Bortezomib ersetzt wird.24 Auch für ältere Patienten wird eine Erhaltungstherapie mit Rituximab über drei Jahre im zweimonatlichen Rhythmus empfohlen.
In der MCL-R2-Elderly-Studie wurde für eine kombinierte Erhaltungstherapie mit Rituximab und Lenalidomid (R2) gegenüber der Rituximab-Erhaltung zwar eine Verlängerung des PFS, nicht jedoch des OS gezeigt.25 Dieser PFS-Vorteil geht allerdings mit einer erhöhten Nebenwirkungsrate einher. Hochrisikopatienten und Patienten mit inkompletter Remission nach Induktionstherapie sind damit mögliche Kandidaten für eine R2-Erhaltungstherapie.
In der SHINE-Studie (ClinicalTrials.gov Identifier: NCT01776840) wird derzeit die Kombination aus BR + Ibrutinib versus BR + Placebo bei älteren, nicht für eine ASCT geeigneten Patienten untersucht. Das PFS war mit 80,6 Monaten im Ibrutinib-Arm gegenüber 52,9 Monaten im Placebo-Arm deutlich überlegen. Das OS ist in beiden Gruppen (noch) vergleichbar.26Auf Basis dieser Daten wurde bereits ein Zulassungsantrag für Ibrutinib in der Erstlinienbehandlung in Kombination mit Bendamustin bei der EMA eingereicht.
Kompromittierte Patienten
Für Patienten mit schweren Begleiterkrankungen kommen BR in Dosisreduktion (50–70mg/m2) oder gut verträgliche Regime wie R-Chlorambucil oder R-CVP infrage.
Was tun beim Rezidiv?
Immunchemotherapie oder BTKi beiPatienten mit erstem Rezidiv
Trotz initial guter Ansprechraten kommt es bei fast allen Patienten im weiteren Verlauf zu einem Rezidiv. Nach längerer Remissionsdauer nach der Erstlinientherapie kann erneut eine Immunchemotherapie verabreicht werden (Abb. 2). Mit dem oralen Bruton-Tyrosinkinase-Inhibitor (BTKi) Ibrutinib steht eine hochwirksame Chemotherapie-freie Monotherapie zur Verfügung.27,28
Besonders Patienten mit TP53-Alterationen sprechen jedoch nur kurz an. In einer Analyse der nordischen MCL2- und MCL3- Studien zeigte sich ein medianes OS von gerade einmal 1,8 Jahren bei Patienten mit TP53-Mutation im Vergleich zu 12,7 Jahren bei nicht TP53-mutierten Patienten.13 Bei Frührezidiven (POD24; Krankheitsprogression innerhalb von 2 Jahren) sollte Ibrutinib bevorzugt werden, da ein Vorteil gegenüber konventionellen Regimen wie BR oder R-BAC belegt ist.29,30 Die BTKi zweiter Generation Acalabrutinib und Zanubrutinib werden derzeit in klinischen Studien evaluiert und zeichnen sich bei vergleichbarer Wirksamkeit durch eine bessere Verträglichkeit aus.
Eine allogene Transplantation kommt aufgrund der hohen Therapie-assoziierten 1-Jahres-Mortalitätsrate von 24% nur in Einzelfällen für junge Patienten mit Frührezidiv in Betracht.31
CAR-T-Zellen bei Patienten mit zweitem Rezidiv (Ibrutinib-Versager)
Nach Versagen von Ibrutinib ist die Prognose mit einem Gesamtüberleben unter einem Jahr sehr limitiert. Mit der CAR(«chimeric anitigen receptor»)-T- Zell-Therapie KTE-X19 (Tecartus®) hat sich das therapeutische Feld nun auch um die zelluläre Immuntherapie für das MCL erweitert.
In der ZUMA-2-Studie zeigte sich bei Patienten mit bis zu 5 Vortherapien ein eindrucksvolles Gesamtansprechen von 93% (Komplettremissionsrate: 67%) nach einer 7-monatigen Nachbeobachtungszeit.32 57% der Patienten hatten ein anhaltendes Ansprechen am Stichtag der Studienauswertung. Die 12-Monats-PFS- und -OS-Rate lag bei 61% bzw. 83%. Interessanterweise war das 6-Monats-PFS auch bei Patienten mit TP53-Mutation, pleomorpher Histologie und erhöhtem Ki-67-Index konsistent hoch. CAR-T-Zellen sind daher die derzeit einzig empfohlene Therapie nach BTKi-Versagen (Abb. 2).
Mit dem Bcl-2(«B-cell lymphoma 2»)-Inhibitor Venetoclax kann bei rezidivierten Patienten ein PFS von knapp unter einem Jahr erreicht werden.33 Bispezifische T-Zell-rekrutierende Antikörper wie z.B. Glofitamab zeigen frühe, vielversprechende Ergebnisse und haben durch ihre unmittelbare Verfügbarkeit auch Vorteile gegenüber der CAR-T-Zell-Therapie.34
BEAM: Carmustin, Etoposid, Cytarabin, Melphalan; CHOP: Cyclophosphamid, Doxorubicin, Vincristin, Prednison; CVP: Cyclophosphamid, Vincristin, Prednison; DHAP: Dexamethason, Cytarabin, Cisplatin; THAM: Ganzkörperbestrahlung, Cytarabin, Melphalan; VR-CAP: Bortezomib, Rituximab, Cyclophosphamid, Doxorubicin, Prednison
Literatur:
1 Smith A et al.: Br J Cancer 2011; 105(11): 1684-92 2 Sant M et al.: Blood 2010; 116(19): 3724-34 3 Jain P et al.: J Clin Oncol 2020; 38(36): 4302-16 4 Cheson BD et al.: J Clin Oncol 2014; 32(27): 3059-68 5 Swerdlow SH et al.: World Health Organization classification of tumours of haematopoietic and lymphoid tissues. International Agency for Research on Cancer 2017; revised 4th edition 6 Navarro A et al.: Cancer Res 2012; 72(20): 5307-16 7 Ondrejka SL et al.: Haematologica 2011; 96(8): 1121-7 8 Hu Z et al.: Mod Pathol; 2018 31(2): 327-36 9 Ye H et al.: Smoldering mantle cell lymphoma. J Exp Clin Cancer Res 2017; 36(1): 85 10 Hoster E et al.: Blood 2008; 111(2): 558-65 11 Hoster E et al.: J Clin Oncol 2016 34(12): 1386-94 12 Aukema SM et al.: Blood 2018; 131(4): 417-20 13 Eskelund CW et al.: Blood 2017; 130(17): 1903-10 14 Nordstrom L et al.: Br J Haematol 2014; 166(1): 98-108 15 Visco C et al.: Br J Haematol 2019; 185(5): 940-4 16 Kumar A et al.: Blood Cancer J 2019; 9(6): 50 17 Swerdlow SH et al.: Blood 2016; 127(20): 2375-90 18 Hermine O et al.: Blood 2021; 138(Suppl_1): 380 19 Hermine O et al.: Lancet 2016; 388(10044): 565-75 20 Smith A et al.: Br J Haematol 2018; 181(2): 215-28 21 Smith A et al.: Br J Cancer 2015; 112(9): 1575-84 22 Le Gouill S et al.: N Engl J Med 2017; 377(13): 1250-60 23 Castellino A et al.: Blood Adv 2021 24 Robak T et al.: Lancet Oncol 2018; 19(11): 1449-58 25 Ribrag V et al.: Blood 2021; 138(Suppl_1): 379 26 Wang ML et al.: N Engl J Med 2022; Online ahead of print 27 Dreyling M et al.: Lancet 2016; 387(10020): 770-8 28 Wang ML et al.: NEngl J Med 2013; 369(6): 507-16 29 Visco C et al.: Leukemia 2021; 35(3): 787-795 30 Visco C et al.: Leukemia 2021; 35(3): 932 31 Robinson SP et al.: Bone Marrow Transplant 2018; 53(5): 617-24 32 Wang M et al.: N Engl J Med 2020; 382(14): 1331-42 33 Davids MS et al.: Clin Cancer Res 2021; 27(17): 4690-5 34 Phillips T et al.: Blood 2021; 138(Suppl_1): 130
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...