Management der Polycythaemia vera im Wandel
Autorin:
Prof. Dr. med. Claire Harrison
Guy’s and St Thomas’ NHS Foundation Trust
London, UK
E-Mail: claire.harrison@gstt.nhs.uk
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
In den letzten Jahren konnte die Behandlung der Polycythaemia vera laufend verbessert werden. Jedoch besteht nach wie vor ein Bedarf an neuen Therapien, während sich gleichzeitig unsere Konzepte dieser Krankheit ständig verändern.
Innerhalb der Gruppe der myeloproliferativen Neoplasien gilt die Polycythaemia vera (PV) als eher indolente Erkrankung. Die Inzidenz liegt bei etwa 0,84/100000.1 Klinische Probleme ergeben sich in erster Linie aufgrund von Thrombosen und Blutungen, gleichzeitig stellt die Progression zu Myelofibrose oder akuter Leukämie ein erhebliches Risiko dar. Das mediane Gesamtüberleben wird auf etwa 20 Jahre geschätzt.2 Als fundamentale Behandlungsprinzipien etablierten die ECLAP- und die CYTO-PV-Studie niedrig dosierte Acetylsalicylsäure bzw. Phlebotomien mit Hämatokrit-Zielwerten <45%.3,4
Ist Niedrigrisiko wirklich niedrig?
Das Konzept von Hoch- vs. Niedrigrisiko-PV ist derzeit im Wandel begriffen. Bisher ging man davon aus, dass eine Indikation zur zytoreduktiven Therapie nur bei Hochrisikopatient:innen besteht. Daten zeigten jedoch, dass das Risiko von Patient:innen mit «niedrigem» Risiko jenes der altersgematchten Allgemeinbevölkerung übersteigt, selbst wenn in der Kontrollpopulation mehrere kardiovaskuläre Risikofaktoren vorliegen.5,6 Eine populationsbasierte Studie aus Schweden erbrachte bei PV-Patient:innen ein signifikant gesteigertes Risiko für venöse Thromboembolien, schwere Blutungen und Gesamtmortalität.7 Da es sich um eine relativ rezente Arbeit handelt, müssen wir davon ausgehen, dass das Management unserer Patient:innen mit den aktuellen Therapien unabhängig von ihrem Risiko zu wünschen übrig lässt.
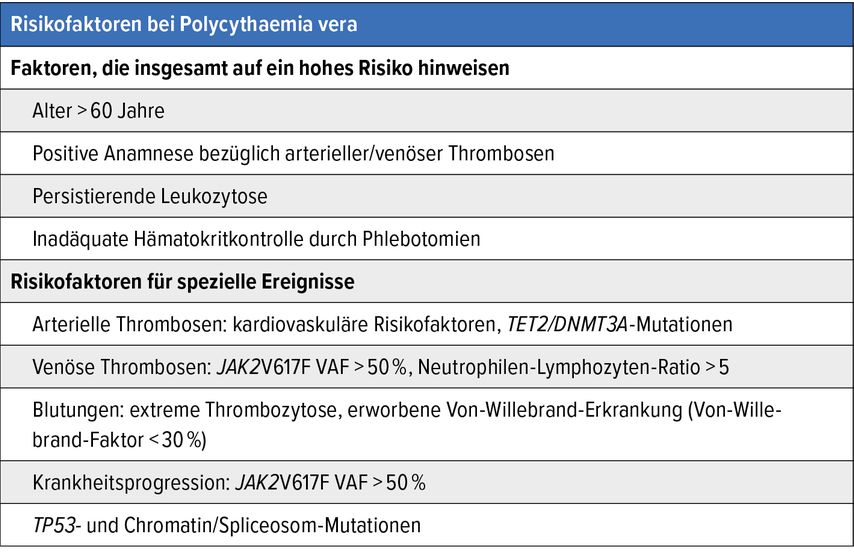
In die Definition der Hochrisikopatient:innen fliessen mehrere Faktoren ein (Tab.). Zusätzliche Risikofaktoren gelten im Zusammenhang mit arteriellen oder venösen Thrombosen, Blutungen und Progression. Einer gesteigerten «variant allele frequency» (VAF) im Zusammenhang mit der JAK2V617F-Mutation (>50%) kommt in der klinischen Praxis mittlerweile wachsende Bedeutung zu. Insgesamt müssen viele Patient:innen, die früher der Niedrigrisikokategorie zugeordnet waren, heute wohl als Hochrisikopatient:innen eingestuft werden.
Erstlinientherapie mit Interferon vs. HU
Bei bestehender Indikation zur Zytoreduktion ist in der Erstlinie primär die Entscheidung zwischen Hydroxyurea (HU) und Interferon (IFN) zu treffen. In der randomisierten Phase-III-Studie PROUD-PV und ihrer Extension CONTINUATION-PV erhielten die Patient:innen entweder Ropeginterferon alfa-2b (Ropeg) oder HU/BAT («best available treatment»). Die finale Effektivitätsanalyse erfolgte, nachdem alle Teilnehmer:innen sechs Jahre lang behandelt worden waren. Sie erbrachte signifikante Vorteile von Ropeg sowohl in Bezug auf komplette hämatologische Remissionen (CHR) laut Zellzahlen (54,5% vs. 34,9%; p=0,02) als auch hinsichtlich der molekularen Response (MR; 66,0% vs. 19,4%; p<0,0001).8 Das ereignisfreie Überleben (EFS) war im experimentellen Arm signifikant verlängert (HR: 0,34; p=0,04). Dieser Endpunkt korrelierte insofern mit der MR, als Patient:innen mit einer MR im Rahmen ihrer letzten Kontrolle deutlich seltener Ereignisse entwickelten als jene ohne MR (3,8% vs. 15,7%; HR: 0,24; p=0,02).
Eine retrospektive Studie konnte bei 470 PV-Patient:innen die Effektivität von rekombinantem IFN alfa über einen Zeitraum von bis zu 28 Jahren nachweisen.9 Sowohl das Überleben ohne Myelofibrose als auch das Gesamtüberleben verlängerten sich durch IFN im Vergleich zu HU und Phlebotomie signifikant. Ein weiterer wichtiger Aspekt ergibt sich aus der Option einer therapiefreien Remission. Daten zeigen eine niedrige Rezidivwahrscheinlichkeit nach dem Absetzen bei Patient:innen, die eine CHR über ≥24 Monate erreicht hatten und zum Zeitpunkt des Absetzens eine JAK2V617F VAF <10% aufwiesen.10 Diese Parameter können als nützliche Richtschnur dienen, wenn die Beendigung einer IFN-Therapie im Raum steht.
Zwar besteht kein Zweifel an der Effektivität von IFN in der Therapie der PV, Nebenwirkungen wie grippeähnliche Symptome, metabolische Komplikationen oder Autoimmunität müssen jedoch auch bei den neueren pegylierten Formulierungen Berücksichtigung finden. Daher ist ein vorsichtiger Einsatz geboten, und ein gewisser Prozentsatz der Patient:innen wird keine IFN-Therapie in Anspruch nehmen können bzw. diese abbrechen müssen.
Studiendaten zu Ruxolitinib
Im Bereich der JAK-Inhibition verglich die randomisierte MAJIC-PV-Studie bei Hochrisikopatient:innen Ruxolitinib als Zweitlinientherapie mit BAT.11 Ebenso wie IFN verlängerte Ruxolitinib das EFS (HR: 0,58; p=0,03). Die Ergebnisse unterstreichen zudem die Bedeutung umfassender Blutbildkontrollen, da das Ereignisrisiko unabhängig von der Art der Therapie bei Patient:innen, die innerhalb von zwölf Monaten eine komplette Remission erreichten, um 59% reduziert war. Dies bekräftigt die Bedeutung von Kontrollen der Leukozyten und Thrombozyten zusätzlich zum Monitoring der Hämatokritwerte.
Darüber hinaus wurde neuerlich eine Assoziation zwischen anhaltender MR und EFS evident, wobei auch progressionsfreies Überleben und Gesamtüberleben unabhängig von der Behandlung mit der MR korrelierten. Dies stellt unser Konzept der Krankheitskontrolle bei PV infrage und verschiebt den Fokus auf die MR. Im Labor festgestellte Reduktionen der JAK2V617Fpositiven Stammzellen deuten auf einen molekular modulierenden Effekt von Ruxolitinib auf Stammzellebene hin. Das Sicherheitsprofil der Substanz umfasst unter anderem Gewichtszunahme, Cholesterinanstiege, Immunsuppression und die Entwicklung kutaner Plattenepithelkarzinome. Im Gegensatz zu IFN ist ein sicherer Einsatz während der Schwangerschaft nicht möglich.
Zukunftsperspektiven
Derzeit befindet sich eine Reihe neuer Wirkstoffe für die Behandlung der PV in klinischer Entwicklung. Rusfertid, Sapablursen und Divesiran setzen am HepcidinSignalweg an, Givinostat ist ein Pan-HDAC-Inhibitor und Bomedemstat ein LSD1-Inhibitor. Alle diese Wirkstoffe werden aktuell in der Phase II oder III geprüft. JAK2-Inhibitoren mit höherer Spezifität wie JAK2V617F-selektive Substanzen und Typ-II-Inhibitoren könnten die Wirksamkeit und Sicherheit im Vergleich zu den etablierten Präparaten verbessern.
Unter Einsatz aller neuen Wirkstoffe lässt sich eine Einflussnahme auf den natürlichen Verlauf der PV andenken; bereits jetzt ist dies bis zu einem gewissen Grad möglich. In Zukunft könnte die MR als Marker Einsatz finden, wenngleich der Implementierung eine Validierung im Labor sowie als klinischer Endpunkt vorausgehen muss. Vorerst kommt weiterhin den umfassenden Blutbildkontrollen Bedeutung zu, ebenso wie dem Management der kardiovaskulären Risikofaktoren und der Toxizität der Therapie.
Literatur:
1 Titmarsh GJ et al.: How common are myeloproliferative neoplasms? A systematic review and meta-analysis. Am J Hematol 2014; 89(6): 581-7 2 Pereira A et al.: Excess mortality in polycythemia vera and essential thrombocythemia. Blood 2018; 132(Suppl 1): 3042 3 Landolfi R et al.: Efficacy and safety of low-dose aspirin in polycythemia vera. N Engl J Med 2004; 350(2): 114-24 4 Marchioli R et al.: Cardiovascular events and intensity of treatment in polycythemia vera. N Engl J Med 2013; 368(1): 22-33 5 Barbui T et al.: In contemporary patients with polycythemia vera, rates of thrombosis and risk factors delineate a new clinical epidemiology. Blood 2014; 124(19): 3021-3 6 Antithrombotic Trialists’ (ATT) Collaboration: Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009; 373(9678): 1849-60 7 Enblom-Larsson A et al.: Thromboembolic events, major bleeding and mortality in essential thrombocythaemia and polycythaemia vera – a matched nationwide population-based study. Br J Haematol 2024; 204(5): 1740-51 8 Gisslinger H et al.: Event-free survival in patients with polycythemia vera treated with ropeginterferon alfa-2b versus best available treatment. Leukemia 2023; 37(10): 2129-32 9 Abu-Zeinah G et al.: Interferon in polycythemia vera yields improved myelofibrosis-free and overall survival. Blood 2020; 136(Suppl 1): 31-2 10 De Oliveira RD et al.: Interferon-alpha therapy discontinuation is feasible in myeloproliferative neoplasm patients with complete hematological remission. Blood 2020; 136(Suppl 1): 35 11 Harrison CN et al.: Ruxolitinib versus best available therapy for polycythemia vera intolerant or resistant to hydroxycarbamide in a randomized trial. J Clin Oncol 2023; 41(19): 3534-44
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...