Das Management der akuten lymphoblastischen Leukämie
Bericht:
Dr. med. Norbert Hasenöhrl
Der bispezifische Antikörper Blinatumomab spielt für Patient:innen mitB-Linien-ALL eine immer wichtigere Rolle. Für erwachsene Patient:innen mit rezidivierter oder refraktärer ALL stehen CAR-T-Zell-Therapien zur Verfügung. Im Forschungsrahmen werden CAR-T-Zell-Therapien auch für die T-Linien-ALL evaluiert.
Keypoints
-
Bei BCR-ABL1-negativer B-ALL verlängert Blinatumomab das OS auch bei Erreichen einer MRD-Negativität nach Induktionstherapie.
-
Die Kombination von Ponatinib und Blinatumomab ist sicher und wirksam bei neu diagnostizierten Patient:innen mit Ph+-ALL.
-
Mit der Zulassung von Brexucabtagen-Autoleucel hat sich das therapeutische Armamentarium für die Behandlung der R/R B-Linien-ALL im Erwachsenenalter vergrössert.
-
Im Forschungsrahmen werden CAR-T-Zellen für neue Indikationen wie z.B. T-ALL untersucht bzw. auch CAR-T-Zellen von allogenen Spender:innen evaluiert.
Die akute lymphoblastische Leukämie (ALL) war das Thema von Prof. Dr. med. Vera Ulrike Bacher, Hämatologin am Inselspital in Bern, beim 14. Swiss Summit on Hemato-Oncology (SSHO).
Management der neu diagnostizierten ALL
Die Rezidivraten bei ALL sind auch bei modernen Therapieprotokollen immer noch relativ hoch. Ausserdem haben klassische, seit Jahrzehnten eingesetzte Zytostatika in der Regel starke Nebenwirkungen. «Mit antikörperbasierten Immuntherapien und Kinaseinhibitoren versucht man deshalb, die Rezidivraten bei ALL zu senken und gleichzeitig die Verträglichkeit der Therapie zu verbessern», erklärte Prof. Bacher. Eine neuere Substanz ist Blinatumomab, ein bispezifisches Molekül (Targets: CD3 an T-Zellen und CD19 an B-Zellen), das T-Zellen aktiviert und in die Nähe von B-Zellen bringt. Die U.S. Food and Drug Administration (FDA) hat Blinatumomab für refraktäre bzw. rezidivierte B-Linien-ALL oder für Patient:innen, die eine morphologische Remission erreicht haben, aber MRD-positiv sind («minimal residual disease»), zugelassen. «Dies sind Patient:innen, bei denen man mit molekularen oder flowzytometrischen Methoden noch leukämische Zellen findet», erläuterte die Hämatologin.
In einer Studie wurde nun bei MRD-negativen Patient:innen die Zugabe von Blinatumomab zur Konsolidierungs-Chemotherapie mit Chemotherapie (CT) alleine verglichen. Hier zeigte sich eine signifikante Verlängerung des Gesamtüberlebens (OS) durch den Antikörper.1 «Wenn sich dieser Effekt in weiteren Studien bestätigt, könnte die Kombination von Blinatumomab mit Konsolidierungs-CT der neue Standard in der Behandlung der BCR-ABL1-negativen ALL werden», so Bacher.
Patient:innen mit einer Philadelphia-Chromosom-positiven (Ph+) B-Linien-ALL zeichnen sich durch eine Fusion zwischen den Chromosomen 9 und 22 aus. In einer Phase-II-Studie wurden Patient:innen mit neu diagnostizierter Ph+-ALL sowohl mit Blinatumomab als auch mit dem Tyrosinkinaseinhibitor (TKI) Ponatinib behandelt.2 «Hingegen wurde auf konventionelle Chemotherapeutika verzichtet, die den Nachteil der Kardiotoxizität aufweisen», erläuterte Bacher. Die Patient:innen erhielten bis zu fünf Zyklen Blinatumomab, weiters wurde Ponatinib in einer Dosis von 30mg während des ersten Zyklus gestartet, sobald der primäre Endpunkt komplettes molekulares Ansprechen (CMR) erreicht war, auf 15mg reduziert und dann mindestens fünf Jahre weitergeführt. Zugleich wurde eine intrathekale Prophylaxe verabreicht (alternierend Cytarabin und Methotrexat).2
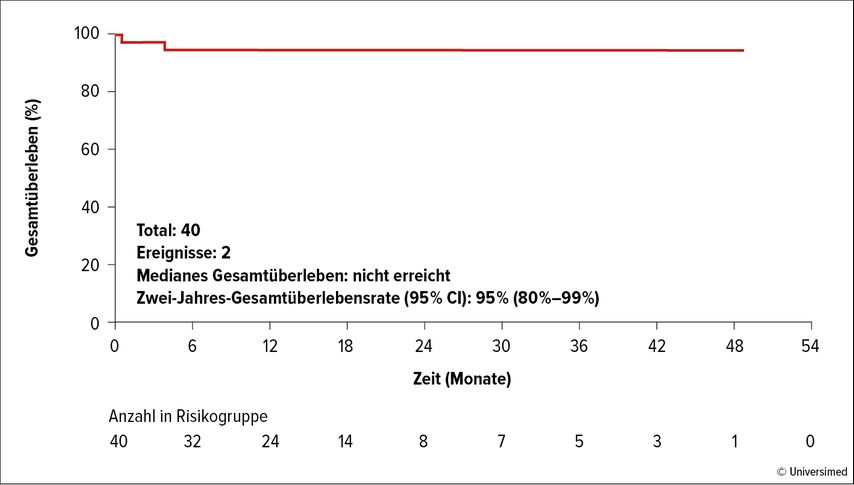
Von 28 Patient:innen erreichten 96% ein hämatologisches Ansprechen (komplettes Ansprechen oder komplettes Ansprechen mit inkompletter Erholung der Zellzahlen [CR/CRi]). Das molekulare Ansprechen trat schnell auf – nach zwei Wochen hatten 75% eine CMR erreicht. Insgesamt erreichten 87% irgendwann eine CMR. Die geschätzte Rate des ereignisfreien Überlebens nach zwei Jahren und die OS-Rate lagen bei 95% (Abb. 1). Rezidive und leukämieassoziierte Todesfälle traten nicht auf. Die Therapie wurde gut vertragen, die meisten Toxizitäten waren von Grad 1 und 2, Nebenwirkungen der Grade 4 und 5 traten nicht auf.2
Rezidivierte oder refraktäre ALL
Bei refraktärer bzw. rezidivierter (R/R) B-Linien-ALL haben vor allem die Behandlungen mit CAR-T-Zellen therapeutische Fortschritte gebracht. «Diese Therapien waren allerdings bisher bei ALL – im Gegensatz zu hochmalignen Lymphomen – nur für Kinder, Jugendliche und junge Erwachsene bis 25 zugelassen», schränkte die Expertin ein.
ZUMA-3 war eine Phase-II-Studie, in der das CAR-T-Zell-Produkt KTE-X19 (Brexucabtagen-Autoleucel) bei Patient:innen ≥18 Jahre mit R/R B-Vorläufer-ALL untersucht wurde. Die Patient:innen mussten entweder eine primär therapierefraktäre Erkrankung oder ein Rezidiv innerhalb von zwölf Monaten nach Erstremission oder eine R/R Erkrankung nach zwei systemischen Therapielinien oder eine R/R Erkrankung ≥100 Tage nach allogener Stammzelltransplantation (SCT) aufweisen.3
Bei 92% der 71 Teilnehmer:innen konnten die CAR-T-Zellen erfolgreich hergestellt werden; 77% (n=55) erhielten sie dann auch. «Das hat damit zu tun, dass ein Teil der Patient:innen sich vor Erhalt der CAR-T-Zellen schon verschlechtert hatte oder verstorben war», erklärte Bacher. «Und die Herstellung der CAR-T-Zellen kann bei Patient:innen mit hoher Krankheitslast manchmal leider auch misslingen.»
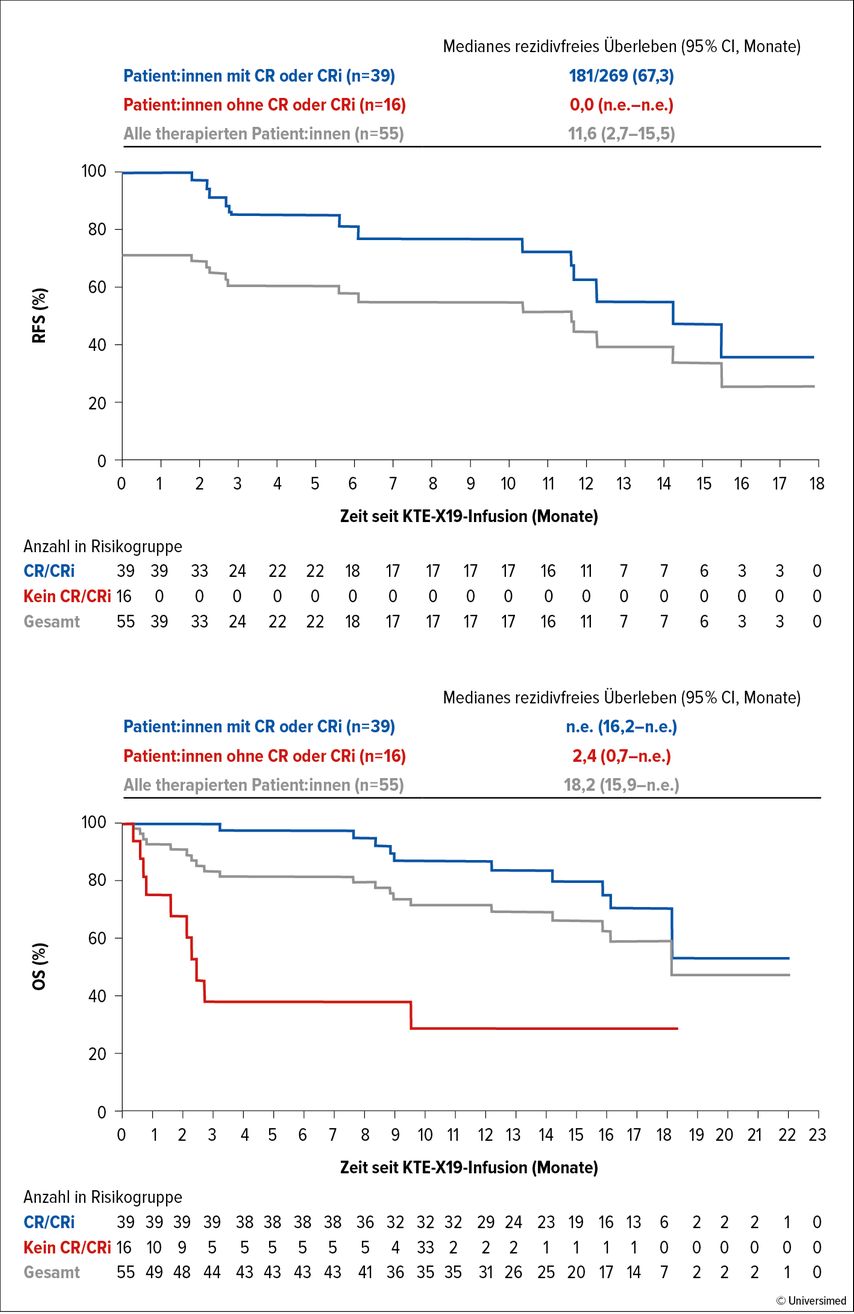
70,1% (n=39) der Patient:innen, die CAR-T-Zellen erhielten, erreichten eine CR/CRi, 56% eine CR. Die mediane Remissionsdauer lag bei 12,8 Monaten, das mediane rezidivfreie Überleben (RFS) bei 11,6 Monaten, das mediane OS bei 18,2 Monaten. Unter den Respondern war das mediane OS noch nicht erreicht; 97% von ihnen waren MRD-negativ (Abb. 2).3
Abb. 2: Rezidivfreies Überleben (RFS) und Gesamtüberleben (OS) in der ZUMA-3-Studie. Modifiziert nach Shah BD et al.3
Das Sicherheitsprofil war handhabbar und entsprach etwa dem, das von CAR-T-Zell-Behandlungen schon bekannt war. 49% entwickelten eine Anämie ≥Grad 3, 36% Fieber, 25% Infektionen ≥Grad 3. Ein Zytokinfreisetzungssyndrom (CRS), eine bekannte Komplikation von Immuntherapien, trat bei 24% auf.3
«Man fand eine Korrelation zwischen der Konzentration an CAR-T-Zellen im peripheren Blut und den Remissionsraten», ergänzte die Expertin, «allerdings hatten Patient:innen mit mehr peripheren CAR-T-Zellen auch vermehrt CRS und neurologische Komplikationen.»
Die ZUMA-3-Studie führte in den USA zur Zulassung von Brexucabtagen-Autoleucel bei erwachsenen Patient:innen mit R/R ALL. Auch in der EU gibt es eine solche Zulassung. In der Schweiz gilt die Zulassung für das R/R Mantelzelllymphom und für R/R B-ALL >25 Jahre. Es existiert zudem eine Reihe von Studien, in denen andere CAR-T-Zell-Produkte bei dieser Erkrankung evaluiert wurden.4
Weiterentwicklung der CAR-T-Zell-Therapien
Die bisherigen Ansätze der CAR-T-Zell-Herstellung beruhten auf der Verwendung patient:inneneigener T-Zellen. Dies ist aber, wie erwähnt, nicht bei allen Patient:innen möglich. Zudem dauert, selbst wenn alles funktioniert, der gesamte Prozess von Leukapherese und Herstellung der CAR-T-Zellen samt den Transportwegen einige Wochen.
Um diesen Problemen zu begegnen, hat man begonnen, allogene CAR-T-Zellen aus Proben gesunder Spender:innen zu entwickeln, die dann fertig zur Verfügung stehen. UCART19 ist ein solches Produkt, also eine allogene T-Zelllinie mit chimärischem Anti-CD19-Rezeptor. Es wurde in einer internationalen Phase-I-Studie (CALM) bei 25 Patient:innen mit R/R B Zell-ALL evaluiert.5
«Man muss sagen, dass die Toxizität hier etwa jener entsprach, die man von autologen CAR-T-Zellen kennt», kommentierte Bacher. Ein Patient wies eine leicht akute Graft-versus-Host-Reaktion der Haut (Grad 1) auf.5 «Und auch die Outcomes waren nicht sehr verschieden von den bisher bekannten Resultaten.» Die Gesamtansprechrate (ORR) lag bei 48%, die Ansprechdauer bei 7,4 Monaten, das PFS bei 2,1 Monaten, das OS bei 13,4 Monaten.5
Im pädiatrischen Setting werden CAR-T-Zellen gegen T-ALL evaluiert.6
Schliesslich wurde die «Low-Hypodiploid»(LH)-ALL bei Erwachsenen, eine ALL-Form mit schlechter Prognose, untersucht. Die Autor:innen konnten einen Zusammenhang zwischen der LH-ALL und einer klonalen Hämatopoese mit TP53-Mutationen feststellen.7
Quelle:
Management of acute lymphoblastic leukemia (ALL). Vortrag von Prof. Dr. med. Vera Ulrike Bacher, Klinik für Hämatologie, Inselspital, Bern, am 14th Swiss Summit on Hemato-Oncology (SSHO); 21. September 2023
Literatur:
1 Litzow MR et al.: ASH Annual Meeting 2022; Abstr. #LBA-1 2 Short N et al.: ASH Annual Meeting 2022; Oral Presentation #213 3 Shah BD et al.: KTE-X19 for relapsed or refractory adult B-cell acute lymphoblastic leukaemia: phase 2 results of the single-arm, open-label, multicentre ZUMA-3 study. Lancet 2021; 398(10299): 491-502 4 Frey NV: Approval of brexucabtagene autoleucel for adults with relapsed and refractory acute lymphocytic leukemia. Blood 2022; 140(1): 11-5 5 Benjamin R et al.: UCART19, afirst-in-class allogeneic anti-CD19 chimeric antigen receptor T-cell therapy for adults with relapsed or refractory B-cell acute lymphoblastic leukaemia (CALM): a phase 1, dose-escalation trial. Lancet Haematol 2022; 9(11): e833-43 6 Chiesa R et al.: Tvt CAR7: phase 1 clinical trial of base-edited “universal” CAR7 T cells for paediatric relapsed/refractory T-ALL. Blood 2022; 140(Suppl. 1): 4579-80 7 Kim R et al.: Adult low-hypodiploid acute lymphoblastic leukemia emerges from preleukemic TP53-mutant clonal hematopoiesis. Blood Cancer Discov 2023; 4(2): 134-49
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...