Das operative Management beim Endometriumkarzinom
Autorinnen:
Dr. med. Fabienne Schwab
Kaderärztin gynäkologische Onkologie und Senologie
Frauenklinik, Universitätsspital Basel
E-Mail: Fabienne.Schwab@usb.ch
PD Dr. med. Céline Montavon Sartorius
Leitende Ärztin Gynäkologische Onkologie
Leiterin Gynäkologisches Tumorzentrum
Frauenklinik, Universitätsspital Basel
E-Mail: Celine.Montavon@usb.ch
Vielen Dank für Ihr Interesse!
Einige Inhalte sind aufgrund rechtlicher Bestimmungen nur für registrierte Nutzer bzw. medizinisches Fachpersonal zugänglich.
Sie sind bereits registriert?
Loggen Sie sich mit Ihrem Universimed-Benutzerkonto ein:
Sie sind noch nicht registriert?
Registrieren Sie sich jetzt kostenlos auf universimed.com und erhalten Sie Zugang zu allen Artikeln, bewerten Sie Inhalte und speichern Sie interessante Beiträge in Ihrem persönlichen Bereich
zum späteren Lesen. Ihre Registrierung ist für alle Unversimed-Portale gültig. (inkl. allgemeineplus.at & med-Diplom.at)
Das Endometriumkarzinom (EC) ist das sechsthäufigste Karzinom derFrau. 2020 wurde weltweit bei 417000 Frauen diese Diagnose gestellt.1 Durch die Einteilung des EC in molekulare Subgruppen kann eine risikoadaptierte Therapie angestrebt und je nach Subgruppe deeskaliert oder eskaliert werden.
Keypoints
-
Das Endometriumkarzinom wird nach molekularen Eigenschaften in vier Kategorien eingestuft: POLE-Mutation, MSI/MMRd, NSMP und P53-Mutation.
-
Die molekulare Klassifikation wird für die Risikostratifizierung berücksichtigt und beeinflusst somit zunehmend die adjuvante Therapie, jedoch kaum das operative Management.
-
Die minimalinvasive Hysterektomie mit Adnexektomie beidseits ist der Goldstandard im Frühstadium, zusätzlich sollte eine SLN-Dissektion aller Patientinnen als Staging-Verfahren angeboten werden.
-
Der Lymphknotenstatus ist nach wie vor ein wichtiger prognostischer Faktor, der therapeutische Wert der Lymphknotenentfernung konnte bisher jedoch nicht belegt werden.
-
Beim SLN-Mapping sollte Indocyaningrün bevorzugt benutzt und gemäss SLN-Protokoll angewendet werden.
-
Beim fortgeschrittenen primär nicht komplett resezierbaren EC ist eine neoadjuvante platinhaltige Chemotherapie mit anschliessender zytoreduktiver Chirurgie zu erwägen.
-
Prospektive Studien über eine molekular basierte individualisierte operative Therapie sind noch ausstehend.
In der westlichen Welt ist das Endometriumkarzinom (EC) der häufigste gynäkologische Tumor. Die Inzidenz dieser Erkrankung ist steigend. Das Risiko, an EC zu erkranken, steigt mit dem Alter und dem Body-Mass-Index (BMI).2 In der Schweiz sind es jährlich 950 Frauen, die an EC erkranken, und 210 Frauen, die daran versterben. Die 5-Jahres-Überlebensrate liegt in der Schweiz bei 80%.3
Die Einteilung des EC in histologische Subtypen (Typ I und Typ II) aufgrund klinisch-pathologischer Kriterien ist heutzutage ungenügend. Durch die Einführung und Bestimmung molekularer Eigenschaften des EC, auch bereits am Kürettagematerial, kommt der molekularen Biologie des EC eine grosse Bedeutung zu. Bei der histologischen Aufarbeitung sollten mittels Immunhistochemie die MMR-Proteine sowie das p53 und mittels DNA-Sequenzierung die POLE-Mutation bestimmt werden. Basierend auf den TCGA-Arbeiten4 wird das EC molekularbiologisch in vier Gruppen eingeteilt: POLEmut, MMRd, NSMP und p53mut (Abb. 1).
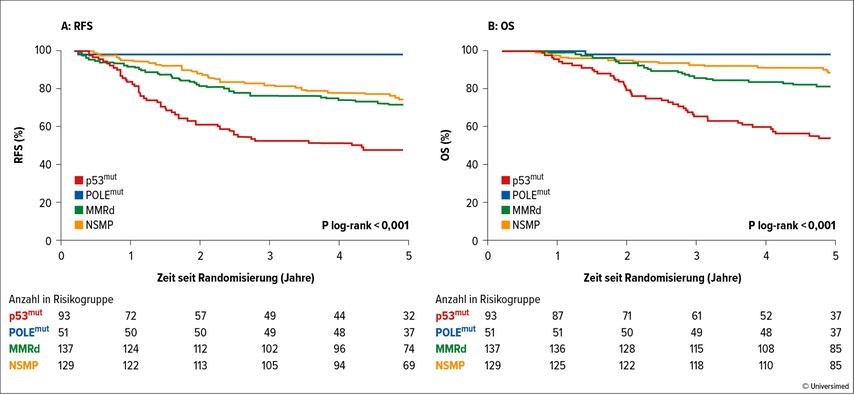
Diese Einteilung ist bedeutungsvoll, da sich die Gruppen prognostisch teilweise stark voneinander unterscheiden. POLE-mutierte EC weisen eine sehr gute Prognose auf und rezidivieren kaum. Dem gegenüber steht das p53-mutierte EC, welches ein aggressives Verhalten zeigt und sich wie das «high grade» seröse Karzinom der Ovarien oder Tuben verhält. Die Einteilung der EC anhand der molekularen Klassifikation in Risikokategorien ist deshalb sinnvoll und beeinflusst wiederum die Intensität der adjuvanten Therapie (Abb. 2).
Abb. 2: Kaplan-Meier-Plot für A: rezidivfreies Überleben (RFS) über fünf Jahre von Patientinnen mit p53-mutiertem Endometriumkarzinom (EC, 48%), Polymerase-mutiertem EC (98%), MMRd- (71,7%) oder NSMP-EC (74,4%), B: Gesamtüberleben (OS) von Patientinnen mit p53-mutiertem EC (54%), Polymerase-mutiertem EC (98%), MMRd- (81,3%) oder NSMP-EC (88,5%). Modifiziert nach León-Castillo A et al.5
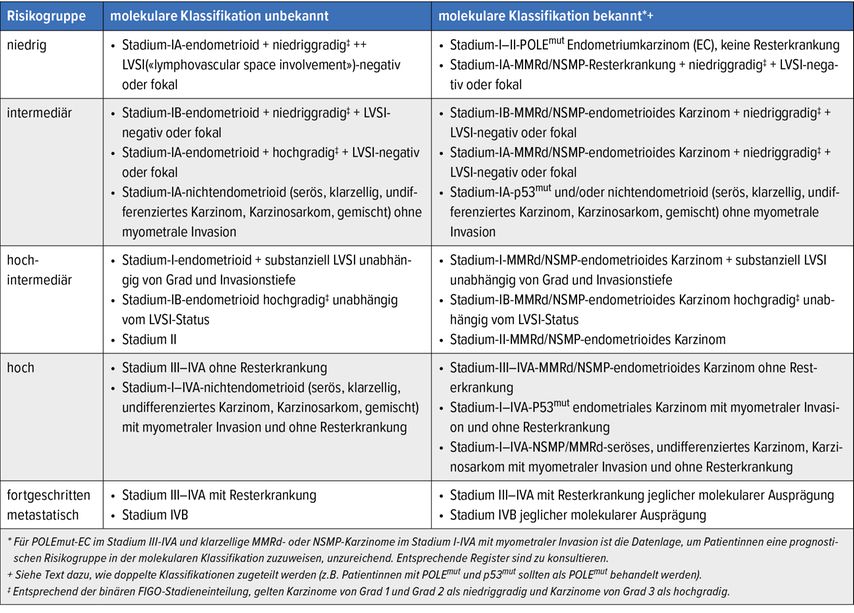
In den 2021 aktualisierten ESGO-ESTRO-ESP-Guidelines zur Behandlung des EC wurden die EC einerseits in Abhängigkeit von den klassischen morphologischen Merkmalen eingeteilt, andererseits mittels molekularen Profils in Risikokategorien stratifiziert. Dabei wurden bekannte prognostische Faktoren wie Stadium, Grad, histologischer Subtyp und LVSI («lymph vascular space invasion») sowie die molekularen Marker berücksichtigt.6 Diese Risikostratifizierung ist ein wesentlicher Bestandteil der Festlegung therapeutischer Strategien beim EC (Tab. 1).
Die prädiktiven Aussagen dieser Faktoren sind jedoch noch unklar. Weitere prospektive randomisierte Studien sollten das genaue Vorgehen bezüglich Eskalation oder Deeskalation der therapeutischen Massnahmen belegen, um eine evidenzbasierte risikoadaptierte Therapie zu fördern und unnötige operative Radikalität sowie Radiotherapie oder Chemotherapie zu verhindern. POLE-mutierte EC werden vermutlich keine adjuvante Therapie benötigen, mikrosatelliteninstabile EC (MSI) mögen eine Immuntherapie vorab erhalten, NSMP-EC («no specific molecular profile») eine endokrine Therapie und p53-mutierte EC eine Chemotherapie. Studien wie PORTEC-4a7 werden uns eine weitere Aufschlüsselung geben.
Auch die Rolle der Radiotherapie sollte in weiteren Studien redefiniert werden. Unter diesem Blickwinkel dürfte das operative Management in Abhängigkeit von den molekularbiologischen Faktoren ebenfalls überdacht werden. Hier sind die Daten jedoch noch spärlicher. Die Radikalität des operativen Vorgehens richtet sich nach wie vor nach den präoperativ vorliegenden prognostischen Faktoren und der Risikostratifizierung.
Operatives Vorgehen
Standard der operativen Therapie des frühen EC sind die Hysterektomie und die bilaterale Adnexektomie, wenn möglich minimalinvasiv.
Die Ausdehnung bzw. die Radikalität der Operation hängt vom Tumorstadium und vom histologischen Subtyp ab. Bei Stadium FIGO I (auf den Uterus begrenzt) bis FIGO II (Infiltration von Zervixstroma) ohne klinischen Verdacht einer Infiltration der Parametrien ist eine einfache Hysterektomie indiziert. Eine radikale Hysterektomie bei Befall des Zervixstromas erhöht die Komplikationsrate, ohne das Outcome der Patientin zu verbessern.8,9 Bei parametraner Infiltration (FIGO IIIB) sollte eine Resektion im Gesunden erzielt und die Radikalität entsprechend angepasst werden.6,10 Die Indikation zur Omentektomie wird bei aggressiver Histologie (serös, undifferenziert und Karzinosarkom) gestellt.11 Die NCCN-Guidelines empfehlen auch bei klarzelligen Karzinomen dieses Verfahren, wohingegen die europäischen Guidelines bei geringer Rate an omentalen Metastasen darauf verzichten.
Bei prämenopausalen Frauen <45 Jahren mit Vorliegen eines niedriggradigen endometrioiden Endometriumkarzinoms mit myometrialer Invasion <50% und ohne offensichtliche ovarielle oder andere extrauterine Erkrankung kann die Erhaltung der Eierstöcke in Betracht gezogen werden, falls keine hereditäre Disposition für Ovarialkarzinom (BRCA, Lynch-Syndrom etc.) vorliegt.6,12,13Die Patientin sollte jedoch über das Risiko des Vorliegens ovarieller Metastasen und eines synchronen Endometrium- und Ovarialkarzinoms aufgeklärt sein. Die bilaterale Salpingektomie wird empfohlen, um das Ovarialkarzinomrisiko zu verringern.14,15 Mit dem Erhalt der Eierstöcke können so bei ausgewählten jungen Patientinnen die unerwünschten Folgen einer chirurgischen Menopause vermieden werden.
Die Peritonealzytologie wird beim FIGO-Staging oder bei der Risikostratifizierung nicht berücksichtigt. Eine positive Peritonealzytologie korreliert jedoch mit schlechten prognostischen Faktoren und schlechteren Überlebensraten.16–18 Zur Zeit ist unklar, ob eine positive Peritonealzytologie die weiteren Therapieentscheidungen beeinflussen sollte.
Jedoch sollten jegliche Zellverschleppung im Abdomen sowie auch jede intraperitoneale Kontamination vermieden werden. Bei grossem Uterus und unmöglicher Bergung in toto sollte eine Bergung über eine Minilaparotomie in Betracht gezogen werden.
Laparoskopie versus Laparotomie
Nach der Publikation der LACC-Studie 2018, die ein schlechteres Überleben bei Patientinnen mit Zervixkarzinom nach laparoskopischer Operation zeigte, wurde die onkologische Sicherheit der Laparoskopie beim EC ebenfalls stark hinterfragt.
Zwei randomisierte kontrollierte Studien (RCT), GOG-LAP219 und der LACE-Trial,20 in denen minimalinvasive mit offenen Eingriffen beim frühen EC verglichen wurden, zeigten ein vergleichbares Risiko für Rezidiv und Überleben mit schnellerer Genesung bei der Laparoskopie.Obwohl ein schlechteres Outcome bei aggressiveren Subtypen (seröses EC oder Karzinosarkome im Vergleich zu G3-endometrioiden EC) gezeigt wurde, sind diese Ergebnisse unabhängig vom operativen Verfahren.21 Zudem zeigten Galaal K et al. in einer aktualisierten Review der Cochrane Library22 (9 RCT mit 4389 Frauen in der Analyse) keine signifikanten Unterschiede im Gesamt- und progressionsfreien Überleben. Die Laparoskopie zeigte weniger operative Morbidität, kürzeren Krankenhausaufenthalt und weniger Blutverlust. Diese Ergebnisse unterstützen die Anwendung der Laparoskopie bei Frauen mit EC im Frühstadium (FIGO I–II). Die Laparoskopie hat sich deshalb auch als Standardverfahren etabliert. Hat sich der Tumor jedoch über den Uterus oder die Zervix hinaus ausgedehnt, wird empfohlen, auf eine minimalinvasive Methode zu verzichten.6
Die robotergestützte Chirurgie bietet ähnliche onkologische Ergebnisse wie die Laparoskopie. Sie zeigte keine Unterschiede in der Dauer der Operation, jedoch kürzere Hospitalisationszeiten, weniger Blutverlust, niedrigere Konversionsraten sowie insgesamt weniger Komplikationen.23,24
Ein wichtiger Aspekt in der Chirurgie des EC ist sicherlich, dass viele Patientinnen zunehmend adipös bis morbid adipös sind, was das Risiko für eine Konversion zu einer Laparotomie erhöht und mehr Morbidität hervorruft.19,25 Cusimano MC et al. konnten in einer Metaanalyse zeigen, dass die robotergestützte Hysterektomie bei Patientinnen mit morbider Adipositas die Zahl der Konversionen verringerte.26 Auch erschwert ein hoher BMI die Sentinelerkennung und zeigt eine signifikant höhere Wahrscheinlichkeit für das «empty bag syndrome» (Lymphknotenentfernung, bei der keine Lymphknoten histologisch nachgewiesen werden).27 Das häufig verwendete Argument gegen eine robotergestützte Chirurgie sind die höheren Kosten,23 wobei wir zeigen konnten, dass ein interdisziplinäres Langzeit-Trainingsprotokoll innerhalb eines «festen» Teams die Effizienz des Verfahrens in Bezug auf Zeit und Kosten verbessert.28
Lymphknotenstaging
Zum Staging gehört das Erfassen der lokoregionären Ausdehnung der Erkrankung und somit auch die Lymphonodektomie (LND). Die LND gehört zum Standardverfahren des chirurgischen Managements des EC, jedoch konnte bisher dafür kein therapeutischer Wert belegt werden. Die zwei grössten randomisierten prospektiven Studien konnten durch die Lymphonodektomie keinen Überlebens-Benefit zeigen.29,30 In der Lymphonodektomie-Gruppe wurden 13% der Patientinnen nach der Operation auf FIGO IIIC hochgestuft. Somit führt die systematische pelvine LND zwar zu einem präziseren chirurgischen Staging, nicht aber zu einer Verlängerung des Überlebens. Die SEPAL-Studie nuancierte diese Aussage.31 Patientinnen mit aggressivem Tumor (hohes Risiko) profitieren von einer systematischen pelvinen und paraaortalen LND mit einer Verlängerung des Gesamtüberlebens; allerdings war diese Studie retrospektiv.
Die erschwerte Vergleichbarkeit der verschiedenen Studien sollte auch in Betracht gezogen werden. Die LND erfolgt öfters in unterschiedlicher Radikalität, teilweise nur pelvin, wenn paraaortal, dann bis zur Arteria mesenterica inferior versus bis zur Vena infrarenalis. Zudem wird manchmal nur ein Sampling von wenigen Lymphknoten durchgeführt. Mit zunehmender Kenntnis der biologischen Tumormerkmale kann sicher in Zukunft das operative Management auch gezielter und individueller angepasst werden. Leider gibt es zum heutigen Zeitpunkt noch keine eindeutigen Biomarker, auf denen eine Eskalation, Deeskalation oder sogar ein Verzicht auf eine operative Massnahme basieren könnte.
Das Sentinellymphknoten(SLN)-Verfahren, welches eine deutlich verringerte Morbidität (Lymphozelen, Lymphödem) im Vergleich zur LND zeigt, wird zunehmend eingesetzt und gilt mittlerweile als Standardverfahren beim EC. Noch umstritten ist dessen alleiniger Einsatz bei der Hochrisiko-Gruppe, wobei der kombinierte Einsatz von SLN-Dissektion und systematischer LND die Detektionsrate um 1% erhöht, ohne Unterschiede im krankheitsfreien (DFS) und Gesamtüberleben (OS).32
In Ergänzung dazu steht eine Multicenterstudie, in der zwischen 2006 und 2013 am Memorial Sloan Kettering Cancer Center das Lymphknotenstaging durch SLN-Entfernung durchgeführt wurde (n=118) und an der Mayo-Klinik zwischen 2004 und 2008 per systematischer LND (n=96).33 Auch wenn sich das Gesamtüberleben nicht signifikant unterschied, hatte die Gruppe mit nodalnegativer SLN-Dissektion ein schlechteres DFS als die nodalnegative Gruppe mit einer systematischen LND. Prospektive Langzeit-Überlebensdaten sind hier notwendig, um die operative Strategie zu klären.
Die ECLAT-Studie (AGO-OP.6) sollte uns hoffentlich diese Fragen beantworten können. Es handelt sich um eine randomisierte, zweiarmige, offene Phase-III-Studie zur Evaluation des Einflusses einer systematischen pelvinen und paraaortalen LND auf die Lebensqualität und das Überleben bei Patientinnen mit Endometriumkarzinom im Stadium I oder II mit hohem Rezidivrisiko.
Die Indikation für eine SLN-Dissektion ist abhängig vom Risikoprofil der Patientin. Die Leitlinien6,10 versuchen diese Nuancen mit sowohl «Kann»- als auch «Soll»-Empfehlungen zum Vorschein zu bringen. Grundsätzlich liegt der Erfolg der SLN-Dissektion im Algorithmus, welcher ein fester Bestandteil des Verfahrens sein sollte. Wenn die klare Darstellung des SLN eines Hemipelvis versagt, muss diese Seite systematisch durch LND untersucht werden. Abstand davon sollte bei niedrigem Risiko (keine/wenige myometrane Infiltration, «low grade», kein «bulky node») genommen werden, da in diesem Fall eine systematische LND eine Übertherapie darstellt.
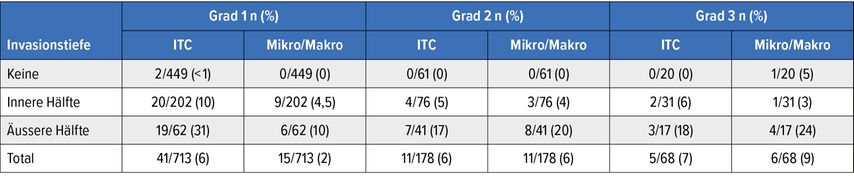
Dennoch sollten die Daten von Praiss AM et al.34 ins Bewusstsein gerufen werden: Bei niedriggradigem endometrioidem EC und positivem LVSI werden in 11–16% der Fälle Lymphknotenmetastasen gefunden. LVSI ist ein wichtiger prognostischer Faktor, der erst postoperativ bekannt wird. Die Studie von Mueller JJ et al.35 mit der Analyse von 959 Patientinnen mit einem endometrioiden EC nach bilateralem Mapping zeigt uns zur weiteren Illustration die niedrige, aber nicht negative Rate an Lymphknotenbefall in der «low grade» Gruppe (G1–G2; Tab. 2).
Tab. 2: Inzidenz von Sentinellymphknotenmetastasen nach Grad und Tiefe der Myometriuminvasion bei endometrioidem Endometriumkarzinom (n=959). Modifiziert nach Mueller JJ et al.35
Technik der Sentinellymphonodektomie (SLND)
Seit der Publikation der ersten prospektiven multizentrischen Studie 2011, welche die Erkennungsrate und diagnostische Genauigkeit der SLN-Dissektion beim Endometriumkarzinom zeigte, hat sich die Technik massiv verbessert und etabliert.36
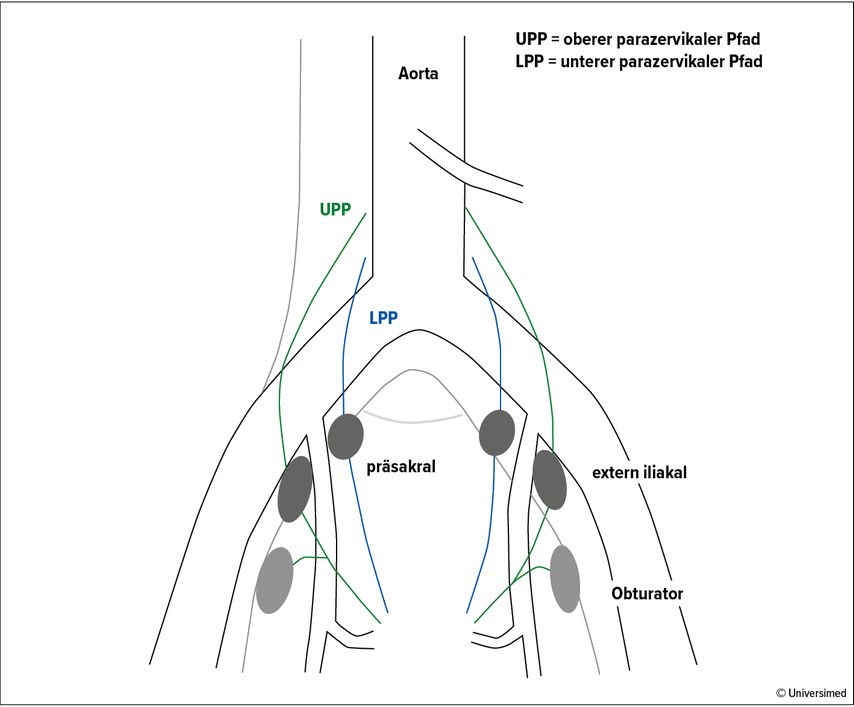
Beim SLN-Mapping wird Indocyaningrün, welches als Mittel der Wahl gilt, submukosal (1–3mm) und stromal (1–2cm) an zwei oder vier Stellen vor Beginn der Laparoskopie oder nach Platzierung der Optik- und Arbeitstrokare in die Zervix gespritzt und mittels Nahinfrarot-Kamera identifiziert. Bei initial fehlgeschlagenem SLN-Mapping kann eine Reinjektion von Indocyaningrün in die Zervix in Betracht gezogen werden. Die verschiedenen Lymphabflusswege (oberer und unterer) sollten dem Operateur vertraut sein, um die Detektionsrate zu optimieren (Abb.3).37,38
Durch Algorithmen, die eine vollständige pelvine Lymphonodektomie des jeweiligen Hemibeckens bei fehlender unilateraler Detektion vorsehen, konnte die Sensitivität auf 95% und der negative Vorhersagewert auf 99% erhöht und die Falsch-negativ-Rate auf 5% erniedrigt werden.39 Da die SLN-Technik operative Erfahrung voraussetzt, wird die erwähnte Erkennungsrate erst nach ca. 30 Fällen erreicht.
Die Frage der Sicherheit der SLN-Dissektion bei Patientinnen mit Hochrisiko-Endometriumkarzinom wurde in einer Reihe von Beobachtungs- und prospektiven Studien untersucht. Die Ergebnisse der SHREC-Studie (2019)37 ähneln den Ergebnissen der Hochrisiko-Untergruppe aus der FIRES-Studie (2017).40 In beiden wurde die falsch-negative Rate mit 2–3% rapportiert. Die histologische Aufarbeitung der Lymphknoten im Ultrastaging-Verfahren ermöglichte eine deutlich höhere Detektionsrate von Lymphknotenmetastasen, die sonst bei der Standardauswertung verpasst werden könnten. Dies führte zu einem Upstaging in 5% der Fälle.39
Das Vorhandensein sowohl von Makro- als auch von Mikrometastasen (<2mm, pN1[mi]) wird als metastatische Beteiligung angesehen. Die prognostische Bedeutung von ITC (isolierte Tumorzellen), pN0(i+), ist zurzeit noch ungewiss.
Ob eine systematische LND bei positiven Lymphknoten indiziert ist, wird kontrovers diskutiert. Die ESGO-ESTRO-ESP-Guidelines empfehlen, bei intraoperativem Befall der pelvinen Lymphknoten auf eine weitere pelvine LND zu verzichten. Allerdings wird auch empfohlen, die Entfernung vergrösserter Lymphknoten und ein paraaortales Staging in Betracht zu ziehen. Dem Lymphknotenstaging wird kein therapeutischer Wert zugeschrieben, sondern die Information für adjuvante Behandlungsentscheidungen.29,30
Maximale Zytoreduktion
Beim Endometriumkarzinom in den Stadien III und IV (einschliesslich Karzinosarkom) und in Abwesenheit von Fernmetastasen sollte eine maximale Zytoreduktion in Betracht gezogen werden. Sie zeigt auch beim Ausbleiben einer groben Resterkrankung bei einer sehr ausgewählten Gruppe von Patientinnen eine bessere Überlebensrate.41
Vergrösserte Lymphknoten sollten reseziert werden, eine systematische Lymphonodektomie wird jedoch nicht empfohlen.6 Solch ausgedehnte zytoreduktive Operationen sollten einem spezialisierten Zentrum zugewiesen werden, da das Endergebnis und die Durchführbarkeit stark von der chirurgischen Expertise abhängen.
Beim fortgeschrittenen, primär nicht komplett resezierbaren EC ist eine neoadjuvante platinhaltige Chemotherapie mit anschliessender zytoreduktiver Chirurgie zu erwägen. Die therapeutische Strategie ähnelt dann der des Ovarialkarzinoms.
Literatur:
1 Sung H et al.: Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021; 71(3): 209-49 2 Crosbie EJ et al.: Endometrial cancer. Lancet 2022; 399(10333): 1412-28 3 Krebsliga Schweiz: Krebs in der Schweiz: wichtige Zahlen. Massgeblicher Zeitraum: 2015-2019 (Jahresdurchschnitt). Stand: Dezember 2022 4 Kandoth C et al.; Cancer Genome Atlas Research Network: Integrated genomic characterization of endometrial carcinoma. Nature 2013; 497(7447): 67-73 5 León-Castillo A et al.: Molecular classification of the PORTEC-3 trial for high-risk endometrial cancer: impact on prognosis and benefit from adjuvant therapy. J Clin Oncol 2020; 38(29): 3388-97 6 Concin N et al.: ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer 2021; 31(1): 12-39 7 Wortman BG et al.: Molecular-integrated risk profile to determine adjuvant radiotherapy in endometrial cancer: evaluation of the pilot phase of the PORTEC-4a trial. Gynecol Oncol 2018; 151(1): 69-75 8 Takano M et al.: Surgery for endometrial cancers with suspected cervical involvement: is radical hysterectomy needed (a GOTIC study)? Br J Cancer 2013; 109(7): 1760-5 9 Liu T et al.: Impact of radical hysterectomy versus simple hysterectomy on survival of patients with stage 2 endometrial cancer: a meta-analysis. Ann Surg Oncol 2019; 26(9): 2933-42 10 S3-Leitlinie Endometriumkarzinom Version 2.0, Update Juli 2022. AWMF-Registernummer: 032/034-OL. Online unter https://www.leitlinienprogramm-onkologie.de/leitlinien/endometriumkarzinom/ . Abgerufen am 8.3.2023 11 Kaban A et al.: Isomentectomy necessary for non-endometrioid endometrial cancer. Gynecol Obstet Invest 2018; 83(5): 482-6 12 Matsuo K et al.: Ovarian conservation and overall survival in young women with early-stage low-grade endometrial cancer. Obstet Gynecol 2016; 128(4): 761-70 13 Wright JD et al.: Utilization and outcomes of ovarian conservation in premenopausal women with endometrial cancer. Obstet Gynecol 2016; 127(1): 101-8 14 Falconer H et al.: Ovarian cancer risk after salpingectomy: a nationwide population-based study. J Natl Cancer Inst 2015; 107(2) 15 Anggraeni TD et al.: Prophylactic salpingectomy and ovarian cancer: an evidence-based analysis. South Asian J Cancer 2018; 7(1): 42-5 16 Lee B et al.: Influence of positive peritoneal cytology on prognostic factors and survival in early-stage endometrial cancer: a systematic review and meta-analysis. Jpn J Clin Oncol 2016; 46(8): 711-7 17 Matsuo K et al.: Significance of abnormal peritoneal cytology on survival of women with stage I-II endometrioid endometrial cancer. Gynecol Oncol 2018; 149(2): 301-9 18 Seagle B-L L et al.: Prognosis and treatment of positive peritoneal cytology in early endometrial cancer: matched cohort analyses from the National Cancer Database. Am J Obstet Gynecol 2018; 218(3): 329.e1-15 19 Walker JL et al.: Laparoscopy compared with laparotomy for comprehensive surgical staging of uterine cancer: Gynecologic Oncology Group Study LAP2. J Clin Oncol 2009; 27(32): 5331-6 20 Janda M et al.: Effect of total laparoscopic hysterectomy vs total abdominal hysterectomy on disease-free survival among women with stage I endometrial cancer: a randomized clinical trial. JAMA 2017; 317(12): 1224-33 21 Fader AN et al.: Impact of histology and surgical approach on survival among women with early-stage, high-grade uterine cancer: an NRG Oncology/Gynecologic Oncology Group ancillary analysis. Gynecol Oncol 2016; 143(3): 460-5 22 Galaal K et al.: Laparoscopy versus laparotomy for the management of early stage endometrial cancer. Cochrane Database Syst Rev 2018; 10(10): CD006655 23 Ind T et al.: A comparison of operative outcomes between standard and robotic laparoscopic surgery for endometrial cancer: a systematic review and meta-analysis. Int J Med Robot 2017; 13(4) 24 Mäenpää MM et al.: Robotic-assisted versus traditional laparoscopic surgery for endometrial cancer: a randomized controlled trial. Am J Obstet Gynecol 2016; 215(5): 588.e1-7 25 Tyan P et al.: Differences in postoperative morbidity among obese patients undergoing abdominal versus laparoscopic hysterectomy for benign indications. J Minim Invasive Gynecol 2020; 27(2): 464-72 26 Cusimano MC et al.: Laparoscopic and robotic hysterectomy in endometrial cancer patients with obesity: asystematic review and meta-analysis of conversions and complications. Am J Obstet Gynecol 2019; 221(5): 410-28.e19 27 Vargiu V et al.: Impact of obesity on sentinel lymph node mapping in patients with apparent early-stage endometrial cancer: the ObeLyX study. Gynecol Oncol 2022; 165(2): 215-22 28 Vigo F et al.: An interdisciplinary team-training protocol for robotic gynecologic surgery improves operating time and costs: analysis of a 4-year experience in a university hospital setting. J Robot Surg 2022; 16(1): 89-96 29 Benedetti Panici P et al.: Systematic pelvic lymphadenectomy vs. no lymphadenectomy in early-stage endometrial carcinoma: randomized clinical trial. J Natl Cancer Inst 2008; 100(23): 1707-16 30 ASTEC study group, Kitchener H et al.: Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial): arandomised study. Lancet 2009; 373(9658): 125-36 31 Todo Y et al.: Survival effect of para-aortic lymphadenectomy in endometrial cancer (SEPAL study): a retrospective cohort analysis. Lancet 2010; 375(9721): 1165-72 32 Bogani G et al.: Uterine serous carcinoma. Gynecol Oncol 2021; 162(1): 226-34 33 Schlappe BA et al.: Multicenter study comparing oncologic outcomes after lymph node assessment via a sentinel lymph node algorithm versus comprehensive pelvic and paraaortic lymphadenectomy in patients with serous and clear cell endometrial carcinoma. Gynecol Oncol 2020; 156(1): 62-9 34 Praiss AM et al.: A modern assessment of the surgical pathologic spread and nodal dissemination of endometrial cancer. Gynecol Oncol 2020; 157(2): 329-34 35 Mueller JJ et al.: Incidence of pelvic lymph node metastasis using modern FIGO staging and sentinel lymph node mapping with ultrastaging in surgically staged patients with endometrioid and serous endometrial carcinoma. Gynecol Oncol 2020; 157(3): 619-23 36 Ballester M et al.: Detection rate and diagnostic accuracy of sentinel-node biopsy in early stage endometrial cancer: a prospective multicentre study (SENTI-ENDO). Lancet Oncol 2011; 12(5): 469-76 37 Persson J et al.: Pelvic sentinel lymph node detection in high-risk endometrial cancer (SHREC-trial) – the final step towards a paradigm shift in surgical staging. Eur J Cancer 2019; 116: 77-85 38 NCCN Guidelines: Uterine Neoplasms. Online unter https://www.nccn.org/guidelines/guidelines-detail?category=1&id=1473 . Abgerufen am 8.3.2023 39 Cormier B et al.; Communities of Practice (CoP) Group of Society of Gynecologic Oncology of Canada (GOC): Sentinel lymph node procedure in endometrial cancer: a systematic review and proposal for standardization of future research. Gynecol Oncol 2015; 138(2): 478-85 40 Rossi EC et al.: A comparison of sentinel lymph node biopsy to lymphadenectomy for endometrial cancer staging (FIRES trial): a multicentre, prospective, cohort study. Lancet Oncol 2017; 18(3): 384-92 41 Shih KK et al.: Surgical cytoreduction in stage IV endometrioid endometrial carcinoma. Gynecol Oncol 2011; 122(3): 608-11
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...