Management der Axilla aus radioonkologischer Sicht
Autor:
PD Dr. med. Guenther Gruber
Institut für Radiotherapie,
Klinik Hirslanden, Zürich
E-Mail: guenther.gruber@hirslanden.ch
Die Behandlung der Axilla ist in den letzten Jahren wieder vermehrt in den Fokus gerückt. Mit zunehmendem Verzicht auf eine axilläre Dissektion wird nun auch häufig die axilläre respektive regionäre Radiotherapie diskutiert. Dabei ist eine Antwort auf dieFrage nach dem «Wie» und «Wann» – insbesondere nach neoadjuvanter Systemtherapie – nicht immer einfach.
Bei der Behandlung der Axilla beim nodal-positiven Mammakarzinom hat sich in den letzten Jahren einiges getan. Der zunehmende Verzicht auf eine Axilladissektion (AD) entfachte die Diskussion über die optimalen Bestrahlungsvolumina axillärer Levels. Wenn ich von meinen Kolleginnen und Kollegen gefragt werde, ob ich die Axilla bestrahle, lässt sich dies nicht immer einfach mit einem Ja oder Nein beantworten.
Ein Blick zurück
Der regionäre Lymphabfluss wurde früher häufig mitbehandelt. Dies erfolgte vor dem Einsatz von 3D-Technologien mittels Direkteinstellung oder durchleuchtungsbasiert am Simulator. Zudem wurde radioonkologisch der Lymphabfluss als funktionelle Einheit gesehen (medialer versus lateraler Lymphabfluss). Dies führte sogar so weit, dass wir heutzutage nicht mehr von «supraklavikulär» sprechen, sondern diese Region als Level 4 der Axilla bezeichnen. Wichtig ist: Bei allen relevanten Studien zur Axillabehandlung wurden die jeweiligen axillären Levels1–4 nicht separat konturiert, und es ist deshalb schwierig zu eruieren, welche Dosen die einzelnen Levels ggf. auch akzidentell abbekommen haben. Je nach Schulterposition oder dem «Hochziehen» der kranialen Feldgrenze der tangentialen Bestrahlungsfelder für Brust/Wand werden, insbesondere Level 1 und zu einem kleineren Teil auch Level 2, meist ungewollt mit einer therapeutisch relevanten Dosis belastet. Aktuell laufende Studien zur Axillabehandlung, wie z.B. die TAXIS-Studie,1 haben aus diesem Grund ein radioonkologisches QA-Programm inkludiert, bei dem dieser Aspekt hinsichtlich klinischer Relevanz speziell analysiert werden wird.
Das Problem mit ACOSOG Z0011
Auslöser dafür, sich vermehrt Gedanken über das genaue Ausmass des regionären Bestrahlungsgebiets zu machen, waren die Ergebnisse der Z0011-Studie.2 Selbst bei Verzicht auf eine AD bei 1–2 Makrometastasen war die axilläre Rezidivrate sehr gering und vergleichbar mit der alleinigen Sentinel-Lymphonodektomie (SLND). Aufgrund der Vermutung, dass «weniger OP» evtl. durch die adjuvante Radiotherapie kompensiert werden konnte, wurden die Bestrahlungsunterlagen angefordert mit dem Versuch, insbesondere die axilläre Dosisabdeckung zu rekonstruieren. Dabei zeigte sich ein erschreckendes Bild: Nur 605 von 856 Case-Report-Forms wurden bzgl. Radiotherapie ausgefüllt und lediglich von 228 Patientinnen wurden die Bestrahlungsunterlagen zugesandt.3 Das Versenden von Bestrahlungsunterlagen stellt heutzutage keine Herausforderung dar (und war gemäss Studienprotokoll sogar «on demand» vorgesehen), weshalb ich mir die Vermutung erlaube, dass etliche Radioonkologen erst im Nachhinein von der Studienteilnahme erfahren haben.
Ausserhalb von Studien war zu damaliger Zeit eine zusätzliche regionäre Bestrahlung bei 1–2 Makrometastasen, insbesondere im Arm ohne AD, sehr wahrscheinlich. Selbst bei den analysierbaren Daten wurde in knapp 20%, entgegen dem Studienprotokoll, welches lediglich eine tangentiale Brustbestrahlung vorsah, auch periklavikulär bestrahlt.3 Die Schlussfolgerung, dass bei 1–2 Makrometastasen nach SLND eine tangentiale Brustbestrahlung – ggf. unter Einschluss der unteren axillären Levels – ausreicht, steht meines Erachtens auf wackligen Beinen.
Status praesens
Die Resultate der Studien Z0011 und insbesondere AMAROS4 und OTOASAR5 (cN0 mit positivem Sentinel), welche die Isoeffektivität der regionären Radiotherapie hinsichtlich Tumorkontrolle bei signifikant weniger Armlymphödemen im Vergleich zur AD zeigen konnten, haben dazu geführt, dass eine AD nur noch bei Patientinnen mit klinisch nodal-positiver Situation (cN+) als indiziert erachtet wird. Die aktuell laufende TAXIS-Studie1 soll diese Fragestellung klären. Gemäss Studienprotokoll ist in beiden Behandlungsarmen eine lokoregionäre Radiotherapie vorgesehen, im Arm mit AD unter (bestmöglicher) Aussparung von Level 1/2. Im Alltag bestrahlen wir die Axilla gerne bei positivem Sentinel, wobei man sich bei Mikrometastasen wohl auch auf die unteren axillären Levels beschränken darf oder im Falle einer Mastektomie ggf. ganz auf die Radiotherapie (RT) verzichtet. Dieser Entscheid sollte aber nicht unabhängig von weiteren Parametern, insbesondere der Tumorbiologie, erfolgen. Nach AD ist eine Radiotherapie dissezierter Levels nicht indiziert.
Das Problem der Überbehandlung
Wir wissen, dass bei positivem Sentinel im Rahmen einer AD in ca. 30–40% der Fälle weitere Lymphknoten(LK)-Metastasen zum Vorschein kommen können.2,4 Adjuvante Therapien haben wahrscheinlich mitgeholfen, dass sich der Verzicht auf eine AD nicht negativ auf Überlebensendpunkte ausgewirkt hat. Wie immer in der adjuvanten Situation muss aber von einer massiven Überbehandlung ausgegangen werden.
Darf bei exzellentem Ansprechen auf eine neoadjuvante Systemtherapie auf eine zusätzliche RT verzichtet werden? Retrospektive Daten z.B. der NSABP-Studie deuten darauf hin.6 Eine Risiko-adaptierte Deeskalation der RT wurde prospektiv im Rahmen eines Konsensus-basierten Studienprotokolls evaluiert (RAPCHEM; BOOG 2010-03):7 Bei 1–3 verdächtigen LK wurden insbesondere aufgrund des Ansprechens auf die neoadjuvante Systemtherapie drei Risikogruppen definiert. Dabei wurde bei «low risk» (ypN0 nach SNLD oder AD; 291 von insgesamt 838 Pat.) bewusst auf eine regionäre RT verzichtet. Unabhängig von der Risikogruppe war die 5-Jahres-lokoreg. Rezidivrate exzellent (2,2%). Und doch sind die Daten schwierig zu interpretieren. 80% der «Low risk»-Pat. hatten eine AD, welche bei ypN0 eigentlich nicht mehr gemacht wird, und ca. 40% hatten letztlich doch «mehr» RT erhalten, als vom Studienprotokoll angedacht.7 Doch es gibt auch Daten, die für eine zusätzliche Radiotherapie selbst nach Mastektomie sprechen: In einer Zusammenstellung von Montero et al. 20198 betrug das mediane lokoregionäre Rückfallrisiko nach Erreichen einer ypN0-Situation 3% mit versus 24% ohne zusätzliche RT.
Behandlungsrichtlinien
Unabhängig vom Operationsausmass lokal (Brusterhaltung; Mastektomie) wird in der aktuell gültigen NCCN-Guideline Version 4.20229 nach neoadjuvanter Systemtherapie eine lokoregionäre RT bei Resttumor in der Axilla empfohlen. Selbst bei Konversion der Axilla von initial cN1 zu ypN0 sollte man eine solche ernsthaft in Betracht ziehen. Die aktuelle S3-Leitlinie10 bringt dabei zusätzliche Risikokriterien mit ins Spiel: prämenopausale Patientin, zentraler od. medialer Tumorsitz, G2/3, ER/PR-Negativität etc.
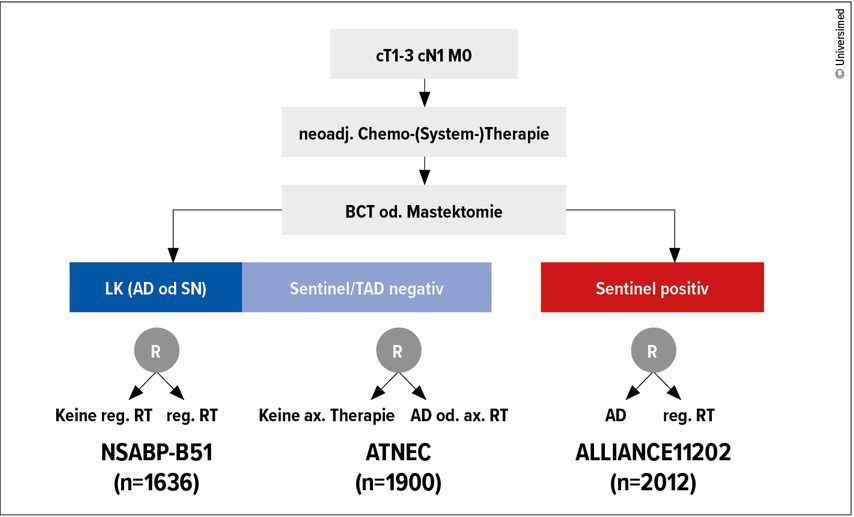
Fazit: ein Blick in die Zukunft
Das optimale Management der Axilla, v.a. nach neoadjuvanter Systemtherapie, ist nach wie vor unklar. Neben der erwähnten TAXIS-Studie, welche bei vorgesehener lokoregionärer RT den Verzicht auf eine AD bei klinisch positiver Axilla prüft und auch Patientinnen mit neoadjuvanter Systemtherapie einschliesst, wurden mehrere wichtige Studien aufgelegt, um die derzeit drängendsten Fragen zu klären. Eine kleine Übersicht gibt Abbildung 1: So werden etwa im Alliance-A11202-Trial Patientinnen mit axillärem Resttumor im Sentinel nach neoadjuvanter Systemtherapie randomisiert zu einer zusätzlichen AD versus lokoregionäre RT. Patientinnen mit negativem Sentinel bzw. markiertem LK erhalten in der ATNEC-Studie entweder keine weitere axilläre Therapie oder eine aktive Therapie mit AD oder lokoregionärer RT. In der Studie NSABP-B51 werden Patientinnen mit negativem Sentinel (+/– AD) zu einer lokoregionären RT bzw. deren Verzicht randomisiert. Lediglich für die letztgenannte Studie wurde die Rekrutierung der Patientinnen abgeschlossen, die oben erwähnten Fragen werden uns deshalb noch etliche Jahre begleiten.
Abb. 1: Wichtige laufende Studien zur optimalen axillären Behandlung beim nodal-positiven Mammakarzinom nach neoadjuvanter Systemtherapie, entweder bei ypN0 (NSABP-B51; ASTEC) oder ypN+(sn) (Alliance 11202). AD = Axilladissektion; reg. RT = regionäre Radiotherapie
Literatur:
1 Weber WP et al.: Tailored axillary surgery in patients with clinically node-positive breast cancer: Pre-planned feasibility substudy of TAXIS (OPBC-03, SAKK 23/16, IBCSG 57-18, ABCSG-53, GBG 101). Breast 2021; 60: 98-110 2 Giuliano AE et al.: Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis: The ACOSOG Z0011 (Alliance) Randomized Clinical Trial. JAMA 2017; 318(10): 918-26 3 Jagsi R et al.: Radiation field design in the ACOSOG Z0011 (Alliance) Trial. JClin Oncol 2014; 32(32): 3600-6 4 Bartels SAL et al.: Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer: 10-year results of the randomized controlled EORTC 10981-22023 AMAROS Trial. JClin Oncol 2022; JCO2201565 5 Sávolt Á et al.: Eight-year follow up result of the OTOASOR trial: The optimal treatment of the axilla - surgery or radiotherapy after positive sentinel lymph node biopsy in early-stage breast cancer: A randomized, single centre, phase III, non-inferiority trial. Eur J Surg Oncol 2017; 43(4): 672-9 6 Mamounas EP et al.: Predictors of locoregional recurrence after neoadjuvant chemotherapy: results from combined analysis of National Surgical Adjuvant Breast and Bowel Project B-18 and B-27. J Clin Oncol 2012; 30(32): 3960-6 7 de Wild SR et al.: De-escalation of radiotherapy after primary chemotherapy in cT1-2N1 breast cancer (RAPCHEM; BOOG 2010-03): 5-year follow-up results of a Dutch, prospective, registry study. Lancet Oncol 2022; 23(9): 1201-10 8 Montero Á, Ciérvide R, Poortmans P: When can we avoid postmastectomy radiation following primary aystemic therapy? Curr Oncol Rep 2019; 21(12): 95 9 NCCN Guideline Breast Cancer Version 4.2022, https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf ; Zugriff 07.01.2023 10 S3 Leitlinie Mammakarzinom, Langversion 4.4 – Juni 2021, https://www.leitlinienprogramm-onkologie.de/fileadmin/user_upload/Downloads/Leitlinien/Mammakarzinom_4_0/Version_4.4/LL_Mammakarzinom_Langversion_4.4.pdf ; Zugriff 07.01.2023 11 MA20 Studienprotokoll, https://www.nejm.org/doi/suppl/10.1056/NEJMoa1415340/suppl_file/nejmoa1415340_protocol.pdf ; Zugriff 07.01.2023
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...