LungSummit 2022 Lausanne: Die Highlights
Bericht:
Dr. med. Lydia Unger-Hunt
Zu den Schwerpunkten der diesjährigen Konferenz zählte die Ausweitung der Behandlungsmöglichkeiten beim kleinzelligen und nichtkleinzelligen Lungenkarzinom etwa durch Inhibition von Mutationen oder durch Immuntherapien. Das bessere genetische Verständnis der Tumorerkrankungen stellt nicht nur die Bedeutung der personalisierten Therapie in den Vordergrund, sondern erlaubt auch eine immer gezieltere Auswahl der für eine Behandlung geeigneten Erkrankten.
HER2 + KRAS in NSCLC: nicht mehr «undruggable»
Die zwei Mutationen HER2 und KRAS beim nichtkleinzelligen Lungenkarzinom (NSCLC) galten zwar bislang als «undruggable» – aber nun nicht mehr, berichtet Assoc. Prof. Dr. Jair Bar vom Chaim Sheba Medical Center in Tel Aviv.
Zunächst Grundsätzliches zu den beiden Mutationen: Bei KRAS ist eine Makropinozytose zu beobachten, wodurch KRAS-mutierte NSCLC «en gros» Nährstoffe aus der Umwelt aufnehmen; zudem erzeugen diese Tumoren ein immuninhibitorisches Mikroklima, das den Mangel eines Ansprechens auf Immuncheckpoint-Inhibitoren erklärt.1
Ebenfalls wichtig: Eine KRAS-Mutation tritt nicht alleine auf, sondern üblicherweise zusammen mit Ko-Mutationen wie TCGA, TRACERx und GENIE, die «zweifellos den Phänotyp beeinflussen und diese Tumoren anfällig für die Entwicklung von Resistenzmechanismen machen».2
KRAS-Mutationen zu inhibieren stellte sich vor allem aufgrund der hohen Bindungseffektivität dieses Proteins an GDP/GTP als schwierig heraus. Der erste Erfolg kam erst 2013 mit dem Entdecken der G12C-Mutante und der nachfolgenden Entwicklung des entsprechenden Inhibitors von KRAS-G12C namens Sotorasib:3
In einer Studie erreichte Sotorasib vs. Docetaxel den primären Endpunkt des progressionsfreien Überlebens (PFS): Grundsätzlich waren die Ergebnisse «nicht wesentlich unterschiedlich», so der Kommentar von Prof. Bar.4 Es war jedoch bei Sotorasib eine geringere Verschlechterung der Lebensqualität zu beobachten.
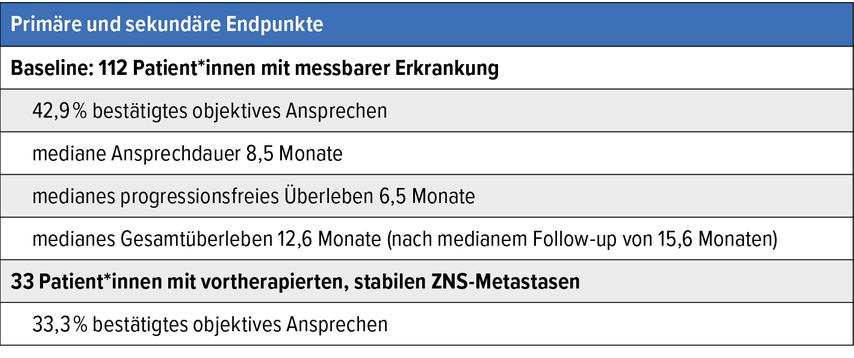
Demgegenüber zeigte ein weiterer KRAS-G12C-Inhibitor namens Adagrasib eine «beeindruckende» Ansprechrate von 43% (Tab. 1).5 Zwar wurden auch bereits Mechanismen erworbener Resistenz nachgewiesen, diese waren aber für die Mutationen jeweils unterschiedlich, was «auf das Fehlen einer Kreuzresistenz hoffen lässt».6
Tab. 1: Primäre und sekundäre Endpunkte von Adagrasib bei NSCLC mit KRAS-G12-Mutation. Modifiziert nach Jänne PA et al. N Engl J Med 2022
Als Alternativen zur KRAS-gerichteten Therapie nennt Prof. Bar «bessere» Moleküle, Membran-Anchoring (KRAS benötigen Membran-Ankerproteine), die Immuntherapie sowie die Up- und Downstream-Inhibition. «Zudem könnte eine SHP2-Inhibierung allein oder synergistisch wirken. Weitere Optionen wie die gleichzeitige Inhibition von KRAS plus jeweils EGFR, MEK beziehungsweise ERK werden derzeit näher beleuchtet», erklärt er.
Die HER2-zielgerichteten Therapien umfassen Tyrosinkinasehemmer (TKI) und Antikörper. Der Anti-HER2-Antikörper Trastuzumab-Deruxtecan wurde kürzlich von der FDA (U.S. Food and Drug Administration) als erste Therapie für HER2-mutierte NSCLC zugelassen. Basis war die DESTINY-Lung01-Studie, in der eine dauerhafte Antitumoraktivität nachgewiesen wurde.7
Der TKI Poziotinib wiederum wird derzeit von der FDA überprüft, zwei Studien dazu sowie zu Kombinationsbehandlungen laufen derzeit. Zudem liegen «interessante Untersuchungen» zur Synergie von Antikörper-Wirkstoff-Konjugaten (ADC) und HER2-TKI vor, «obwohl die Toxizität hier zu stark sein könnte», schränkt Prof. Bar ein.
Immuntherapie bei lokalisiertem NSCLC
Immuntherapien hätten als wesentliches Merkmal das Potenzial einer dauerhaften Remission, sogar bei metastasierter Erkrankung, leitet Univ.-Prof. Dr. Sandip Patel vom UC Moores Cancer Center in San Diego, USA, seinen Vortrag ein. Darauf basiere die Idee, diese Wirkstoffe auch bei nichtkleinzelligem Lungenkarzinom (NSCLC) frühzeitig adjuvant oder neoadjuvant einzusetzen, um ein dauerhaftes Ansprechen zu erreichen.
In einer Studie zur neoadjuvanten Therapie mit Nivolumab + platinhaltiger Chemotherapie vs. platinhaltige Chemotherapie alleine bei Patient*innen mit resezierbarem NSCLC im Stadium IB–IIIA war der primäre Endpunkt des pathologischen kompletten Ansprechens (pCR =0% lebende Tumorzellen in Primärtumor und untersuchten Lymphknoten) unter Nivolumab mit 24,0% vs. 2,2% «wirklich beeindruckend und hochsignifikant besser», so Prof. Patel (Abb. 1).8
Abb. 1: Primärer Endpunkt pCR bei der Gabe neoadjuvanten Nivolumabs + Chemotherapie bei resezierbarem Lungenkarzinom. Modifiziert nach Forde PM et al. N Engl J Med 20228
Wie immer bei neoadjuvanten Ansätzen ist die Sicherheit zu berücksichtigen: Die unerwünschten Ereignisse (AE) waren zwischen den Gruppen sehr ausgeglichen; alle Todesfälle traten in der Chemotherapie-Gruppe (Infektionen) auf, immunbezogene AE wurden nicht registriert. Und: Nach Immuntherapie hatten die Patient*innen weniger Chirurgie-bezogene Komplikationen, was «wahrscheinlich auf den stärker geschrumpften Tumor zurückzuführen» sei, erläutert Prof. Patel.
In einer weiteren Studie erhielten Patient*innen mit NSCLC im Stadium IB–IIIA eine Immuntherapie mit Atezolizumab im adjuvanten Setting. Hier war ein Vorteil hinsichtlich des krankheitsfreien Überlebens (DFS) bis zu zwei Jahre nach der letzten Dosierung zu erkennen, zudem erwies sich die Therapie als «recht sicher» im Vergleich zur «best supportive care» (BSC).9 Allerdings fügt Prof. Patel hinzu: «Zu keiner dieser Studien liegen Daten zum Gesamtüberleben vor, darauf müssen wir noch warten.»
METex14/RET-positiver NSCLC: wichtige Entscheidungsfaktoren
Die therapeutische Landschaft beim nichtkleinzelligen Lungenkarzinom (NSCLC) ist komplex, wobei neue Wirkmechanismen einen zunehmend personalisierten Ansatz erlauben. Damit beginnt der Vortrag von Dr. Jordi Remón vom Gustave Roussy Cancer Center in Villejuif, Frankreich, zum METex14/RET-positiven NSCLC.
Zu den klinischen Merkmalen zählt typischerweise ein medianes Alter von 75 Jahren, Frauen sind etwas häufiger betroffen als Männer, 50% sind Niemals-Raucher und in 80% liegt ein Nicht-Plattenepithelkarzinom vor.10 MET-deregulierte NSCLC (METex14-Mutation, MET-Amplifikation und -Überexpression) sind mit einer schlechten Prognose assoziiert. „Bei Nachweis dieser Mutation ist eine personalisierte Behandlung wirklich wichtig, da dadurch nachweislich das Outcome verbessert werden kann», legt Dr. Remón nahe.11
Mehrere MET-Inhibitoren wurden bereits entwickelt, zunächst nicht selektive (Crizotinib) sowie nachfolgend auch MET-selektive TKI mit höherer intrakranieller Aktivität (Capmatinib, Tepotinib, Savolitinib, Glumetinib). Das Ansprechen liegt bei rund 50%, sowohl in der Erst- als auch in der Zweitlinie, mit Ausnahme von Capmatinib, das «in der Erstlinie eine höhere Aktivität aufzuweisen scheint».12,13
Auf Basis dieser Ergebnisse wurden diese Wirkstoffe von FDA und EMA 2021 bzw. 2022 zugelassen (Tepotinib und Capmatinib nur in der Zweitlinie). Da wie berichtet die meisten Patient*innen älter sind, ist das altersunabhängige Ansprechen unter Tepotinib ein «wichtiges Ergebnis». Ein Alter >75 Jahre könnte möglicherweise mit einem höheren Risiko für Nebenwirkungen verbunden sein, allerdings scheint eine frühere Immuntherapie kein erhöhtes derartiges Risiko mit sich zu bringen.14
Das Toxizitätsprofil wiederum ist recht spezifisch für diese Wirkstoffe: Rund 40% der Behandelten entwickeln eine Grad-3-Toxizität, am häufigsten ein peripheres Ödem mit potenziell starker Beeinträchtigung der Lebensqualität; zwischen sieben und 15% brechen deswegen die Behandlung ab.
Die intrakranielle Aktivität ist wichtig: Mindestens 20% der Patient*innen mit MET-mutiertem Tumor weisen zur Baseline Gehirnmetastasen auf, im Laufe der Erkrankung sind es bis zu 40%, berichtet Prof. Remón. Sowohl Tepotinib als auch Capmatinib haben hier nachweislich Aktivität, mit einer intrakraniellen Ansprechrate von 54% bis 67% und einem intrakraniellen progressionsfreien Überleben (PFS) von 21 Monaten.15,16
Die zukünftige Auswahl der Patient*innen könnte auch aufgrund von zirkulierender DNA (ctDNA) erfolgen: In einer Studie hatten Patient*innen mit METex14-mutierter ctDNA zur Baseline ein schlechteres Outcome unter Crizotinib, während Proband*innen unter Tepotinib bei ctDNA- Clearance ein besseres Outcome zeigten.17,18
Zudem sind bereits Medikamente mit neuem Wirkmechanismus verfügbar, etwa Amivantamab, ein bispezifischer monoklonaler Antikörper gegen EGFR und MET, der in einer Studie eine Ansprechrate von 33% und ein PFS von 6,8 Monaten zeigte.19 «Die Gehirnaktivität ist allerdings nicht bekannt, Amivantamab wird daher andere MET-Wirkstoffe wahrscheinlich nicht verdrängen», schließt Dr. Remón.
Zusätzliche Immuntherapie verlängert Überleben bei SCLC
Das kleinzellige Lungenkarzinom (SCLC) ist ein hochletaler Subtyp mit einem durchschnittlichen Gesamtüberleben (OS) von lediglich 8,6 Monaten, berichtet Dr. Alfredo Addeo vom Universitätskrankenhaus Genf.
Jahrzehntelang blieben vielversprechende Forschungsergebnisse aus, was sich erst 2018 mit der Veröffentlichung der IMpower-133-Studie änderte: Unter Atezolizumab vs. Placebo (jeweils + Standardchemotherapie aus Carboplatin + Etoposid in der Induktionsphase) war der primäre Endpunkt des OS nach zwei Jahren signifikant besser (12,3 vs. 10,3 Monate).20
Im CASPIAN-Trial wiederum wurden der experimentelle PD-L1-Inhibitor Durvalumab und der Anti-CTL4-Wirkstoff Tremelimumab vs. Standard-Chemotherapie (Etoposid-Cisplatin, EP) untersucht.21 Durvalumab + EP in der Erstlinie führte zu einer signifikanten Verlängerung des OS vs. EP alleine, mit einer HR von 0,73 (13,0 vs. 10,3 Monate).
Laut einem Update war der Nutzen auch nach zwei Jahren noch zu beobachten, mit einem OS von jeweils 12,9 Monaten vs. 10,4 Monate, während ein Update nach drei Jahren sogar einen noch größeren Unterschied aufwies, mit 12,9 Monaten vs. 10,5. Die OS-Rate lag bei jeweils 17,6% vs. 5,8%.22,23 «Das unterstreicht die Bedeutung der Immuntherapie in der Erstlinientherapie», so Dr. Addeo.
Die Behandlung war gut verträglich, ohne neue Erkenntnisse bezüglich der Sicherheit. Beide Wirkstoffkombinationen (Carboplatin-Etoposid + Atezolizumab bzw. Platin-Etoposid + Durvalumab) sind seit 2019 bzw. 2020 von EMA und Swissmedic zugelassen und stellen derzeit den Behandlungsstandard bei SCLC dar.
Zu den derzeitigen Herausforderungen zählt die Auswahl derjenigen Patient*innen, die von einer solchen Therapie am ehesten profitieren würden: Entsprechende Biomarker konnten bislang trotz intensiver Forschung nicht identifiziert werden.
Erst- und Zweitlinien-Optionen beikleinzelligem Lungenkarzinom
Über mögliche zusätzliche Optionen zum derzeitigen Behandlungsstandard des kleinzelligen Lungenkarzinoms (SCLC) von Carboplatin-Etoposid + Atezolizumab bzw. Platin-Etoposid + Durvalumab berichtet Assoc. Prof. Dr. Stephen V. Liu vom Georgetown Lombardi Comprehensive Cancer Center in Washington DC:
-
Negative Ergebnisse zeigten sich unter Tiragolumab (Anti-TIGIT) zusätzlich zu Carboplatin, Etoposid, Atezolizumab.24
-
In einer einarmigen Phase-II-Studie führte Lurbinectedin, ein selektiver Inhibitor onkogener Transkriptionsprogramme, zwar zu Ansprechraten von 35% und einem mittleren Überleben von 9,3 Monaten.25 Die randomisiert-kontrollierte Studie von Lurbinectedin (niedrige Dosis, in Kombination mit Doxorubicin) ergab allerdings keinen Überlebensvorteil vs. Topotecan oder vs. Chemotherapie.26
-
Wirkstoffe am Horizont:
-
Liposomales Irinotecan hatte gute Ansprechraten, aber ein negatives Ergebnis bezüglich des Überlebens.27
-
Vielversprechend sind hingegen die Ergebnisse des Anti-DLL3- (auf 85% von SCLC) und Anti-CD3-Antikörpers Tarlatamab, mit einem mittleren Gesamtüberleben von über einem Jahr.28
-
DS-7300, ein B7-H3-Antikörper-Wirkstoff-Konjugat, zeigte Ansprechraten von 53%.29
Fazit: «Wir sehen aktive Wirkstoffe, die uns Hoffnung auf eine bessere Zukunft von SCLC-Patient*innen machen», schließt Prof. Liu.
Factbox
Die Power der Pathologie (Dr. Sabina Berezowska, Universitätskrankenhaus Lausanne, Schweiz)
NSCLC: Marker helfen bei der weiteren Unterscheidung zwischen «eher Adenokarzinom» oder «eher Plattenepithelkarzinom»: TTF1-Positivität und/oder P40-Negativität spricht mehr für Adenokarzinom; sind beide negativ, kann als (einziger) weiterer Marker Zytokeratin eingesetzt werden, um die Karzinomdiagnose zu befestigen (und ein Melanom auszuschließen).
Problem des geringen Tumorzell-Inhalts von Proben: Bei einem Tumorzellinhalt von < 10 % können Mutationen übersehen werden. Um die Validität der molekularen Untersuchungen zu erhöhen, kommt «scraping» (Kratzen) zum Einsatz. Bei dieser manuellen Mikrodissektion wird alles, was nicht Tumor ist, weggekratzt. Damit steigt der Tumorzellanteil von > 20 % auf > 70 %. Die Methode ist zwar arbeitsintensiv, aber führt zu sehr guten Ergebnissen.
Problemlage «Was soll untersucht werden?» beinhaltet:
I. Die Variationen unterschiedlicher nationaler bzw. internationaler Guidelines zu molekularen Zielstrukturen
II. Die Lücke zwischen Real-World-Praxis und technischer Innovation
III. Entscheidungen bezüglich der Kostenrückerstattung unterscheiden sich häufig wesentlich von den EMA ZulassungenNeue «fokussierte» Technologie namens Idylla®:
- Vorteile: sehr einfach und sehr schnell, das Resultat steht innerhalb weniger Stunden fest, ein molekularpathologisches Laboratorium ist nicht erforderlich, das Gerät weist EGFR-, KRAS- und BRAF-Mutationen selbstständig nach.
- Nachteile: Manche Marker werden nur teilweise abgedeckt, und es gibt keine Informationen zur Varianten-Allel-Frequenz (VAF) und zu Co-Mutationen. Für die Praxis könnte das aber entscheidend sein: Laut Studien beeinflussen beispielsweise TP53-Mutationen das Outcome von EGFR-mutierten Patienten, die mit TKI behandelt werden.30
Quelle:
International Lung Cancer Summit 2022, Lausanne
Literatur:
1 Punekar SR et al.: Nat Rev Clin Oncol 2022; 19: 637-55 2 Cai H et al.: Cancer Discovery 2021; PMID: 33608386 3 Ostrem J et al.: Nature 2013; 503: 548-51 4 Johnson ML et al.: Ann Oncol 2022; 33(suppl. 7): S808-69 5 Jänne PA et al.: N Engl J Med 2022; 387: 120-31 6 Awad MM et al: NEngl J Med 2021; 384: 2382-93 7 Li BT et al.: N Engl J Med 2022; 386: 241-51 8 Forde PM et al.: N Engl J Med 2022; 386: 1973-85 9 Wakelee HA et al.: J Clin Oncol 2021; 39: (15_suppl): 8500 10 Lee JK et al.: J Clin Oncol Precision Oncology 2021; 5: 1354-76 11 Leigh et al.: ESMO 2022 12 Wolf J et al.: ASCO 2021; Abstr. #9020 13 Lu S et al.: ELCC 2022: Abstr. #2MO 14 Cortot A et al.: Clin Lung Cancer 2022; 23: 195-207 15 Friese-Hamim M et al.: Lung Cancer 2022; 163: 77-86 16 Garon EB et al.: AACR 2020; Abstr. #CT082 17 Drilon A et al.: Nature Med 2020; 26: 47-51 18 Sanz-García E et al.: Sci Adv 2022; 8(4): eabi8618 19 Krebs M et al.: ASCO 2022; Abstr. #9008 20 Horn L et al.: N Engl J Med 2018; 379: 2220-9 21 Paz-Ares L et al.: Lancet 2019; 394: 1929-39 22 Goldman JW et al.: Lancet Oncol 2021; 22: 51-65 23 Paz-Ares L et al.: ESMO 2022; 7(2): 100408 24 Rudin CM et al.: ASCO 2022; Abstr. #LBA8507 25 Trigo J et al.: Lancet Oncol 2020; 21: 645-54 26 Paz-Ares L et al.: WCLC 2021 27 Paz-Ares L et al.: WCLC 2019 28 Borghael H et al.: WCLC 2022 29 Doi T et al.: ESMO 2022; Abstr. #4530 30 Canale M et al.: Clin Cancer Res 2017; 23: 2195-202
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...