Lokaltherapie nach radiologisch kompletter Remission
Autorin:
OÄ Dr. Theresa Czech
Brustgesundheitszentrum Tirol
Universitätsklinik für Gynäkologie und
Geburtshilfe
Medizinische Universität Innsbruck
E-Mail: theresa.czech@i-med.ac.at
Durch Biopsie oder Bildgebung eine pathologisch komplette Remission (pCR) vorherzusagen wäre eine elegante, kosteneffektive und komplikationsarme Option für Mammakarzinompatientinnen nach systemischer neoadjuvanter Chemotherapie. Leider kann nach derzeitiger Studienlage dieses Prozedere nicht forciert werden – es sind dringend weitere Studien notwendig! Goldstandard bleibt weiterhin die definitive Beurteilung am OP-Präparat.
Das Konzept der „präoperativen Therapie“ bei inoperablen Mammakarzinomen wurde bereits 1973 von Gianni Bonadonna erstbeschrieben. Heute ist es der unangefochtene Behandlungsstandard immer dann, wenn auch postoperativ eine Chemotherapie indiziert ist. Dies betrifft etwa 17–40% aller frühen Mammakarzinome. Traditionelle Indikationen sind lokal fortgeschrittene Tumoren, vor allem dann, wenn keine brusterhaltende Operation möglich ist bzw. wenn sie mit einem ungünstigen kosmetischen Ergebnis assoziiert wäre. Weiters stellt die neoadjuvante Chemotherapie die bevorzugte Therapie bei HER-2-positiven (Stadium II–III) sowie bei tripelnegativen Tumoren dar. Durch neoadjuvante Chemotherapie kann ein Downstaging in Brust und Axilla erreicht werden. Das Konzept „neoadjuvante Therapie“ hat zweifelsohne einen erheblichen klinischen Benefit: Bei inoperablen Tumoren kann Operabilität erreicht werden; es verbessert die Optionen für brusterhaltende Operationen, senkt die Rate an Axilladissektionen und erlaubt eine Individualisierung der Therapie nach Interimsansprechen. Aber auch die onkologischen Vorteile sind nicht zu unterschätzen: Es erlaubt eine In-vivo-Beurteilung des Therapieansprechens, es kann kein Unterschied im Überleben zwischen adjuvanter und neoadjuvanter Therapie (bei gleichem Regime, gleicher Zyklenzahl) gezeigt werden und das Erreichen einer pCR ist ein prädiktiver Surrogatmarker für die Langzeitprognose der Patientin. Und nicht zuletzt ermöglicht eine neoadjuvante Therapie eine Prognoseverbesserung durch Individualisierung der postneoadjuvanten Therapie nach Tumorbiologie analog zu den Studien CREATE-X, APHINITY, KATHERINE, HERA und ExteNET.
pCR nach neoadjuvanter Chemotherapie ist ein starker Surrogatmarker sowohl für das ereignisfreie Überleben (EFS) als auch das Gesamtüberleben (OS) und ist somit prädiktiv für die Langzeitprognose der Patientin. Das Erreichen einer pCR ist stark abhängig vom biologischen Subtyp. Aus den Publikationen von Patricia Cortazar (Lancet, 2014)1 und Cornelia Liedtke (JCO, 2008)2 ist bekannt, dass speziell HER-2-positive und tripelnegative Tumoren mit einer höheren pCR vergesellschaftet sind.
Die Beurteilung der Ansprechrate und damit der pCR sollte durch Methoden mit einer möglichst niedrigen Falsch-negativ-Rate erfolgen. Das heißt, de facto kommen die konventionelle Beurteilung am OP-Präparat sowie (derzeit nur im Rahmen von Studien) die minimalinvasive und bildgebende Beurteilung infrage. Es ist absolut unabdingbar, dass diese Beurteilung akkurat erfolgt; die Konsequenzen für die Patientin sind weitreichend: Bei pCR kann eine Deeskalation der weiteren Therapie erwogen werden: Gegebenenfalls könnte auf eine OP und Radiotherapie verzichtet werden. Hingegen sollte bei Nichtvorliegen einer pCR eine Therapieeskalation empfohlen werden – postneoadjuvante Therapiekonzepte mit T-DM1, dualer Blockade und Capecitabin können angeboten werden. Die diagnostische Sicherheit von Bildgebung und/oder minimalinvasiven Methoden ist abhängig vom molekularen Subtyp, von der Tumorheterogenität, der Biopsienadelgröße und der Anzahl der Biopsien. Je nach molekularem Subtyp reagieren Mammakarzinome ganz unterschiedlich auf die neoadjuvante Chemotherapie: Nonluminale HER-2-positive und tripelnegative Mammakarzinome tendieren zu einem sogenannten „Tumorshrinkage“, während lobuläre und luminale Tumoren einen diffusen Zellverlust erfahren.
Ist eine OP bei bildgebender kompletter Remission verzichtbar?
Somit stellt sich die Frage: Ist es onkologisch sicher, bei bildgebender kompletter Remission auf eine Operation zu verzichten? Vier rezente Studien haben sich mit diesem Themenkomplex befasst:
-
Vrancken et al. präsentierten am SABCS 2019 eine multizentrische prospektive Kohortenstudie. Ziel dieser Studie war es, die Falsch-negativ-Rate der unterschiedlichen Biopsiemethoden zu evaluieren. Es konnte leider gezeigt werden, dass das MRT zu ungenau ist, um eine pCR vorherzusagen. Auch die 14G-Biopsienadel ist nicht ausreichend. Residuelle Tumorreste wurden häufig übersehen. Es ist ganz klar, dass diese Ergebnisse den Verzicht auf eine OP auf Basis von Bildgebung und Tumorbettbiopsie nicht unterstützen.
-
Heil et al. befassten sich mit einer ganz ähnlichen Fragestellung im Rahmen der prospektiven, multizentrischen RESPONDER-Studie. Die Falsch-negativ-Rate der Vakuumsaugbiopsie lag bei 17,8% im gesamten Kollektiv. Immerhin bei 37 von 208 Studienteilnehmerinnen wurde der residuelle Tumorrest verpasst. Allerdings wiesen 51% vermeidbare Gründe wie Protokollverletzungen oder technische Probleme bei der Biopsie auf. Auch diese Studie ist klar negativ zu werten.
-
Die Phase-II-Studie NRG-BR005 (Basik et al.) zeigt ganz klar, dass keine pCR-Prädiktion durch Biopsie möglich ist. Der negativ-prädiktive Wert von ≤90% wurde nicht erreicht. Insgesamt wurden nur 50% der Patientinnen mit residualem Tumor nach neoadjuvanter Chemotherapie zum Zeitpunkt der OP detektiert.
Tasoulis et al. konnten im Rahmen einer gepoolten Analyse jedoch nachweisen, dass, sofern Bildgebung und Biopsie nach neoadjuvanter Therapie einem standardisierten Protokoll folgen, der residuelle Tumor mit einer Falsch-negativ-Rate von weniger als 5% vorhergesagt werden kann.
Es muss ganz klar postuliert werden: Die OP nach neoadjuvanter Therapie bleibt weiterhin Goldstandard – ein Abweichen von diesem Prozedere ist nur im Rahmen von klinischen Studien zulässig.
Ist eine Axilladissektion verzichtbar?
In Bezug auf die axilläre Intervention nach neoadjuvanter Chemotherapie, insbesondere bei initial pathologischem und posttherapeutisch unauffälligem Status der axillärem Lymphknoten, stellt sich eine ähnliche Frage: Kann auf eine Axilladissektion bei posttherapeutisch unauffälligen Lymphknoten verzichtet werden? Um Morbidität – wie axilläre Parästhesien, Plexusverletzungen und Lymphödeme – zu vermeiden, sollte nur wenn unbedingt notwendig eine Axilladissektion durchgeführt werden.
-
ACOSOG Z1071 ist eine prospektive, multizentrische Studie mit insgesamt 756 eingeschlossenen Patientinnen. Die SLN-Detektionsrate lag bei 92,9% und die axilläre pCR bei 41%. Eine ungeplante retrospektive Analyse zeigte, dass prätherapeutische Clipmarkierung des Sentinellymphknotens die Detektionrate steigert und gleichzeitig die Falsch-negativ-Rate senkt.
-
SENTINA ist eine 4-armige prospektive, multizentrische Kohortenstudie, welche ganz klar zeigen konnte, dass zweifache Markierung (radionuklearmedizinischer Tracer + Patentblau) die Detektionsrate steigert. Weiters konnte in SENTINA die Falsch-negativ-Rate durch Entnahme von mehr als 3 Lymphknoten deutlich gesenkt werden.
Auch SN-FNAC hat bewiesen, dass zweifache Markierung die Falsch-negativ-Rate senkt, jedoch auch, dass, falls die HE-Färbung versagt, unbedingt eine Immunhistochemie durchgeführt werden sollte.
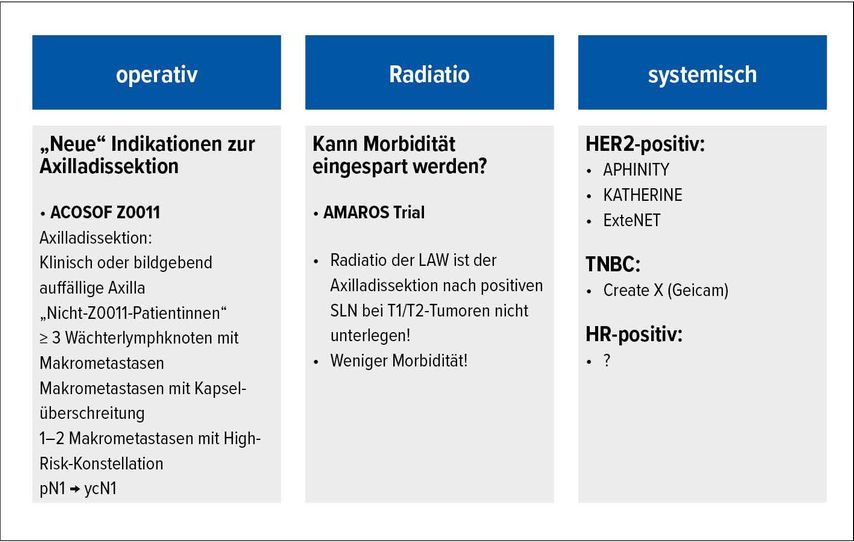
Durch diese neuen Erkenntnisse ergeben sich unterschiedliche Konsequenzen in der klinischen Praxis (Abb. 1).
Fazit
Zusammenfassend kann ganz klar gesagt werden, dass zur Beurteilung des pCR-Status nach neoadjuvanter Chemotherapie weiterhin die Beurteilung am OP-Präparat Standard ist.
Literatur:
bei der Verfasserin
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...