Lokaltherapie der Brust im Jahr 2021
Autorin:
Dr. med. Constanze Elfgen
Fachärztin Gynäkologie und Geburtshilfe
Brust-Zentrum Zürich
Wenn heute bei einer Patientin in der Schweiz ein Mammakarzinom diagnostiziert wird, so sind ihre Chancen auf Heilung sehr hoch.1 Auchkann die Patientin zu Recht erwarten, dass sie zumeist brusterhaltend operiert werden kann und dass dabei die Operationstechniken wie onkoplastischen Verfahren mit deutlich geringeren kosmetischen Einschränkungen einhergehen als Mastektomien oder zum Teil deformierende brusterhaltende Operationen vorangegangener Generationen.2
Keypoint
-
Im Jahr 2021 ist die Lokaltherapie der Brust beim Mammakarzinom eine zunehmend individualisierte Entscheidung, die auf dem Risikoprofil und den Wünschen der Patientin, ihren physischen Gegebenheiten sowie dem Stadium und dem biologischen Profil des Tumors beruht. Die Entscheidungsfindung wird komplexer und erfordert mehr denn je eine interdisziplinäre Zusammenarbeit.
Obgleich die konventionelle Mastektomie eine marginal geringere Langzeit- Lokalrezidivrate im Vergleich zur brusterhaltenden Operation (BCS) aufweist, so zeigen sich keine Unterschiede bezüglich Fernmetastasen, Zweitkarzinomen oder des Gesamtüberlebens.3 Auch die Hautmantel-erhaltende («skin-/nipple-sparing») Mastektomie hat ähnliche oder allenfalls minimal erhöhte Lokalrezidivraten wie die konventionelle Mastektomie.4
Die Deeskalation in der operativen Behandlung
Seit einigen Jahren besteht der Konsens, dass tumorfreie Schnittränder («no ink on tumor») bei primärer Operation ausreichend sind und dass ein grösserer Resektionsrand im Gesunden keine Vorteile bringt.5 Gleiches scheint auch für die neuen Tumorgrenzen nach neoadjuvanter Chemotherapie zu gelten, obgleich bestimmte Risikofaktoren die Lokalrezidivrate nach Operation in den neuen Grenzen erhöhen.6
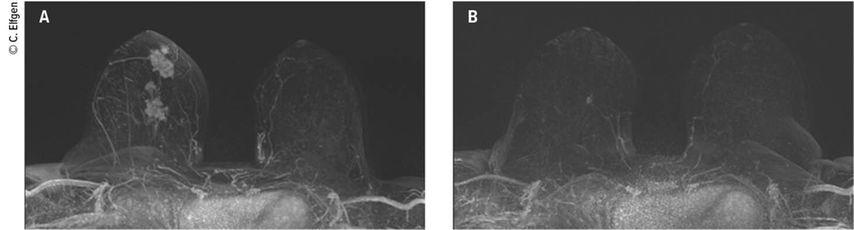
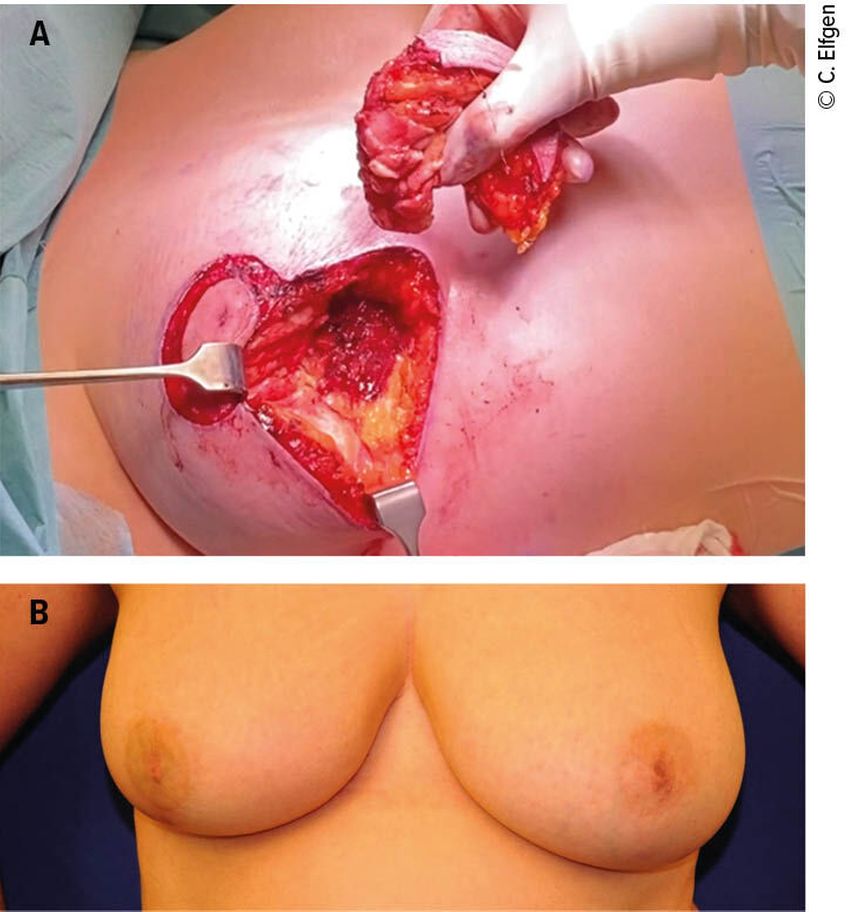
Der Fall einer 43-jährigen Patientin zeigt den Entscheidungsprozess in der täglichen klinischen Praxis. Bei der Patientin wurde ein multifokales Mammakarzinom rechts bei 6 Uhr diagnostiziert (Abb. 1A). Aufgrund der Tumorbiologie mit einem hohen Proliferationsindex (Ki-67 von 50%) bestand die Indikation zu einer Chemotherapie. Nicht nur als systemische Therapie zur Minimierung des Metastasierungsrisikos, sondern auch im Hinblick auf eine Tumorgrössenreduktion wurde diese Behandlung neoadjuvant durchgeführt (NACT). Es zeigte sich ein hervorragendes Ansprechen der beiden Clip-markierten Tumoren in der klinischen Bildgebung (Abb.1B), sodass die Patientin klar brusterhaltend operiert werden konnte. Aus onkologischer Sicht wäre dabei eine reine Tumorektomie im Bereich der Clips ausreichend gewesen, jedoch wäre dann der Gewebsdefekt im kaudalen Bereich der Mamma mit deutlichen kosmetischen Einschränkungen einhergegangen. Daher wurde der Patientin eine onkoplastische Operation im Sinne einer J-Plastik empfohlen, welche eine ausgedehntere Gewebsresektion und -mobilisation, aber auch ein besseres kosmetisches Outcome bedeutete (Abb. 2A und B).
Abb. 1: 1A: Das Mamma-MRI zeigt ein multifokales Mammakarzinom rechts bei 5–6 Uhr. 1B: Nach neoadjuvanter Chemotherapie deutliche Tumorregression bis auf einen wenige Millimeter kleinen Rest-Herdbefund rechts bei 6 Uhr
Abb. 2: 2A: Gewebsentnahme bei der onkoplastischen Operation (J-Plastik). 2B: Ergebnis ein Jahr nach der Operation
Bei dem beschriebenen Fall waren die Lymphknoten glücklicherweise frei von Metastasen. Aber auch bei Patientinnen mit axillären Lymphknotenmetastasen hat die Deeskalation deutliche Vorteile gezeigt. So führt das axilläre «downstaging» durch NACT bei Lymphknotenmetastasen dazu, dass bei nun negativen Sentinellymphknoten eine Axilladissektion mit den damit verbundenen Risiken vermieden werden kann.7 Ob die gezielte Exzision von Lymphknotenmetastasen («tailored axillary dissection», TAD) eine Axilladissektion auch in anderen Situationen ersetzen kann, ist derzeit Gegenstand von klinischen Studien.8
Die Zunahme an Mastektomien
Interessanterweise gibt es zu dem Trend der Deeskalation bei der operativen Behandlung auch eine gegenläufige Beobachtung. So sehen wir in den letzten Jahren eine zunehmende Anzahl von Mastektomien.9 Insbesondere steigen auch die Zahlen der kontralateral prophylaktischen Mastektomien deutlich an, wobei dies nicht allein durch vermehrte genetische Testung der Patientinnen und den zunehmenden Einsatz von Mamma-MRI in der Diagnostik zu erklären ist.10 Die Angst einer Patientin vor einer erneuten Karzinomerkrankung der Gegenseite, auch bei fehlender genetischer Disposition, ist emotional nachvollziehbar, wenngleich es durch die kontralaterale Mastektomie keinen Benefit für das Gesamtüberleben gibt und die Guidelines nicht zu dieser Behandlung raten.11 Die Patientin wird heute mehr denn je in den Entscheidungsprozess für die Therapie eingebunden („shared decision making“), und wir begegnen in der ärztlichen Praxis häufig Patientinnen, die sich durch verschiedenste Quellen über ihre Erkrankung informiert haben.9 Das komplexe Zusammenspiel aus Ängsten und Wünschen der Patientin, äusseren Einflüssen und innerer Überzeugung des Behandlers mag dazu führen, dass auch ohne vorliegendes genetisches Risiko Mastektomien der gesunden Seite vorgenommen werden. Da rekonstruktive Techniken etabliert sind und insbesondere durch Nipple- oder Skin-sparing Mastektomien gute kosmetische Ergebnisse erzielt werden können, kann die Bereitschaft des Behandlers heute höher sein, einen solchen Eingriff durchzuführen.9 Diese Entwicklung darf nicht unkritisch gesehen werden, da das Risiko von unmittelbaren und langfristigen Komplikationen sowie möglichen Folgeeingriffen an einer initial gesunden Brust eingegangen wird.
Entwicklung der adjuvanten Radiotherapie
Die eingangs erwähnten niedrigen Lokalrezidivraten nach BCS sind auch auf die adjuvante Radiotherapie zurückzuführen.12 Klassischerweise wird die Ganzbrustbestrahlung («whole breast irradiation», WBI) mit einer Dosis von ca. 50 Gy durchgeführt; wobei diese bei Patientinnen mit einem niedrigen Risiko für ein Lokalrezidiv zunehmend als Übertherapie angesehen wird.13 Die hypofraktionierte WBI bezeichnet eine geringere Therapiedauer mit leichter Gesamtdosisreduktion durch weniger Fraktionen, aber einer leicht erhöhten Strahlendosis pro Fraktion. Sie hat bei vergleichbarer onkologischer Sicherheit geringere Nebenwirkungen wie z.B. Dermatitis, Schmerzen oder Fatigue.14
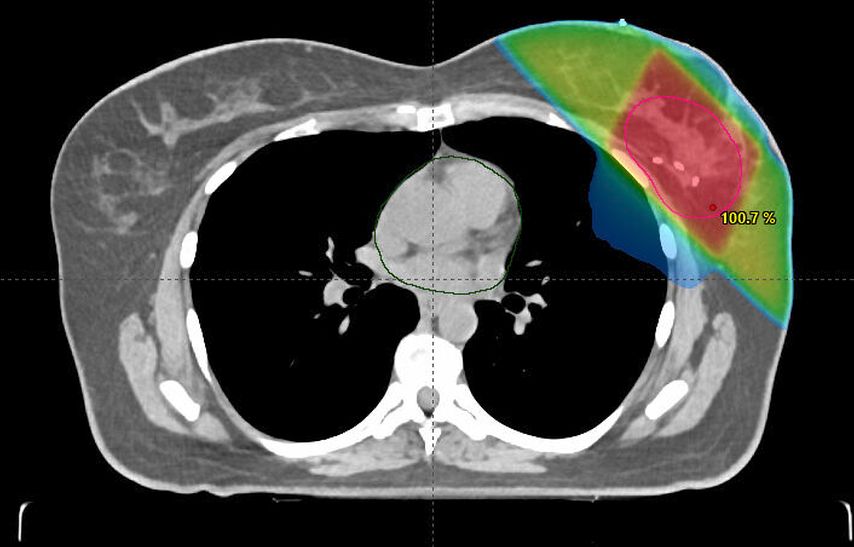
Ein weiterer Schritt in Richtung Deeskalation und Dosisreduktion stellt die akzelerierte Teilbrustbestrahlung (APBI) als Option bei Patientinnen mit niedrigem Lokalrezidivrisiko nach BCS dar.15 Die Rationale dahinter ist, dass im Falle eines Lokalrezidivs dieses mit hoher Wahrscheinlichkeit in der Nähe des ehemaligen Tumorbetts auftritt.16 Die APBI erfolgt durch eine höhere Strahlendosis pro Fraktion auf das postoperative Tumorbett bei weniger Gesamtfraktionen, kleinerem Zielvolumen und somit einer Reduktion der Gesamtdosis (Abb. 3). Akute und langfristige Nebenwirkungen sind dabei reduziert und das kosmetische Outcome in vielen Fällen verbessert.15 Unterschiedliche technische Methoden liegen der APBI zugrunde: die Brachytherapie, die intraoperative Radiotherapie (IORT) und die externe Teilbrustbestrahlung.17 Obwohl eine Studie mit nicht selektierter Patientinnengruppe ein leicht erhöhtes 10-Jahres-Rezidivrisiko nach APBI zeigte, scheinen in weiteren Studien insbesondere Patientinnen mit niedrigem Risiko von dieser Behandlung zu profitieren.15,18,19 Somit zeichnet sich ab, dass auch bei der Radiotherapie Kriterien wie Alter der Patientin, Tumorgrösse und Tumorbiologie zunehmend entscheidend für die Wahl der Methodik sind.17
Abb. 3: Planungs-CT zur Dosisberechnung der akzelerierten externen Teilbrustbestrahlung (Abbildung freundlicherweise zur Verfügung gestellt von PD Dr. med. G. Gruber, Radioonkologie Hirslanden Zürich)
Literatur:
1 Soerjomataram I et al.: An overview of prognostic factors for long-term survivors of breast cancer. Breast Cancer Res Treat 2008; 107: 309-30 2 Tenofsky P et al.: Surgical, oncologic, and cosmetic differences between oncoplastic and nononcoplastic breast conserving surgery in breast cancer patients. Am J Surg 2017; 207: 398-402 3 Veronesi U et al.: Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med 2002; 347: 1227-32 4 Kroll S et al.: Risk of recurrence after treatment of early breast cancer with skin-sparing mastectomy. Ann Surg Oncol 1997; 4: 193-7 5 Moran MS et al.: Society of Surgical Oncology-American Society for Radiation Oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in stages I and II invasive breast cancer. Int J Radiat Oncol Biol Phys 2014; 88: 553-64 6 Valachis A et al.: Risk factors for locoregional disease recurrence after breast-conserving therapy in patients with breast cancer treated with neoadjuvant chemotherapy: an international collaboration and individual patient meta-analysis. Cancer 2018; 124: 2923-30 7 Burstein HJ et al.: Estimating the benefits of therapy for early-stage breast cancer: the St. Gallen International Consensus Guidelines for the primary therapy of early breast cancer 2019. Ann Oncol 2019; 30: 1541-57 8 Henke G et al.: Tailored axillary surgery with or without axillary lymph node dissection followed by radiotherapy in patients with clinically node-positive breast cancer (TAXIS): study protocol for a multicenter, randomized phase-III trial. Trials 2018; 19: 667 9 Tan MP, Silva E: Addressing the paradox of increasing mastectomy rates in an era of de-escalation of therapy: communication strategies. Breast 2018; 38: 136-43 10 Lim DW et al.: Bilateral mastectomy in women with unilateral breast cancer: a review. JAMA Surg 2021; online ahead of print 11 Wong SM et al.: Growing use of contralateral prophylactic mastectomy despite no improvement in long-term survival for invasive breast cancer. Ann Surg 2017; 265: 581-9 12 Fisher B et al.: Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N Engl J Med 2002; 347: 1233-241 13 Franco P et al.: De-escalation of breast radiotherapy after conserving surgery in low-risk early breast cancer patients. Med Oncol 2018; 35: 62 14 Shaitelman SF et al.: Acute and short-term toxic effects of conventionally fractionated vs hypofractionated whole-breast irradiation: a randomized clinical trial. JAMA Oncol 2015; 1: 931-41 15 Coles CE et al.: Partial-breast radiotherapy after breast conservation surgery for patients with early breast cancer (UK IMPORT LOW trial): 5-year results from a multicentre, randomised, controlled, phase 3, non-inferiority trial. Lancet 2017; 390: 1048-60 16 Veronesi U et al.: Radiotherapy after breast-conserving surgery in small breast carcinoma: long-term results of a randomized trial. Ann Oncol 2001; 12: 997-1003 17 Correa C et al.: Accelerated partial breast irradiation: executive summary for the update of an ASTRO evidence-based consensus statement. Pract Radiat Oncol 2017; 7: 73-9 18 Vicini FA et al.: Long-term primary results of accelerated partial breast irradiation after breast-conserving surgery for early-stage breast cancer: a randomised, phase 3, equivalence trial. Lancet 2019; 394: 2155-64 19 Livi L et al.: Accelerated partial breast irradiation using intensity-modulated radiotherapy versus whole breast irradiation: 5-year survival analysis of a phase 3 randomised controlled trial. Eur J Cancer 2015; 51: 451-63
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...