Lebermetastasen des Kolorektalkarzinoms, hepatozelluläres Karzinom, cholangiozelluläres Karzinom: Chirurgie und neoadjuvante Konzepte
Autoren:
Prim. Univ.-Prof. Dr. Thomas Grünberger
Abteilungsvorstand
Abteilung für Chirurgie und HPB-Zentrum
Klinik Favoriten
Gesundheitsverbund Wien
E-Mail: tgruenberger@icloud.com
Dr. Yawen Dong
Abteilung für Chirurgie und HPB-Zentrum
Klinik Favoriten
Gesundheitsverbund Wien
E-Mail: yawen.dong@gesundheitsverbund.at
Der heurige ASCO-Kongress war bedingt durch Covid und die Virtualisierung aller Meetings nicht das gewohnte Highlight vor Ort in Chicago. Trotzdem konnte sich die onkologisch interessierte Welt wieder an neuen Erkenntnissen und zum Teil „practice-changing results“ erfreuen. In dieser Zusammenfassung beschränke ich mich auf die Highlights der Abstracts, die sich mit der chirurgischen Behandlung des Leber-metastasierten Kolorektalkarzinoms (mCRC) beschäftigt haben, und solcher, die zu einem geänderten Vorgehen beim hepatozellulären Karzinom (HCC) bzw. beim cholangiozellulären Karzinom (CCC) führen könnten.
Zusammenfassend lässt sich feststellen, dass die Chirurgie von Lebermetastasen differenzierter und spezialisierter wird. Die auch heuer in aller Munde befindliche Immuntherapie hat beim mCRC weiterhin ihren Stellenwert lediglich beim Mikrosatelliten-instabilen Patienten, dort allerdings eindrucksvoll bestätigt, beim HCC und CCC hat sie eine große Zukunftsperspektive.
RAXO-Studie: Resektabilität und Outcome bei mCRC-Patienten nach RAS/BRAF-Mutationsstatus
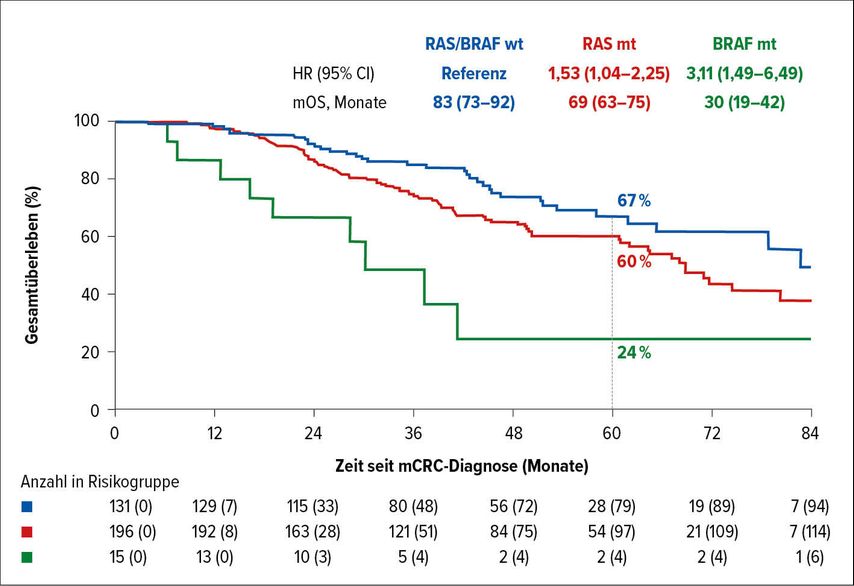
Diese finnische Multicenter-Studie stellt sicher eines der aktuell besten prospektiven Protokolle bei Patienten mit metastasiertem kolorektalem Karzinom dar und ist auch in Teilbereichen bereits publiziert. In der aktuellen Auswertung wurden die Verläufe der über 1000 Patienten bzgl. ihrer vorhandenen Molekularbiologie analysiert. Patienten wurden repetitiv in multidisziplinären Team-Meetings mit einem Leberchirurgen hinsichtlich der Resektabilität evaluiert. Es konnten die Verläufe von 289 RAS/BRAF-Wildtyp(wt), 529 RAS-mutierten (mt) und 88 BRAF-mt Patienten ausgewertet werden. Verglichen mit den beiden anderen Gruppen waren mehr Frauen in der BRAF-mt-Population, mit einem höheren Prozentsatz an rechtsseitigen Tumoren und einem höheren Prozentsatz an peritonealer Metastasierung. Primär resektabel waren mit 32% am meisten in der RAS/BRAF-wt-Gruppe, wobei lediglich 15% in der BRAF-mt-Gruppe bei Diagnosestellung operabel waren. Das gleiche Bild zeigte sich auch bei der Konversionsrate, wo 16% der Wildtyp-Patienten sekundär resektabel wurden. Insgesamt wurden in der RAS/BRAF-wt-Population 45% der Patienten reseziert/einer Thermoablation zugeführt, in der RAS-mt-Gruppe 37%, aber lediglich 17% in der BRAF-mt-Gruppe. Erwartungsgemäß war das Gesamtüberleben bei resezierten RAS/BRAF-wt-Patienten am längsten (medianes Gesamtüberleben [OS]: 83 Monate), jedoch auch bei RAS-mt (mOS: 69 Monate) und vor allem BRAF-mt-Patienten (mOS: 30 Monate) für den Versuch der kurativen OP sprechend (Abb. 1). Somit kommen die Autoren zum Schluss, dass eine wiederholte Besprechung von mCRC-Patienten unbedingt gefordert werden soll und alle potenziell resektablen Patienten unabhängig von ihrer Molekularpatholgie der Operation zugeführt werden sollen.1
Abb. 1: Unterschiedliche OS-Daten abhängig vom Molekularpathologie-Status (nach Osterlund PJ et al.)1
PARLIM-Studie: Panitumumab plus FOLFOX bei RAS-wt-mCRC
Diese Studie ist ein weiterer Versuch der FIRE-Studiengruppe, den Stellenwert der EGFR-basierten Therapie im RAS-wt-mCRC-Setting zu etablieren. In dieser Phase-II-Studie wurden insgesamt 106 Patienten in einem 2:1-Protokoll nach Leberresektion adjuvant behandelt, wobei im experimentellen Arm Panitumumab nach 3 Monaten Kombination mit FOLFOX weitere 3 Monate alleine gegeben und mit 3 Monaten FOLFOX im Standardarm verglichen wurde. Der intendierte primäre Endpunkt, das progressionsfreie Überleben (PFS) nach 2 Jahren auf >65% im experimentellen Arm zu steigern, wurde mit 33% klar verfehlt, es war aber im Kontrollarm mit 22% noch schlechter. Das mediane PFS lag im experimentellen Arm bei 19,5 Monaten, im FOLFOX-Arm bei 17,1 Monaten, statistisch nicht signifikant unterschiedlich. Auch das mediane OS war nach bisherigem Follow-up nicht statistisch signifikant unterschiedlich und im experimentellen Arm noch nicht erreicht, im Vergleich zu 89,2 Monaten im FOLFOX-Arm. Diese Daten eines wirklich langen medianen OS zeigen auch in dieser Studie, dass nicht nur eine standardisierte studienspezifische Nachsorge eine potenziell kurative Rezidivtherapie ermöglicht, sondern dass zusätzlich im RAS-wt-Status eine Vielzahl an Folgetherapien die Chronifizierung der mCRC-Erkrankung ermöglicht.2
Neoadjuvante transarterielle FOLFOX-Chemotherapie plus Resektion beim HCC
In dieser chinesischen multizentrischen Phase-III-Studie wurde eine neoadjuvante transarterielle FOLFOX-Chemotherapie plus Resektion mit der alleinigen Resektion bei resektablen HCC-Patienten jenseits der Milan-Kriterien untersucht. Innerhalb von 4 Jahren wurden 208 Patienten in 5 chinesischen Zentren inkludiert, wovon 199 auswertbar waren. Sowohl die OS- als auch die PFS-Daten waren signifikant besser in der neoadjuvant behandelten Gruppe (3-Jahres-OS: 63,5% vs. 46,3%; p=0,016; 18-Monats-PFS: 47,4% vs 34,8%, p=0,017) ohne dass es zu einer Erhöhung der Peri-OP-Morbidität kam.
Es konnte bei 2–4 neoadjuvanten Therapien eine beeindruckende Gesamtansprechrate (ORR) von 63,6% mit einer Rate an kompletten Remissionen (CR) von 10,1% und einer Krankheitskontrollrate (DCR) von 96% erreicht werden. Zusätzlich interessant war die Reduktion der mikrovaskulären Invasion von 39% in der Kontrollgruppe auf 11,4% in den neoadjuvant FOLFOX-behandelten Patienten.3
Gemox, Toripalimab und Lenvatinib beim fortgeschrittenen intrahepatalen CCC
In dieser chinesischen einarmigen Studie wurden innerhalb eines halben Jahres 30 Patienten mit lokal fortgeschrittenem bzw. metastasiertem intrahepatalem cholangiozellulärem Karzinom mit einer Kombination aus Standard-Chemotherapie Gemox, Immuntherapie Toripalimab und dem Tyrosinkinase-Inhibitor (TKI) Lenvatinib behandelt. Der primäre Endpunkt war die ORR, die mit 80% äußerst effektiv gezeigt werden konnte, zusätzlich war eine DCR von 93,3% zu vermerken. Ein Patient erzielte eine komplette Remission und 3 Patienten (10%) konnten nach suffizienten Downsizing sekundär kurativ reseziert werden. Es konnte ein medianes PFS von 10 Monaten erreicht werden, das mediane OS war noch nicht erreicht, aber ein 12-Monats-OS von 73,3% scheint vielversprechend. Es traten keine schwerwiegenden Nebenwirkungen auf und die unerwünschten Ereignisse Grad 1/2 waren nicht unterschiedlich zu den bereits bekannten Nebenwirkungen der Einzelsubstanzen.4
Take-Home-Message
Die Therapie des mCRC wird deutlich individualisierter, ein „Standardvorgehen“ ist sowohl im neoadjuvanten wie auch im Induktionssetting und auch im adjuvanten Behandlungsalgorithmus unbedingt einer erweiterten Analyse von Patienten- und Tumorcharakteristika anzupassen. Die lange Zeit übliche Peri-OP-Chemo/AK-Therapie bei jedem Patienten mit Lebermetastasen ist aufgegeben und heute wesentlich von dem Stadium der Erstdiagnose und spezifischer Molekulargenetik abhängig.
Sehr erfreulich ist die Entwicklung der Behandlungsmöglichkeiten bei den primären Lebertumoren, wo neben den beeindruckenden Immuntherapie-Ergebnissen auch andere Therapiezusammensetzungen das Überleben unserer Patienten deutlich verlängern können.
Einmal mehr ist zu betonen, dass die Diskussion jedes neu diagnostizierten Tumorpatienten in einem spezialisierten MDT-Meeting von vorrangiger Bedeutung ist, um eine auf Patienten- und Tumorcharakteristika abgestimmte ideale Therapieabfolge zu definieren.
Literatur:
1 Osterlund PJ et al.: Resectability, conversion and resections rates, and outcomes in RAS&BRAF wildtype (wt), RAS mutant (mt) and BRAFmt metastatic colorectal cancer (mCRC) subgroups in the prospective Finnish RAXO study. J Clin Oncol 2021; 39(15_suppl): Abstr. #3532 2 Modest D et al.: FOLFOX plus panitumumab or FOLFOX alone as additive therapy following R0/1 resection of RAS wild-type colorectal cancer liver metastases: The PARLIM trial, AIO KRK 0314. J Clin Oncol 2021; 39(15_suppl): Abstr. #3553 3 Li S et al.: Neoadjuvant transarterial infusion chemotherapy with FOLFOX could improve outcomes of resectable BCLC stage A/B hepatocellular carcinoma patients beyond Milan criteria: An interim analysis of a multi-center, phase 3, randomized, controlled clinical trial. JClin Oncol 2021; 39(15_suppl): Abstr. #4008 4 Jian Z et al.: Gemox chemotherapy in combination with anti-PD1 antibody toripalimab and lenvatinib as first-line treatment for advanced intrahepatic cholangiocarcinoma: A phase 2 clinical trial. J Clin Oncol 2021; 39(15_suppl): Abstr #4094
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...