Kopf-Hals-Tumoren: personalisierte Immuntherapiestrategien wünschenswert
Autor:
Assoc. Prof. Priv.-Doz. Dr. Thorsten Füreder
Klinische Abteilung für Onkologie
Universitätsklinik für Innere Medizin I
Medizinische Universität Wien
Auf dem Jahreskongress 2024 der American Society of Clinical Oncology standen im Bereich der Kopf-Hals-Tumoren – wie bereits im letzten Jahr – Studien zum lokal fortgeschrittenen Nasopharynxkarzinom und zu lokal fortgeschrittenen und rezidivierten/metastasierten Plattenepithelkarzinomen im Fokus. Die in diesen Studien präsentierten Therapiestrategien könnten teilweise den „Standard of Care“ neu definieren bzw. einen Einfluss auf die klinische Praxis haben. Sie werden im folgenden Artikel näher erläutert.
Lokal fortgeschrittenes Nasopharynxkarzinom
Phase-III-Studie BEACON
In der randomisierten Phase-III-Studie BEACON wurde die Frage gestellt, ob eine Induktionschemotherapie (ICT) mit drei Zyklen Gemcitabin/Cisplatin (GP) in Kombination mit dem Immuncheckpoint-Inhibitor Tislelizumab gefolgt von Radiochemotherapie (CRT) und adjuvanter Tislelizumab-Gabe einer ICT mit GP+Placebo gefolgt von CRT gefolgt von Placebo überlegen ist.1 450 Patient:innen mit Nasopharynxkarzinomen (NPC) im Stadium III/IVa (außer T3–T4, N0 und T3, N1) wurden in die beschriebenen Studienarme randomisiert. Primäre Endpunkte waren die Rate von komplettem Ansprechen (CRR) und das progressionsfreie Überleben (PFS). Die CRR war in der Tislelizumab-Gruppe signifikant höher als in der Standardtherapie-Gruppe (30,5% vs. 16,7%; p=0,0006). Das mediane PFS und das Gesamtüberleben (OS) wurden noch nicht erreicht und daher nicht rapportiert. Die Rate an Nebenwirkungen (AE) von Grad 3–5 war in beiden Studienarmen vergleichbar (75,15% vs. 70,4%).
DIPPER: Radiochemotherapie, adjuvante Immuntherapie+Camrelizumab
Im Rahmen der ASCO-Konferenz 2024 wurden die Ergebnisse der randomisierten Phase-III-Studie DIPPER präsentiert, die den Einsatz des PD-1-Inhibitors Camrelizumab als adjuvante Therapie bei Patient:innen mit Hochrisiko-NPC (T4-N1-M0 oder T1-4N2-3M0) untersuchte. 450 Patient:innen hatten zuvor eine ICT mit GP gefolgt von CRT erhalten und wurden anschließend in den experimentellen Arm mit Camrelizumab für zwölf Zyklen oder in den Standard-Observanz-Arm randomisiert. Der primäre Endpunkt der Studie war das ereignisfreie Überleben (EFS), sekundäre Endpunkte umfassten das OS, lokoregionäres rückfallfreies Überleben (LRFS) und das fernmetastasenfreie Überleben (DMFS).2
Die 3-Jahres-EFS-Rate betrug 86,9% in der Camrelizumab-Gruppe und 77,3% in der Standardtherapie-Gruppe (HR: 0,56; 95% CI: 0,36–0,89; p=0,03). Das LRFS und DMFS waren in der Camrelizumab-Gruppe ebenfalls verlängert im Vergleich zur Observanz-Gruppe:
-
LRFS: HR: 0,53; 95% CI: 0,28–0,99; p=0,046
-
DMFS: HR: 0,54; 95% CI: 0,3–0,97; p=0,037
Das OS unterschied sich nicht zwischen den Gruppen. Die OS-Rate lag bei 11,2% in der Camrelizumab-Gruppe im Vergleich zu 3,2% in der Standardtherapie-Gruppe.
Relevanz für die klinische Praxis
Patient:innen mit NPC im Stadium III/IV, die in kurativer Intention behandelt werden, weisen ein klinisch relevantes Rezidivrisiko und verkürztes OS auf, weshalb neue Therapiestrategien wünschenswert sind.
Die Daten der BEACON-Studie sind einerseits vielversprechend, andererseits fehlen noch relevante klinische Endpunkte wie das PFS und OS. Weiters ist die berichtete hohe CRR von 30,5% überraschend und deckt sich nicht mit anderen Immuntherapie-Studien, die eine CRR von ca. 10% rapportierten.3 Kritisch sei weiterhin angemerkt, dass die Methode und der Zeitpunkt zur Bestimmung der CRR unklar sind.
Im adjuvanten Setting ist Camrelizumab der alleinigen Observanz überlegen, wobei eine längere Nachbeobachtung des Gesamtüberlebens notwendig ist und auch gefordert werden muss, bevor diese Strategie im klinischen Alltag umgesetzt werden sollte. Insbesondere sei auf die positive Studie mit adjuvanter metronomischer Gabe von Capecitabin hingewiesen, die ein signifikant längeres OS vs. Observanz demonstriert hatte, in den ESMO-Leitlinien als Option angeführt wird und einen validen Vergleichsarm darstellen würde.4,5
Dennoch unterstützen die Studienergebnisse der letzten Jahre zunehmend die Implementierung der Immuntherapie in Kombination mit GP sowohl beim lokal fortgeschrittenen (LA) NPC (z.B. die CONTINUUM-Studie)3 als auch beim rezidivierten/metastasierten (r/m) NPC (Studien JUPITER-02 oder RATIONALE-309).6,7
Die untersuchten Checkpoint-Inhibitoren sind zwar in Asien zugelassen, jedoch in Europa/USA teilweise nicht verfügbar, wobei Zulassungsanträge für die Therapie des NPC (z.B. für Tislelizumab) von der EMA derzeit geprüft werden. Da das NPC in Asien endemisch ist und in Europa/USA zu den seltenen Tumorentitäten zählt, müssen wir die in Asien generierten Daten nolens volens seit Jahren extrapolieren und nach Zulassung diese Substanzen auch bei dieser Tumorentität einsetzen.
HNSCC im rezidivierten/metastasierten Stadium
HB-200-Arenavirus+Pembrolizumab
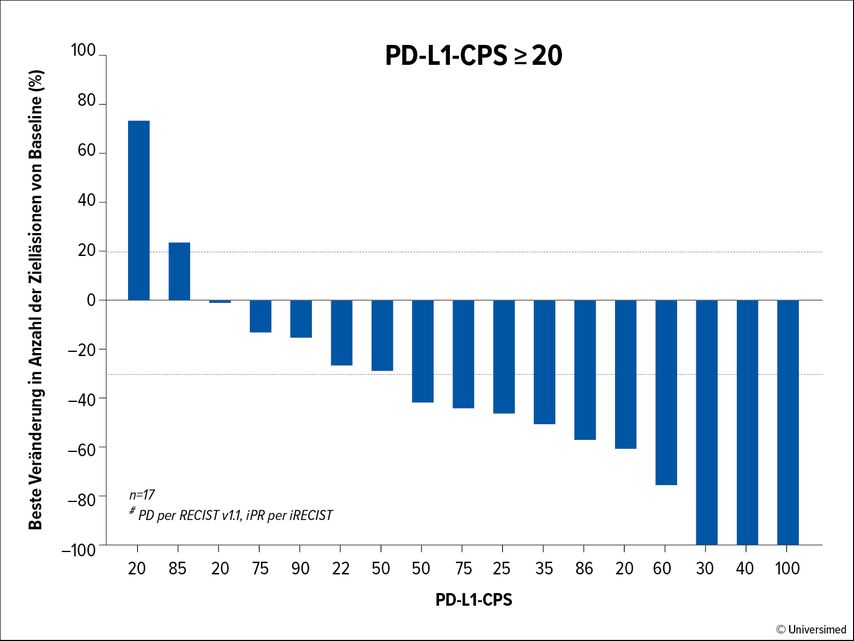
In einer Phase-II-Studie wurde die Wirksamkeit einer HB-200-Arenavirus-basierten Immuntherapie in Kombination mit Pembrolizumab als Erstlinienbehandlung für Patient:innen mit einem r/m Plattenepithelkarzinom (HNSCC) evaluiert, das positiv auf humanes Papillomavirus (HPV) 16 ist und einen PD-L1-„combined positive score“ (CPS) ≥20 hat.8
46 Patient:innen erhielten HB-200 intravenös in Kombination mit Pembrolizumab. Die Anti-Tumor-Aktivität bei 38 Patient:innen im Sinne eines Ansprechens betrug 37,1% in der Gesamtpopulation und 52,9% in der Subgruppe mit PD-L1-CPS ≥20 (Abb. 1), wobei in dieser Gruppe ein komplettes Ansprechen bei 17,6% der Patient:innen erzielt wurde. Die Behandlung wurde generell gut vertragen. Nebenwirkungen von Grad ≥3 traten bei 15,2% der Patient:innen auf. Basierend auf diesen Ergebnissen ist eine Phase-III-Studie geplant.
Abb. 1: Anti-Tumor-Aktivität bei 38 Patient:innen im Sinne eines Ansprechens (modifiziert nach Ho AL et al.)8
Tumorvakzine ISA101b+Cemiplimabin der Erst-und Zweitlinie
In der randomisierten Phase-II-Studie OpcemISA wurden 198 Patient:innen mit r/m HPV16-positivem Oropharynxkarzinom (OPC) in der Erst- und Zweitlinie randomisiert, um entweder ISA101b+Cemiplimab oder Placebo kombiniert mit Cemiplimab zu erhalten.9
ISA101b ist ein Peptidimpfstoff und zielt auf die HPV16-E6/E7-Onkoproteine ab. Der primäre Endpunkt war die Gesamtansprechrate (ORR) nach mindestens sechs Monaten Nachbeobachtung gemäß RECIST1.1. In der ISA101b-Gruppe betrug die ORR 25,3% im Vergleich zu 22,9% in der Kontrollgruppe. Patient:innen mit einem CPS ≥20 zeigten eine signifikant bessere ORR (51,7% vs. 25,8%; p=0,062). In der „Per protocol“-Analyse war das OS in dieser Subpopulation ebenfalls verlängert, mOS wurde nicht erreicht vs. 23,3 Monate; (p=0,0324). Die Toxizität war in beiden Gruppen vergleichbar.
Systemische Therapie bei reduziertem Allgemeinzustand ab Zweitlinie
Eine am ASCO-Jahrestreffen 2024 vorgestellte Phase-III-Studie untersuchte das OS ab der Zweitlinie bei r/m HNSCC bei Patient:innen mit einem Allgemeinzustand von ECOG 2–3, die entweder eine systemische Therapie nach Entscheidung der Ärzt:innen erhielten (metronomische Tripeltherapie mit MTX, Celecoxib und Erlotinib oder Docetaxel) vs. „best supportive care“ (BSC). Insgesamt wurden 66 Patient:innen randomisiert.10
Die 6-Monats-OS-Rate betrug 9,09% (95% CI: 1,56–25,1) in der BSC-Gruppe und 53,8% (95% CI: 37,9–67,2) in der Chemotherapie-Gruppe (p<0,0001). Das mediane OS lag in der Chemotherapie-Gruppe bei 223 Tagen (95% CI: 129–283) gegenüber 77,5 Tagen (95% CI: 58–110) in der BSC-Gruppe (HR: 0,33; 95% CI: 0,187–0,593; p<0,0001).
Relevanz für die klinische Praxis
Obwohl Patient:innen mit HPV-positiven Oropharynxkarzinomen eine bessere Prognose aufweisen als jene mit HPV-negativen Tumoren, sind die Therapieoptionen im r/m Setting limitiert. Personalisierte und neue Immuntherapiestrategien sind jedenfalls wünschenswert.
Zur Einordnung der Daten der Studien OpcemISA und Arenavirus sei erwähnt, dass in der Studie KEYNOTE-048, die den aktuellen Therapiestandard definiert hat, die Ansprechrate mit Pembrolizumab-Monotherapie ca. 23% in der Subgruppe mit CPS ≥20 betrug.11 Obwohl die beiden genannten Studien keine aktuelle klinische Relevanz besitzen, sind die rapportierten Ansprechraten sehr ermutigend und zeigen das Potenzial von Tumorvakzinen auf. Mit Spannung dürfen wir daher die weitere klinische Entwicklung dieser Substanzen verfolgen.
Relevanter für den klinischen Alltag scheinen die Ergebnisse der Studie zu systemischer Therapie bei Patient:innen mit reduziertem Allgemeinzustand zu sein, da diese Patient:innenpopulation häufig von klinischen Studien ausgeschlossen wird. Da der Großteil der Patient:innen in dieser Studie einen ECOG 2 (86%) hatte und vorrangig mit in Europa nicht zugelassener metronomischer Therapie behandelt wurde, müssen wir die Ergebnisse jedoch vor diesem Hintergrund interpretieren. In jedem Fall wird die klinische Praxis bestätigt, dass diese Population von systemischer Therapie profitiert. Fraglich bleibt der Stellenwert der systemischen Therapie bei Patient:innen mit ECOG ≥3.
Kopf-Hals-Tumoren im frühen und lokal fortgeschrittenen Stadium
Radiochemotherapie mit Protonen vs. Photonen bei Oropharynxkarzinomen
Eine Phase-III-Studie adressierte die Frage, ob bei Patient:innen mit Oropharynxkarzinomen (OPC) eine CRT mit intensitätsmodulierter Protonentherapie (IMPT) gegenüber der intensitätsmodulierten Standard-Strahlentherapie (IMRT) nicht unterlegen ist.12
Der primäre Endpunkt war die 3-Jahres-PFS-Rate, sekundäre Endpunkte umfassten das OS und die Abhängigkeit von einer Ernährungssonde. Insgesamt wurden 440 Patient:innen randomisiert, wobei der Großteil HPV-positiv war. In den PFS- und OS-Analysen wurde demonstriert, dass IMPT der IMRT nicht unterlegen ist (PFS: HR: 0,87; 95% CI: 0,56–1,35; p>=1,535; OS: HR: 0,63; 95% CI: 0,36–1,1). Die Abhängigkeit von einer Ernährungssonde verringerte sich von 42% mit IMRT auf 28% (p=0,019) mit IMPT. Mehr Patient:innen in der IMPT-Gruppe behielten ihr Gewicht bis zum Ende der Behandlung bei (24% vs. 14%; p=0,037).
Relevanz für die klinische Praxis
Neben Deeskalationsstudien, die derzeit bei HPV-positiven Patient:innen mit OPC durchgeführt werden, ist auch die Verringerung von Nebenwirkungen der Standardtherapie ein relevantes Therapieziel. IMPT ist in diesem Setting in Hinblick auf Effektivität der IMRT nicht unterlegen, in Hinblick auf Abhängigkeit von einer Ernährungssonde oder Gewichtsverlust der IMRT jedoch überlegen.
Kritisch sei angemerkt, dass die Rate der Patient:innen, die eine Ernährungssonde benötigten, hoch erscheint und Langzeittoxizitäten nicht untersucht wurden. Je nach Verfügbarkeit erscheint IMPT bei HPV-positiven OPC jedenfalls eine valide Therapieoption zu sein.
Zusammenfassung
Kurz zusammengefasst lassen sich aus den in diesem Jahr präsentierten Studien bei Kopf-Hals-Tumoren folgende Erkenntnisse ableiten:
-
Adjuvante Immuntherapie mit Camrelizumab verlängert das EFS bei Hochrisiko-NPC-Patient:innen im Vergleich zur Observanz.
-
Tumorvakzinen und Arenavirus-basierte Therapie plus Pembrolizumab sind interessante Ansätze zur Therapie von HPV-positivenr/m Oropharynxkarzinomen.
-
IMPT ist der IMRT bei HPV-positiven Oropharynxkarzinomen im kurativen Setting nicht unterlegen, jedoch mit einem günstigeren Toxizitätsprofil assoziiert.
Literatur:
1 Mai H-Q et al.: Tislelizumab vs. placebo combined with induction chemotherapy followed by concurrent chemoradiotherapy and adjuvant tislelizumab or placebo for locoregionally advanced nasopharyngeal carcinoma: Interim analysis of a multicenter, randomized, placebo-controlled, double-blind, phase 3 trial. J Clin Oncol 2024; 42(Suppl. 16): Abstr. #6001 2 Ma J et al.: Adjuvant PD-1 blockade with camrelizumab in high-risk locoregionally advanced nasopharyngeal carcinoma (DIPPER): A multicenter, open-label, phase 3, randomized controlled trial. J Clin Oncol 2024; 42(Suppl. 17): Abstr. #LBA6000 3 Liu X et al.: Induction-concurrent chemoradiotherapy with or without sintilimab in patients with locoregionally advanced nasopharyngeal carcinoma in China (CONTINUUM): a multicentre, open-label, parallel-group, randomised, controlled, phase 3 trial. Lancet 2024; 403(10445): 2720-31 4 Chen YP et al.: Metronomic capecitabine as adjuvant therapy in locoregionally advanced nasopharyngeal carcinoma: a multicentre, open-label, parallel-group, randomised, controlled, phase 3 trial. Lancet 2021; 398(10297): 303-13 5 Bossi P et al.: ESMO-EURACAN Clinical Practice Guideline update for nasopharyngeal carcinoma: adjuvant therapy and first-line treatment of recurrent/metastatic disease. Ann Oncol 2023; 34(3): 247-50 6 Chen QY et al.: Final overall survival analysis of JUPITER-02: A phase 3 study of toripalimab vs. placebo in combination with gemcitabine and cisplatin as first-line treatment for recurrent or metastatic nasopharyngeal carcinoma (NPC). J Clin Oncol 2023; 41(Suppl. 16): Abstr. #6009 7 Yang Y et al.: Tislelizumab plus chemotherapy as first-line treatment for recurrent or metastatic nasopharyngeal cancer: A multicenter phase 3 trial (RATIONALE-309). Cancer Cell 2023; 41(6):1061-72.e4 8 Ho AL et al.: HB-200 arenavirus-based immunotherapy plus pembrolizumab as first-line treatment of patients with recurrent/metastatic HPV16-positive head and neck cancer: updated results. J Clin Oncol 2024; 42(Suppl. 16): Abstr. #6005 9 Even C et al.: Results of a randomized, double-blind, placebo-controlled, phase 2 study (OpcemISA) of the combination of ISA101b and cemiplimab vs. cemiplimab for recurrent/metastatic (R/m) HPV16-positive oropharyngeal cancer (OPC). J Clin Oncol 2024; 42(Suppl. 16): Abstr. #6003 10 Balermpas P et al.: Head and neck cancer relapse after chemoradiotherapy correlates with CD163+ macrophages in primary tumour and CD11b+ myeloid cells in recurrences. Br J Cancer 2014; 111(8): 1509-18 11 Burtness B et al.: Pembrolizumab alone or with chemotherapy vs. cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): arandomised, open-label, phase 3 study. Lancet 2019; 394(10212): 1915-28 12 Frank SJ et al.: Phase III randomized trial of intensity-modulated proton therapy (IMPT) vs. intensity-modulated photon therapy (IMRT) for the treatment of head and neck oropharyngeal carcinoma (OPC). J Clin Oncol 2024; 42(Suppl. 16): Abstr. #6006
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...