Kontroversen im Management von Patient:innen mit Weichteilsarkomen
Autor:innen:
Dr. med. Silvia Hofer
FMH Innere Medizin, FMH Onkologie
Zürich
E-Mail: silvia.hofer@usz.ch
PD Dr. med. Christian Rothermundt
Leitender Arzt
Klinik für Medizinische Onkologie und Hämatologie
Kantonsspital St. Gallen
E-Mail: christian.rothermundt@kssg.ch
Aufgrund ihrer Seltenheit und Heterogenität stellen Weichteilsarkome (STS, «soft tissue sarcoma») bei der Diagnosestellung, den Entscheidungen für ein multimodales Therapiekonzept und in der Art und Frequenz der Nachsorge eine Herausforderung für alle Beteiligten dar. In Europa beträgt die Inzidenz von Weichteilsarkomen 4–9/100000/Jahr.1 Sie treten in den Extremitäten (ESTS), im Abdomen/Retroperitoneum (RPS) und Rumpf auf, finden sich jedoch auch sonst fast überall im Körper.
Seit der Neuauflage der WHO-Klassifikation 2020 und in den Folgejahren wurden an die 150 Weichteilsarkom-Subtypen charakterisiert, die sich in Morphologie, Immunhistochemie, molekularen Eigenschaften und ihrem biologischen Verhalten unterscheiden.2
In den letzten Jahren wurden weltweit Anstrengungen unternommen, um das Management von Weichteilsarkomen (STS) auf der Grundlage von weiterentwickelter pathologischer/molekularer und radiologischer Diagnostik zu verbessern. Viele Histotypen sind ausserordentlich selten (im Bereich von 0,1 Fällen/100000/Jahr), sodass selbst spezialisierte Patholog:innen und Kliniker:innen diesen in ihrem Berufsleben nicht öfter als einmal begegnen. Multidisziplinäre Sarkomzentren mit hohen Fallzahlen sind daher eine Voraussetzung für eine optimale Versorgung der Patient:innen, wobei nicht an allen Zentren das gesamte hochspezialisierte Angebot vorhanden sein muss. Ein gut funktionierendes Netzwerk über die Landesgrenzen hinaus ist für eine optimale Versorgung entscheidend.
Leitlinien für Weichteilsarkome
Wie für die meisten Krebsarten, gibt es auch für die Diagnostik und Behandlung von Weichteilsarkomen interdisziplinäre Leitlinien, etwa die englischen ESMO-Guidelines (2021), die deutsche S3-Leitlinie (2021) und die deutschsprachige Onkopedia-Leitlinie (2019).3–5 Trotz der vielen klaren Statements und Empfehlungen in diesen Leitlinien bleiben viele Fragen im klinischen Alltag offen oder werden kontrovers beurteilt. Die Evidenz aus klinischen Studien fehlt oftmals aufgrund kleiner Fallzahlen, zudem gesellen sich laufend neue molekulare STS-Subtypen hinzu. Biologisch unterschiedliche Sarkome alle gleich zu behandeln ist aber problematisch und war in der Vergangenheit wenig erfolgreich.
Konsensuskonferenz zum klinischen Management von STS
Onkologische Konsensuskonferenzen zu kontroversen Meinungen in Diagnostik, Therapie und Nachsorge von Karzinomen, an welchen international renommierte Expert:innen in regelmässigen Abständen debattieren und abstimmen, haben in der Schweiz bereits eine lange Tradition. Weltweit bekannt sind die St. Galler internationale Brustkrebs-Konferenz, die 2023 zum 18. Mal abgehalten wurde, und die «Advanced Prostate Cancer Consensus Conference» (APCCC), welche seit 2015 jedes zweite Jahr stattfindet. Beide Konferenzen erreichen durch ihre Internationalität und den konsensusbildenden Austausch von Expert:innen hohe Aufmerksamkeit.
Eine Konsensuskonferenz schien uns für Weichteilsarkome umso nötiger, als das Erreichen einer robusten Evidenz anhand prospektiv kontrollierter Studien immer wieder an der Seltenheit der einzelnen STS-Subtypen gescheitert ist. Und dennoch braucht es im klinischen Alltag akzeptierte Vorgehensweisen, verbindliche Therapieempfehlungen, selbst wenn diese ggf. nur vorübergehender Natur sein können, und selbstverständlich anerkannte Qualitätsindikatoren. Die Ergebnisse einer solchen Konsensuskonferenz dienen als Basis für derzeit akzeptierte Behandlungspfade, für Verhandlungen mit den Krankenversicherern, als Argumente in der Politik und zur Planung von klinischen Studien oder Registern in internationaler Zusammenarbeit.
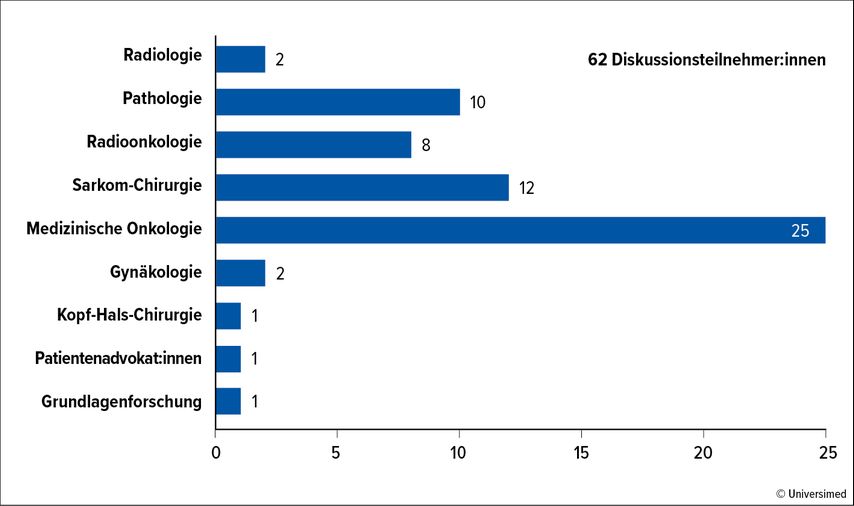
Aus dieser Notwendigkeit heraus formten sich 2021 acht interdisziplinäre Arbeitsgruppen (Abb. 1) mit 62 europäischen und Schweizer Sarkomexpert:innen (Abb. 2), die kontroverse Statements bei STS diskutierten und daraus 220 Fragen formulierten. Über diese wurde vor und anlässlich der ersten Sarkom-Konsensus-Konferenz in St. Gallen im Mai 2022 diskutiert.
Ergebnisse der ersten Sarkom-Konsensus-Konferenz
Im Vorfeld der Konferenz sind analog einem Delphi-Prozess kontroverse Statements ausgetauscht und dann festgelegt worden. Über diese 220 Statements fand dann eine Online-Abstimmung durch die Sarkom Expert:innen statt. Am 20. und 21. Mai 2022 diskutierten wir die Ergebnisse in St. Gallen und wiederholten zu 62 Fragen die Abstimmung. Es gab Fragen mit Einfachauswahl und solche, bei denen mehrere Antworten erlaubt waren. Zusätzlich war bei jeder Frage die Option «Enthaltung» möglich, wenn sich jemand in diesem Bereich nicht kompetent fühlte oder den Eindruck gewann, die Frage sei nicht eindeutig gestellt worden. Bei 33% oder mehr Enthaltungen wurde die Frage für die Auswertung gestrichen. Wir definierten einen Konsensus bei ≥75% und einen klaren Konsensus bei ≥95% Übereinstimmung.
Konsensus zur Diagnostik von STS
Sarkompathologie und -radiologie sind die beiden Grundpfeiler der STS-Diagnostik. Sie komplementieren sich, was eine gute Kommunikation beider Disziplinen voraussetzt. Kriterien für das Grading von STS sind zwingend aus dem Biopsiematerial (geleitet durch eine zuvor veranlasste Bildgebung) zu bestimmen, bieten doch präoperative Therapien bei Hochrisiko-STS in mehrfacher Hinsicht Vorteile für einen kurativen Therapieansatz. Eine Standardisierung von Pathologieberichten mit integrierten Angaben zu den radiologischen Befunden wurde gefordert. Die gleichen Anforderungen wurden an das postoperative Response-Assessment gestellt. Ein klarer Konsensus (100% Zustimmung) bestand darin, dass mesenchymale Tumoren mit Ungewöhnlichkeiten in der Morphologie, dem biologischen Verhalten oder in molekularen Aberrationen zwingend von einem Referenz-Sarkom-Pathologen/einer Referenz-Sarkom-Pathologin beurteilt werden müssen. Folgenden Kriterien, die Referenz-Patholog:innen erfüllen sollen, wurde mehrheitlich zugestimmt:
-
Vorhandensein von Qualitätskontrollen in der Diagnostik am Institut
-
regelmässige Teilnahme an interdisziplinären Sarkom-Tumorboards
-
Zusammenarbeit mit validierten Laboren für molekulare Diagnostik
-
regelmässiger Austausch mit Referenzpatholog:innen
-
Kenntnisse in den neuesten diagnostischen Techniken (Antikörper, molekulare Assays)
-
regelmässige Durchführung von NGS
-
Ausbildung für mindestens ein Jahr an einem Institut mit einem Referenzpathologen/einer Referenzpathologin
-
wissenschaftliche und Ausbildungsfunktionen auf dem Gebiet der Sarkompathologie
-
mehr als 100 STS-Primärdiagnosen pro Jahr
Konsensus zu perioperativem STS-Management
Viel zu diskutieren gab es in Bezug auf das perioperative Management der STS. Zwar gibt es Daten zur perioperativen Systemtherapie bei Hochrisiko-STS, es fehlt aber bis dato eine Studie mit einem Observationsarm ohne eine entsprechende Systemtherapie. Unklar ist die genaue Definition von «Hochrisiko-STS». Hier werden Grösse, Tiefe und Grading als Risikoindikatoren verwendet, alternativ wird das SARCULATOR-Tool zur Risikoberechnung herangezogen, das jedoch nur einen Teil der STS-Subtypen berücksichtigt, oder auch molekulare Signaturen.
Weiterhin fehlen robuste Daten zur Dauer einer perioperativen Systemtherapie, zum besten Zeitpunkt derselben (prä- oder postoperativ) und zu den am besten geeigneten Medikamenten.
Die Wahl der Substanzen ist wiederum erschwert durch die zahlreichen STS-Subtypen. Als optimaler primärer Endpunkt für eine künftige Studie zur perioperativen Systemtherapie wurden an der Konsensus-Konferenz DFS («disease-free survival») und OS («overall survival») als etwa gleichwertig beurteilt.
Zur perioperativen Radiotherapie (RT) gab es ebenfalls offene Fragen. Bei den Sarkomen – wie auch bei einigen andern Tumoren – werden zunehmend Kurzprotokolle angewendet. Deren Gleichwertigkeit wird in Studien zurzeit validiert – mit entsprechenden Modifikationen der Strahlendosis.
Auch wenn bei der RT eine präoperative Applikation bevorzugt wird, konnten Argumente für eine postoperative RT formuliert werden, nämlich die Sorge vor Wundheilungsstörungen und eine Diskrepanz zwischen dem Grading der Biopsie («sampling error») und der Aussage der initialen Bildgebung.
Konsensus zum operativen Vorgehen
Die Planung einer kurativen Resektion erfolgt nach initialer Bildgebung und histologischer Aufarbeitung der obligaten prätherapeutischen Biopsie am interdisziplinären Sarkom-Tumorboard. Dabei wird von den Chirurg:innen die Wahrscheinlichkeit einer R0-Resektion eingeschätzt und die dafür unterstützenden Vortherapien werden besprochen. Für Sarkome im Retroperitonealraum ist aus anatomischen Gründen oft nur eine R1-Resektion möglich, und sie wird entsprechend als Vorgehen akzeptiert. In Ausnahmefällen kann bei Extremitätensarkomen eine geplante marginale Resektion durchgeführt werden, wenn dadurch ein relevanter Funktionsverlust verhindert werden kann.
Anlass zu vielen Diskussionen gab die Indikation für eine Re-Resektion im Fall von positiven Resektionsrändern mit oder ohne makroskopischen Tumorrest. Diese Situation wird vor allem nach ungeplanten Resektionen angetroffen (sogenannte Whoops-Resektionen), die durch Antizipation und erhöhte Aufmerksamkeit vor allem unter Allgemeinchirurg:innen ausserhalb von Sarkomnetzwerken verhindert werden müssen.
Ein klarer Konsens konnte darüber erreicht werden, dass die Prinzipien der Sarkomchirurgie auch für die Disziplinen der Kopf-Hals-Chirurgie und der Dermatologie sowie für die gynäkologisch tätigen Chirurg:innen gelten sollen.
Konsensus zur Oligometastasierung
Um über therapeutische Optionen (kurativ versus palliativ) bei Oligometastasierung diskutieren zu können, musste zunächst über die Definition «Oligometastasierung bei STS» abgestimmt werden.
Die Kriterien, die favorisiert wurden, sind: Anzahl der Läsionen (knapp die Hälfte der Panelist:innen stimmten dafür), gefolgt von der Anzahl der betroffenen Organe, des Intervalls zur Primärdiagnose und der Wachstumsdynamik der Läsionen sowie schlussendlich einer Vorgeschichte von STS-Metastasen beim Patienten/bei der Patientin. Ein Konsensus konnte dahingehend erreicht werden, dass bei synchron aufgetretenen Lungenmetastasen zum Zeitpunkt der STS-Diagnose zunächst eine Verlaufsbildgebung durchgeführt werden soll, bevor eine lokale Therapie angeboten wird. Als hilfreich im Kontext der Oligometastasierung wurde der Algorithmus der European Society for Radiotherapy and Oncology und European Organisation for Research and Treatment of Cancer erachtet.6
Konsensus zur fortgeschrittenen STS-Erkrankung
Die Molekularpathologie wird immer relevanter für Therapieentscheidungen beim fortgeschrittenen STS. War bis vor Kurzem eine Anthrazyklin-Monotherapie (evtl. kombiniert mit Ifosfamid bei Therapiedruck) als Erstlinientherapie in der palliativen Situation akzeptiert, so werden zunehmend zielgerichtete Therapieansätze in der ersten und den weiteren Therapielinien gemäss molekularem Profil gefordert. Die Verfügbarkeit solcher Medikamente, die dafür aber nicht zugelassen sind, stellt eine grosse Hürde dar. Hier sind die Sarkom-Community und die Politik gefragt, eine nationale und internationale Harmonisierung des Vorgehens ist unumgänglich.
Aufgrund des Fehlens randomisierter Studien wegen der kleinen Fallzahlen werden Registerdaten, Daten zur Lebensqualität und zum «patient-reported outcome» (PRO) zur Argumentation mit den regulatorischen Behörden benötigt. Diese Schritte und Massnahmen sind, wie in unserer Konsensus-Konferenz festgestellt wurde, nur durch internationale Zusammenarbeit möglich und über Therapieprotokolle, die von akademischen Konsortien, beispielsweise der EORTC, entworfen werden.
Konklusion und Ausblick
Nicht überraschend gab es nur bei wenigen Fragen einen Konsensus (13,7%) oder gar einen klaren Konsensus (7,3%). Der positive Zugewinn, den wir aus Voten für den klinischen Alltag ableiten, ist zum Beispiel eine Verhandlungsbasis mit den Krankenkassen für eine Off-label-Therapieempfehlung. Einige verbleibende kontroverse Standpunkte können in prospektiven Studien mit internationaler Kollaboration untersucht und geklärt werden. Allen Teilnehmer:innen der Konferenz war aber klar, dass bei den Weichteilsarkomen Restfragen verbleiben, die aufgrund der Seltenheit der STS nie im Rahmen von Studien untersucht werden können.
Eine interessante Übereinstimmung fand sich bei der Suche nach standespolitischen Kriterien für Sarkomspezialist:innen der diversen Disziplinen (Qualitätskriterien). Alle Ergebnisse der Konsensus-Konferenz wurden im European Journal of Cancer 2022 publiziert.7
Auf allgemeinen Wunsch der Panelist:innen ist eine zweite Konsensus-Konferenz am 3. und 4. Mai 2024 in St. Gallen in Vorbereitung. Die Registrierung ist für Interessierte offen unter: https://www.kssg.ch/events/2024/conference-on-challenges-sarcoma-2024
Literatur:
1 de Pinieux G et al.: Nationwide incidence of sarcomas and connective tissue tumors of intermediate malignancy over four years using an expert pathology review network. PLoS One 2021; 16: e0246958 2 Soft Tissue and Bone Tumours. WHO Classification of Tumours, 5th Ed. Vol. 3, 2020 3 Gronchi A et al.: Soft tissue and visceral sarcomas: ESMOEURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2021; 32: 1348e65 4 Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): S3-Leitlinie Adulte Weichgewebesarkome, Langversion 1.1, 2022, AWMF-Registernummer: 032/044OL 5 Onkopedia Leitlinien: Weichgewebssarkome (maligne Weichgewebstumoren) des Erwachsenen. 2019 ( www.onkopedia.com ) 6 Guckenberger M et al.: Characterisation and classification of oligometastatic disease: a European Society for Radiotherapy and Oncology and European Organisation for Research and Treatment of Cancer consensus recommendation. Lancet Oncol 2020; 21(1): e18-28 7 Rothermundt C et al.: Writing committee on behalf of CSSS panellists. Controversies in the management of patients with soft tissue sarcoma: recommendations of the Conference on State of Science in Sarcoma 2022. Eur J Cancer 2023; 180: 158-79
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...