Kombinationstherapie des HCC,EGFR-Rechallenge beim Kolonkarzinom
Bericht: Dr. Judith Moser
Im Rahmen des Gastrointestinal Cancers Congress 2025 der European Society for Medical Oncology, der vom 2. bis 5. Juli 2025 in Barcelona stattfand, wurden in 34 Sessions insgesamt 426 Poster und 27 orale Abstracts präsentiert. Unter anderem belegen mehrere Analysen die Bedeutung des therapiefreien Intervalls im Zuge einer Anti-EGFR-Rechallenge beim fortgeschrittenen Kolonkarzinom.
Nichtresektables HCC: TALENTACE
Die transarterielle Chemoembolisation (TACE) gilt im Setting des hepatozellulären Karzinoms (HCC) als Therapiestandard, ihre Effektivität ist jedoch bei höherer Tumorlast eingeschränkt.1 Daher prüfte die in China und Japan durchgeführte offene, randomisierte Phase-III-Studie TALENTACE, ob die Zugabe von Atezolizumab und Bevacizumab zur On-demand-TACE beim unbehandelten, nichtresektablen HCC mit intermediärer bis hoher Tumorlast (Summenscore aus maximalem Durchmesser und Anzahl der Tumoren ≥6) die Outcomes verbessern kann.
In beiden Studienarmen wurden 171 Personen in die Analyse eingeschlossen; Patient:innen im Kontrollarm erhielten die alleinige On-demand-TACE. Als primärer Endpunkt galten das TACE-PFS (definiert als Zeit von der Randomisierung bis zu einer nicht behandelbaren Progression oder TACE-Versagen/-Refraktärität bzw. Tod aus jeglicher Ursache) sowie das Gesamtüberleben (OS).
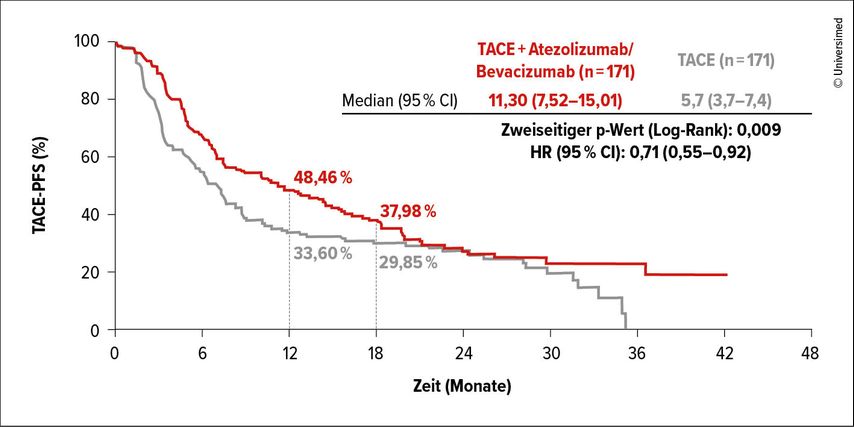
Die Zugabe der systemischen Therapie bewirkte eine statistisch signifikante und klinisch relevante Verbesserung der TACE-PFS-Rate um 29% (median: 11,3 vs. 7,03 Monate; HR: 0,71; p=0,009; Abb. 1).2 Das Zusammenlaufen der Kurven nach ca. 20 Monaten mit anschließender neuerlicher Trennung dürfte auf die pandemiebedingt hohe Zensurrate zurückgehen. Auch in Bezug auf das PFS laut RECIST (sekundärer Endpunkt) wurde eine klinisch relevante Überlegenheit der Kombination verzeichnet (10,32 vs. 6,37 Monate; HR: 0,64). Hinsichtlich der objektiven Ansprechraten (ORR) resultierten im Prüfarm Vorteile gemäß RECICL (81,3% vs. 66,7%) und RECIST (49,1% vs. 33,9%). Die OS-Daten waren zum Analysezeitpunkt noch unreif.
Abb. 1: Verlängerung des TACE-PFS unter TACE+Atezolizumab/Bevacizumab vs. alleinige TACE beim hepatozellulären Karzinom (modifiziert nach Dong J et al.)2
Das Sicherheitsprofil der Kombination entsprach den Profilen der einzelnen Komponenten und erwies sich im Allgemeinen als beherrschbar. Therapiebedingte unerwünschte Ereignisse (TRAE) der Grade 3 und 4 traten häufiger im Prüfarm auf (60,8% vs. 40,5%). Als häufigste TRAE aller Grade wurden Proteinurie (45,8% vs. 1,2%), Postembolisationssyndrom (42,8% vs. 50,3%) und AST-Erhöhungen (33,1% vs. 26,6%) gemeldet. Insgesamt legen die Ergebnisse nahe, dass Atezolizumab/Bevacizumab plus TACE eine effektive Therapieoption des unbehandelten, nichtresektablen HCC mit mittlerer und hoher Tumorlast darstellt.
Irpagratinib beimFGF19-positiven HCC
Rund 30% der HCC weisen eine Überexpression des Fibroblasten-Wachstumsfaktors 19 (FGF19) auf, die mit ungünstiger Prognose und vermindertem Ansprechen auf eine Immuncheckpoint-Inhibitor(ICI)-basierte Erstlinientherapie in Verbindung steht.3 Die Phase-II-Studie ABSK-011-201 prüft den oralen FGFR4-Inhibitor Irpagratinib in ansteigenden Dosierungen zusätzlich zu Atezolizumab beim fortgeschrittenen oder nichtresektablen, FGF19-positiven HCC. Am ESMO GI 2025 präsentierten Cheng et al. aktualisierte Ergebnisse für 33 Patient:innen, die Irpagratinib 220mg zweimal täglich plus Atezolizumab erhalten hatten.4 15 Teilnehmer:innen waren therapienaiv und 18 mit ICI vorbehandelt. Die ORR galt als primärer Endpunkt.
Nach einem medianen Follow-up von 7,1 Monaten erbrachte die Analyse eine bemerkenswerte Effektivität der Kombination. 50% der Therapienaiven und 52,9% der Vorbehandelten sprachen auf die Therapie an, meist in Form tiefer und anhaltender Remissionen. Die mediane Dauer des Ansprechens war in beiden Gruppen noch nicht erreicht worden. Eine Krankheitskontrolle resultierte in 91,7% bzw. 70,6%. Weiters wurden vielversprechende PFS-Resultate dokumentiert (medianes PFS: 7,0 bzw. 8,3 Monate).
Als häufigste AE ergab die Sicherheitsanalyse Anstiege der Transaminasen, Diarrhö, Auslenkungen der Bilirubinspiegel und Hyperphosphatämie. Keine:r der Teilnehmer:innen entwickelte AE der Grade 4 oder 5, und niemand brach die Therapie aufgrund von TRAE ab. Alle Grad-3-Ereignisse bezogen sich auf Veränderungen von Laborparametern (Anstiege von ALT, alkalischer Phosphatase, Kreatinin; Abnahme der Leukozytenzahl). Die Kombination von Irpagratinib mit Atezolizumab bewirkte im Vergleich zu historischen Daten keine Zunahme immunbezogener AE. Derzeit werden klinische Studien auf den Weg gebracht, die Irpagratinib bei ICI-vorbehandelten Patient:innen zusätzlich zu einem ICI bzw. als Teil einer Tripelkombination im Erstlinien-Setting untersuchen.
PARERE: ctDNA-gesteuerteAnti-EGFR-Reinduktion
Bei Patient:innen mit RAS-/BRAF-negativem metastasiertem kolorektalem Karzinom (mCRC) stellt die Reinduktion EGFR-gezielter Therapien eine vielversprechende Strategie dar, um das Behandlungskontinuum auszudehnen.
Die randomisierte, offene Phase-II-Studie PARERE widmete sich der Frage, ob eine Verbesserung der Patient:innenselektion mittels Liquid Biopsy möglich ist, da auf diese Weise Personen mit Resistenzmutationen laut zirkulierender Tumor-DNA (ctDNA) ausgeschlossen werden können. Es nahmen Patient:innen mit mCRC und RAS-/BRAF-Wildtyp teil, die auf eine Anti-EGFR-haltige Erstlinientherapie zumindest mit einem partiellen Ansprechen oder Krankheitsstabilisierung über ≥6 Monate angesprochen hatten.
Weitere Einschlusskriterien umfassten unter anderem mindestens eine Anti-EGFR-freie Folgetherapie und ein Intervall von ≥4 Monaten zwischen dem Ende der EGFR-gezielten Behandlung und dem Screening. Randomisiert wurde entweder Panitumumab oder Regorafenib bis zur ersten Progression verabreicht. Danach erhielten die Patient:innen das jeweils andere Medikament bis zur zweiten Progression.
Die Liquid Biopsy ermöglichte vor der Randomisierung die Detektion von RAS- und BRAF-Mutationen laut ctDNA bei 38% der Patient:innen, die ansonsten als eligibel für die Rechallenge eingestuft worden wären.5 In dieser Gruppe war das Intervall zwischen der letzten Anti-EGFR-Gabe in der Erstlinie und der Liquid Biopsy signifikant kürzer als im tatsächlich RAS-/BRAF-negativen Kollektiv (11,2 vs. 14,3 Monate; p=0,004). Arm A (Panitumumab gefolgt von Regorafenib) enthielt schließlich 106 Personen, Arm B (Regorafenib gefolgt von Panitumumab) 107.
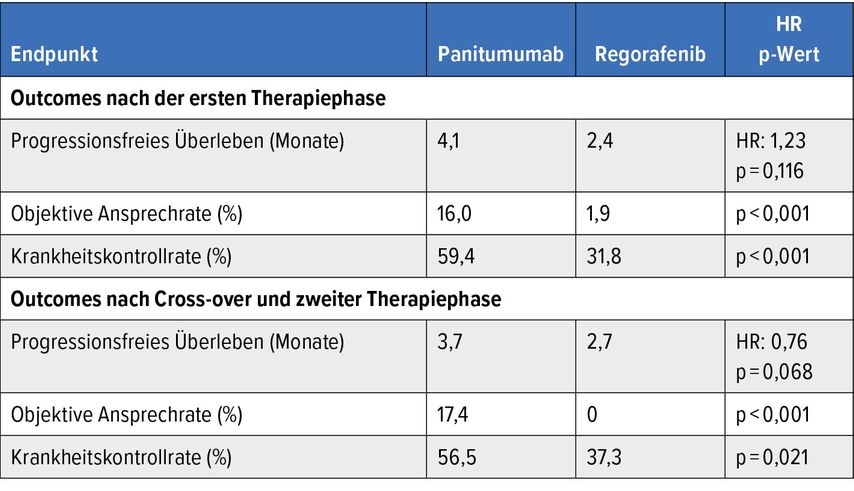
Unabhängig von der Sequenz bedingte Panitumumab bessere Outcomes als Regorafenib (Tab.1). Laut Subgruppenanalysen ging ein Intervall von >6 Monaten seit der letzten Anti-EGFR-Gabe in der Erstlinie mit einem höheren PFS-Benefit durch Panitumumab als erste Komponente der Sequenz einher, ansonsten fanden sich keine signifikant prädiktiven klinischen Marker. Das Sicherheitsprofil entsprach den bisherigen Erfahrungen.
Tab. 1: PARERE: Outcomes unter Rechallenge mit Panitumumab vs. Regorafenib beim mCRC (ITT-Population) (modifiziert nach Ciraci P et al.)5
Den Autor:innen zufolge ist die ctDNA-gesteuerte Reinduktion mit Panitumumab eine effektive therapeutische Option bei selektierten Patient:innen mit chemorefraktärem mCRC und RAS-/BRAF-Wildtyp.
Rechallenge im Real-World-Setting
Auch eine retrospektive Real-World-Analyse aus Spanien zur Anti-EGFR-Rechallenge weist das therapiefreie Intervall als relevanten Faktor aus.6 134 Patient:innen mit RAS-/BRAF-negativem mCRC, die unter einer vorangegangenen EGFR-gerichteten Behandlung mindestens sechs Monate progressionsfrei geblieben waren und ≥4 Monate keine EGFR-Antikörper mehr erhalten hatten, wurden eingeschlossen. In 55% der Fälle waren zwei Therapielinien verabreicht worden und in 31% drei. Resistenzmutationen lagen bei 30% vor. Das Rechallenge-Regime bestand bei 77% aus einer Anti-EGFR/Chemotherapie-Kombination und bei 23% aus einer EGFR-gerichteten Monotherapie.
In der Gesamtgruppe bewirkte die Behandlung eine ORR von 26%, ein medianes PFS von 5,7 Monaten, ein medianes OS von 14,9 Monaten und eine Krankheitskontrollrate (DCR) von 68%. Die Subpopulation nach einem Anti-EGFR-therapiefreien Intervall von >10,4 Monaten zeigte im Vergleich zur Gruppe mit kürzeren Intervallen Überlegenheit im Bereich von PFS (6 vs. 2,8 Monate; HR: 0,42; p=0,001), OS (16,6 vs. 5,7 Monate; HR: 0,23; p<0,001) und DCR (77% vs. 29%; p<0,001). Ebenso schnitten Patient:innen, die unter der vorangegangenen EGFR-gerichteten Therapie ein medianes PFS von >20 Monaten erzielt hatten, besser ab als jene mit kürzer anhaltendem Behandlungsbenefit (PFS: 16,3 vs. 14,2 Monate; HR: 0,51; p=0,01; DCR: 88% vs. 62%; p=0,04).
OrigAMI-1:Amivantamab nach EGFR-Versagen
Nach dem Absetzen von Anti-EGFR-Substanzen werden RAS- und EGFR-mutierte Klone im Körper abgebaut, wobei die Halbwertszeit für den mutativen Zerfall („mutational decay“, MD) rund 4,4 Monate beträgt.7
Arnold et al. präsentierten Daten zum Einsatz des EGFR-/MET-gerichteten bispezifischen Antikörpers Amivantamab in der Kohorte B der Phase-IB/II-Studie OrigAMI-1.8 Diese Patient:innen wiesen ein linksseitiges mCRC auf, hatten 2–3 Therapielinien erhalten und eine Progression unter der Anti-EGFR-Behandlung erlitten. In Abhängigkeit vom Intervall seit der Beendigung der EGFR-gezielten Therapie wurden zwei Gruppen evaluiert: Bei der einen betrug die Therapiepause ≤2 MD-Halbwertszeiten, d.h. rund 8,8 Monate (n=29), bei der anderen überstieg sie diese Grenze (n=25).
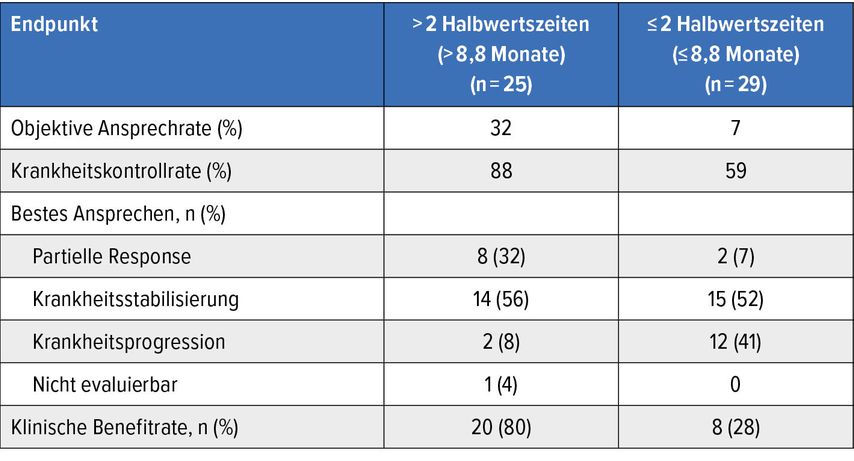
Amivantamab legte vielversprechende Antitumoraktivität an den Tag. Nach einem medianen Follow-up von 13,7 Monaten belief sich die als primärer Endpunkt definierte ORR in der Gesamtgruppe auf 19% und die DCR auf 72%. Die Population mit dem längeren therapiefreien Intervall schnitt in Bezug auf beide Endpunkte besser ab (Tab.2). Insgesamt lagen das mediane PFS und OS bei 4,6 bzw. 14,0 Monaten. Vorteile nach dem längeren Intervall im Vergleich zum kürzeren fanden sich auch hinsichtlich des PFS (7,0 vs. 2,8 Monate; HR: 0,48; p=0,0081) und des OS (16,1 vs. 10,4 Monate; HR: 0,56; p=0,0878). Ein dokumentiertes Ansprechen auf eine EGFR-gezielte Substanz in der rezentesten Therapielinie war mit numerischen Verbesserungen von ORR, DCR und PFS assoziiert.
Tab. 2: Ansprechen auf Amivantamab nach mCRC-Progression in Abhängigkeit vom therapiefreien Intervall (Halbwertszeiten für den mutativen Zerfall) (modifiziert nach Arnold D et al.)8
Olaparib beim HRR-defizienten Gallengangskarzinom
Die ACCRU-ICRN-1702-Studie wurde initiiert, um den PARP-Inhibitor Olaparib im Setting des fortgeschrittenen Gallengangskarzinoms mit homologer Rekombinationsreparatur(HRR)-Defizienz zu testen. Vor Studieneinschluss hatten die Patient:innen zumindest eine Chemotherapielinie erhalten, weiters wiesen sie somatische Varianten im Zusammenhang mit der HRR oder Tumoren mit homologer Rekombinationsdefizienz auf.
In der Gruppe der ersten 30 evaluierbaren Personen waren 22 (73,3%) zum Zeitpunkt des ersten Restagings nach ca. acht Wochen progressionsfrei (primärer Endpunkt).9 Die gemessene ORR betrug 6,5% und die DCR 74,2%; das mediane OS und PFS lagen bei 11,2 Monaten bzw. 16,7 Wochen. Olaparib zeichnete sich durch eine hohe Verträglichkeit mit niedrigen TRAE-Raten aus. TRAE der Grade 3/4 umfassten Zytopenien, Fatigue und Transaminasenauslenkungen.
Wie die Autor:innen festhielten, stellt die PARP-Inhibition eine potenzielle Therapieoption beim HRR-defizienten fortgeschrittenen BTC dar.
CLDN18.2-positives Magenkarzinom/GEJ: Givastomig
Beim HER2-negativen, CLDN18.2-positiven Magenkarzinom und Adenokarzinom des Ösophagus oder gastroösophagealen Übergangs untersucht eine Phase-IB-Dosiseskalationsstudie den gegen CLDN18.2 und 4-1BB gerichteten bispezifischen Antikörper Givastomig in Kombination mit Nivolumab und FOLFOX.10 Die Patient:innen haben zuvor noch keine systemische Therapie aufgrund ihrer nichtresektablen oder metastasierten Erkrankung erhalten. Im Hinblick auf die PD-L1-Expression handelt es sich um eine All-Comer-Population. Klempner et al. stellten am ESMO GI Daten zu den drei Dosisgruppen vor, die mit Givastomig 5mg/kg (n=5), 8mg/kg (n=6) oder 12mg/kg (n=6) behandelt worden waren.
Die Kombination aus dem bispezifischen Antikörper und der Chemoimmuntherapie zeigte hohe Verträglichkeit. Es wurden keine dosislimitierenden Toxizitäten verzeichnet; TRAE bedingten bei 24% Therapiepausen und bei 12% eine Beendigung der Behandlung. Als häufigste AE aller Grade fanden sich Neutropenie (71%), periphere Neuropathie (59%) und Übelkeit (53%), wobei die Grad-3-Ereignisrate insgesamt niedrig war und Grad-4-Ereignisse nur im Zusammenhang mit Neutropenien auftraten (12%). Ebenso manifestierten sich immunassoziierte AE nur selten und wurden fast ausschließlich als niedriggradig klassifiziert.
Das Schema legte vielversprechende präliminäre Wirksamkeit an den Tag. 71% der Patient:innen entwickelten unabhängig vom Ausmaß der CLDN18.2- und PD-L1-Expression ein objektives Ansprechen. Die ORR unter den beiden höheren Dosen, die aktuell in der Expansionsphase evaluiert werden, betrug 83%. Das Ansprechen trat rasch ein und hielt lange an. Zum Analysezeitpunkt waren die mediane Res-ponsedauer ebenso wie das mediane PFS noch nicht erreicht worden. Nach sechs Monaten wiesen 72,9% aller Patient:innen sowie 81,5% jener in den 8mg- und 12mg-Gruppen Progressionsfreiheit auf.
Gegenwärtig ist die Rekrutierung der Expansionskohorten in der 8mg-Gruppe abgeschlossen und befindet sich in der 12mg-Gruppe im Laufen.
Quelle:
European Society for Medical Oncology (ESMO) Gastrointestinal Cancers Congress 2025, 2.–5. Juli 2025, Barcelona, Spanien
Literatur:
1 Wang Q et al.: Development of a prognostic score for recommended TACE candidates with hepatocellular carcinoma: a multicentre observational study. J Hepatol 2019; 70(5): 893-903 2 Dong J et al.: TALENTACE: a phase III, open-label, randomized study of on-demand transarterial chemoembolization (TACE) combined with atezolizumab + bevacizumab (Atezo+Bev) or on-demand TACE alone in patients with systemically untreated, intermediate-to-high burden unresectable hepatocellular carcinoma (uHCC). ESMO GI 2025; Abstr. #LBA2 3 Zhao X et al.: Combined inhibition of FGFR4 and VEGFR signaling enhances efficacy in FGF19 driven hepatocellular carcinoma. Am J Cancer Res 2022; 12(6): 2733-43 4 Cheng Q et al.: Irpagratinib (ABSK-011) plus atezolizumab in first-line (1L) and immune checkpoint inhibitors (ICIs) treated advanced hepatocellular carcinoma (HCC) with FGF19 overexpression (+): updated results of the phase 2 ABSK-011-201 study. ESMO GI 2025; Abstr. #149MO 5 Ciraci P et al.: Liquid biopsy-guided selection for anti-EGFR re-treatment in RAS/BRAF wild-type (wt) chemorefractory metastatic colorectal cancer patients (mCRC pts): results from the phase II randomized PARERE trial. ESMO GI 2025; Abstr. #4O 6 Baselga PM et al.: Real-world outcomes of anti-EGFR rechallenge in RAS/BRAF wild-type (wt) metastatic colorectal cancer (mCRC). ESMO GI 2025; Abstr. #42P 7 Parseghian CM et al.: Combined inhibition of FGFR4 and VEGFR signaling enhances efficacy in FGF19 driven hepatocellular carcinoma. Ann Oncol 2019; 30(2): 243-9 8 Arnold D et al.: Rechallenge with amivantamab, an EGFR-MET bispecific antibody, after disease progression on prior EGFR inhibitor in left-sided RAS/BRAF wild-type metastatic colorectal cancer: updated results from OrigAMI-1. ESMO GI 2025; Abstr. #6MO 9 Ahn DH et al.: A phase II study of olaparib in patients (pts) with advanced biliary tract cancer (aBTC) with aberrant homologous recombinant repair (HRR) mutations. ESMO GI 2025; Abstr. #261MO 10 Klempner SJ et al.: Preliminary safety and efficacy of givastomig, a novel claudin 18.2/4-1BB bispecific antibody, in combination with nivolumab and mFOLFOX in metastatic gastroesophageal carcinoma (mGEC). ESMO GI 2025; Abstr. #388MO
Das könnte Sie auch interessieren:
Erhaltungstherapie mit Atezolizumab nach adjuvanter Chemotherapie
Die zusätzliche adjuvante Gabe von Atezolizumab nach kompletter Resektion und adjuvanter Chemotherapie führte in der IMpower010-Studie zu einem signifikant verlängerten krankheitsfreien ...
Highlights zu Lymphomen
Assoc.Prof. Dr. Thomas Melchardt, PhD zu diesjährigen Highlights des ASCO und EHA im Bereich der Lymphome, darunter die Ergebnisse der Studien SHINE und ECHELON-1
Aktualisierte Ergebnisse für Blinatumomab bei neu diagnostizierten Patienten
Die Ergebnisse der D-ALBA-Studie bestätigen die Chemotherapie-freie Induktions- und Konsolidierungsstrategie bei erwachsenen Patienten mit Ph+ ALL. Mit einer 3-jährigen ...